仁爱版初中化学九年级下册专题7 《初识酸、碱和盐》检测题(含答案)
文档属性
| 名称 | 仁爱版初中化学九年级下册专题7 《初识酸、碱和盐》检测题(含答案) |  | |
| 格式 | zip | ||
| 文件大小 | 131.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 仁爱科普版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-05-17 21:52:08 | ||
图片预览


文档简介
《初识酸、碱和盐》检测题
一、单选题
1.下列各组离子在溶液中一定能大量共存的是( )
A.Na+、K+、Cl- B.Ca2+、Na+、CO32- C.H+、Ca2+、OH- D.NH4+、OH-、SO42-
2.下列实验不能达到目的的是( )
A.用MnO2鉴别的5%过氧化氢溶液和蒸馏水
B.用加熟石灰研磨的方法区别氯化铵和硫酸铵
C.用火星的木条鉴别CO2和O2
D.用足量的稀硫酸除去碳粉中的氧化铜
3.下列实验设计正确的是 ( )
A.用肥皂水区分CaCl2和MgCl2溶液 B.用氢氧化钠溶液吸收CO2中的少量HCl
C.用KMnO4溶液区分SO2和CO2 D.用淀粉溶液检验是否为加碘盐
4.今天妈妈做了小江最爱吃的鱼,但吃起来怎么苦呢?原来妈妈剖鱼时,一不小心把鱼胆弄破了,鱼胆弄破后鱼肉会沾上难溶于水的胆汁酸(一种酸)而变苦,要减少这种苦味,用来洗涤鱼的最佳物质是
A.水 B.纯碱 C.食盐 D.食醋
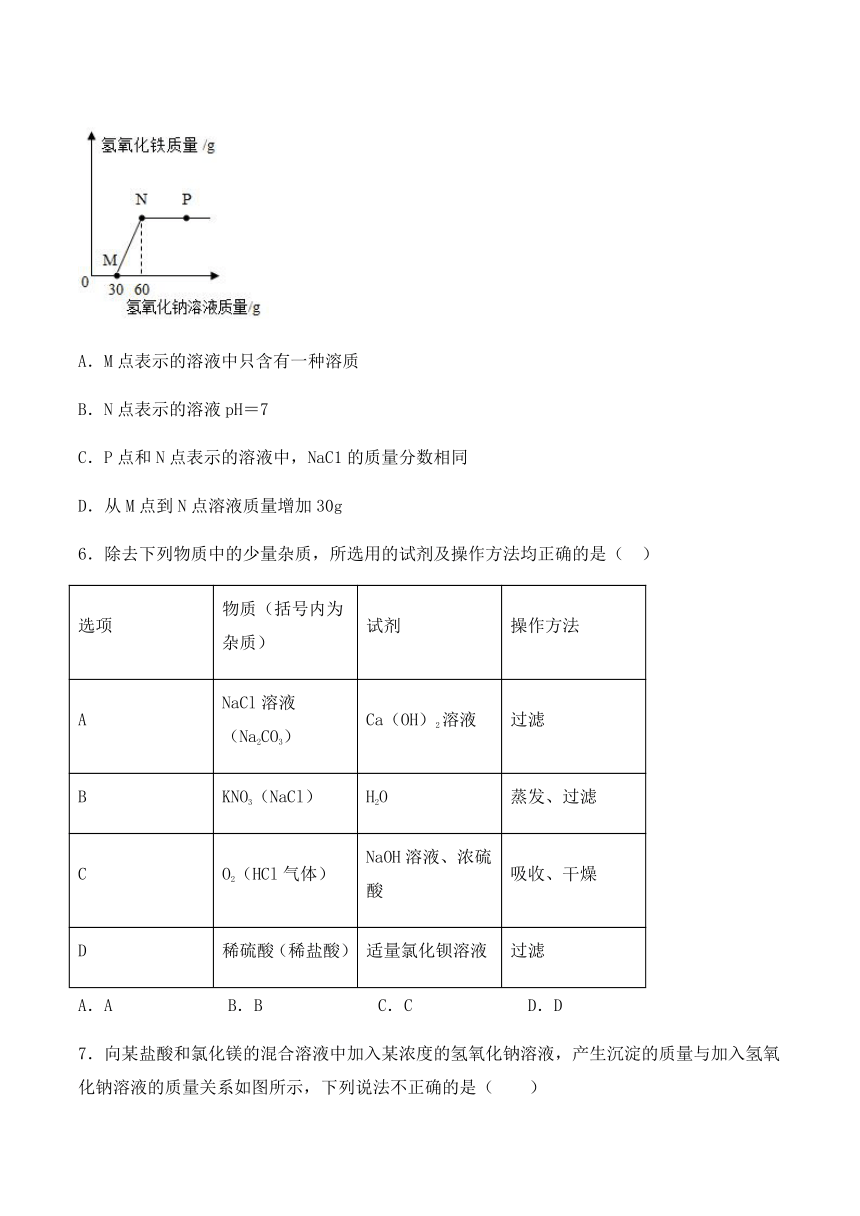
5.向一定量盐酸和氯化铁溶液的混合物中逐滴加入氢氧化钠溶液,产生沉淀的质量与加入氢氧化钠溶液的质量关系如图所示。下列说法正确的是( )
A.M点表示的溶液中只含有一种溶质
B.N点表示的溶液pH=7
C.P点和N点表示的溶液中,NaC1的质量分数相同
D.从M点到N点溶液质量增加30g
6.除去下列物质中的少量杂质,所选用的试剂及操作方法均正确的是( )
选项 物质(括号内为杂质) 试剂 操作方法
A NaCl溶液(Na2CO3) Ca(OH)2溶液 过滤
B KNO3(NaCl) H2O 蒸发、过滤
C O2(HCl气体) NaOH溶液、浓硫酸 吸收、干燥
D 稀硫酸(稀盐酸) 适量氯化钡溶液 过滤
A.A B.B C.C D.D
7.向某盐酸和氯化镁的混合溶液中加入某浓度的氢氧化钠溶液,产生沉淀的质量与加入氢氧化钠溶液的质量关系如图所示,下列说法不正确的是( )
A.a点溶液中滴入紫色石蕊试液变红 B.bd段的现象是白色沉淀不断增多
C.整个变化过程中氯离子数目没有改变 D.d点溶液中含有两种溶质
8.工业上常用高温煅烧石灰石的方法来制得生石灰,发生的反应为CaCO3CaO+CO2↑.现取一定量的石灰石样品进行煅烧(假设杂质质量不变)。某变量y随时间的变化趋势如图所示,则纵坐标表示的是( )
A.生成CO2的体积 B.生成CaO的质量
C.固体中杂质的质量分数 D.固体中氧元素的质量
9.下列实验现象和对应的结论描述都正确的是
A.某化肥中加熟石灰研磨,未闻到氨臭味,该化肥一定不是氮肥
B.生石灰块投入水中,水会沸腾——生石灰变成熟石灰的过程是放热过程
C.在无色溶液中滴入酚酞试液,溶液变红——该溶液一定是碱溶液
D.向饱和硫酸铵溶液中加入鸡蛋清,产生白色絮状沉淀——蛋白质变性
10.下列实验操作正确的是
A.液体的量取 B.称取氯化钠
C.稀释浓硫酸 D.测定溶液PH
11.溶洞中存在的反应:CaCO3+CO2+H2O→(CaHCO3)2此反应属于( )
A.化合反应 B.分解反应 C.置换反应 D.复分解反应
12.敞口放置的浓硫酸和浓盐酸,一段时间后,溶液的质量、溶质的质量分数将发生变化。下列说法正确的是 ( )
A.溶液的质量都增加,质量分数都减小
B.溶液的质量都减小,质量分数都增加
C.溶液的质量前一个增加,后一个减小,质量分数都减小
D.溶液的质量前一个减小,后一个增加,质量分数都增加
13.衣服上沾了铁锈(主要成分是Fe2O3),直接用水很难洗净,要除去白色衬衣上的铁锈,你认为比较适宜的液体是
A.白醋 B.酱油 C.酒精 D.洗洁精
二、实验题
14.实验室常用的干燥剂“碱石灰”是CaO和固体NaOH的混合物,极易与空气中水蒸汽和CO2反应而变质。某同学对一瓶久置的“碱石灰”作了如下探究:
(1)(猜想)猜想Ⅰ:没有变质,“碱石灰”只含有CaO、固体NaOH;
猜想Ⅱ:已完全变质,“碱石灰”全部变成了CaCO3和Na2CO3。
则CaO与水反应的反应方程式为___________________________________。
(2)(实验)如下图所示:
(3)(判断)
a.若Ca(OH)2、CaCO3和Na2CO3投入到水中不会放热,则由操作②现象判断:猜想Ⅱ________(填:成立、不成立)
b.操作④发生化学反应的方程式为_________________________;由操作⑤⑥的现象判断:滤液中含
有_________(写化学式);由此判断猜想Ⅰ________(填:成立、不成立)。
c.综合a和b的结论,判断该样品变质情况为_____________________。
(4)(拓展)由上述实验说明,实验室中“碱石灰”应______保存;操作③中玻棒的作用是_________________________________________。
15.某小组在探究铁、铜、镁、银的金属活动性顺序时,做了如下三个实验(所用金属的形状与大小和稀盐酸的用量均相同):
①通过实验 I 和 II 可比较出镁和铁的金属活动性强弱。他们依据的实验现象是_____。
②通过观察到实验III 的现象可得出的结论是_____,该反应的化学方程式为_____。
③上述三个实验不能够得出四种金属的活动性顺序。探究小组在上述实验的基础上,补充了一个实验(如图所示),实现了探究目的。他们实验所用金属 X、Y 溶液分别是_____。
④小组同学又将一定量的锌粉加入含有 AgNO3、Cu(NO3)2、Mg(NO3)2 的混合溶液中,充分反应后过滤,得到了一定量的固体和无色的滤液。则固体中一定含有_____,滤液中一定含有的溶质是_____(填化学式)。
三、推断题
16.构建知识网络是学习化学的重要方法,下图是不同物质间相互转化关系图。其中 A、B、C、D属于不同类别的物质,且都含有铜元素。“→”表示一种物质一步转化成另一种物质(部分反应物、生成物及反应条件未标出),请回答问题:
(1)B的化学式_______;
(2)写出D生成A的化学方程式________。
17.如下图所示:A~F均为初中化学中的六种常见物质,其中A为红棕色,C在常温下为气体,D属于难溶性物质,F为化合物。“——”表示相邻物质在一定条件下能发生化学反应,“→”表示物质间能够转化(反应都进行完全;条件和部分物质都已略去)。
(1)书写物质的化学式:A______________,D__________________。
(2)④反应的实验现象:__________________________________________.
(3)③反应的基本类型:__________________________________________________.
(4)完成②化学方程式:____________________________________________________.
四、计算题
18.课外活动小组的同学在测定由NaCl和Na2CO3形成的固体混合物组成时,进行了以下实验:取40 g固体混合物配成溶液,平均分为四份,然后分别加入一定质量分数的CaCl2溶液,实验数据见下表:
实验一 实验二 实验三 实验四
原固体混合物质量 10g 10g 10g 10g
加入CaCl2溶液质量 10g 20g 30 40g
生成的沉淀的质量 2g m 5g 5g
请分析表中数据回答并计算[(4)要求写计算过程 ]
(1)生成的沉淀是(填写化学式)________。
(2)10g原固体混合物配成的溶液和足量CaCl2溶液反应,最多生成沉淀质量为_____g。
(3)m=_________g。
(4)原固体混合物中NaCl的质量分数是多少_____________?
19.现有部分被氧化的铜粉固体混合物,先加热完全氧化后,再加入的稀硫酸恰好完全反应,求固体混合物中铜元素的质量分数。(计算结果精确到0.1%)
20.现有一包Na2CO3和NaOH固体样品,为了测定Na2CO3的质量分数,取该样品20g,加水搅拌至全部溶解.然后逐滴加入稀盐酸至过量,测得生成气体质量与所加稀盐酸质量关系如图所示。请计算:
(1)生成气体的质量____;
(2)该样品中Na2CO3的质量分数____;
(3)所用稀盐酸溶质的质量分数____.
参考答案
1.A 2.B 3.C 4.B 5.B 6.C 7.D 8.C 9.B 10.C 11.A 12.C 13.A
14.CaO + H2O= Ca(OH)2 不成立 CaCO3+ 2HCl =CaCl2+ H2O + CO2↑ . Na2CO3 不成立 部分变质 密封 引流
15.实验Ⅱ比实验Ⅰ反应剧烈 铜比银活泼 Cu+2AgNO3→2Ag+Cu(NO3)2 Fe/CuSO4(或Cu/H2SO4) Ag、Cu Zn(NO3)2、Mg(NO3)2
16.CuO Cu(NO3)2+ 2NaOH == Cu(OH)2↓+ 2NaNO3
17. 固体逐渐溶解,溶液逐渐变为浅绿色,有气泡产生 复分解反应
18.CaCO3 5 4 47%
19.86.5%
20.4.4g 53% 10%
