1.2 有机化合物中碳原子的成键特点-天津市2020年空中课堂人教版高中化学选修五课件(共17张PPT)
文档属性
| 名称 | 1.2 有机化合物中碳原子的成键特点-天津市2020年空中课堂人教版高中化学选修五课件(共17张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 35.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-05-19 00:00:00 | ||
图片预览




文档简介
(共17张PPT)
高二年级 化学
选修五 第一章 第二节 第一课时
有机化合物的结构特点
---有机化合物中碳原子的成键特点
学习目标
1.能概括常见有机化合物中碳原子的成键特点
2.能结合碳原子的杂化,描述甲烷、乙烯、
乙炔的分子结构特征
3.初步掌握共价键的性质
同学们,咱们九年级和高一化学《必修2》学习过,有机物主要由C、H、O、N、S等元素组成,但有机物构成的种类却是成千上万。人们逐渐认识到这与有机物的组成与结构息息相关。
今天我们要研究有机物的最主要元素—碳元素的原子结构,并揭开有机物种类繁多的“奥秘”。
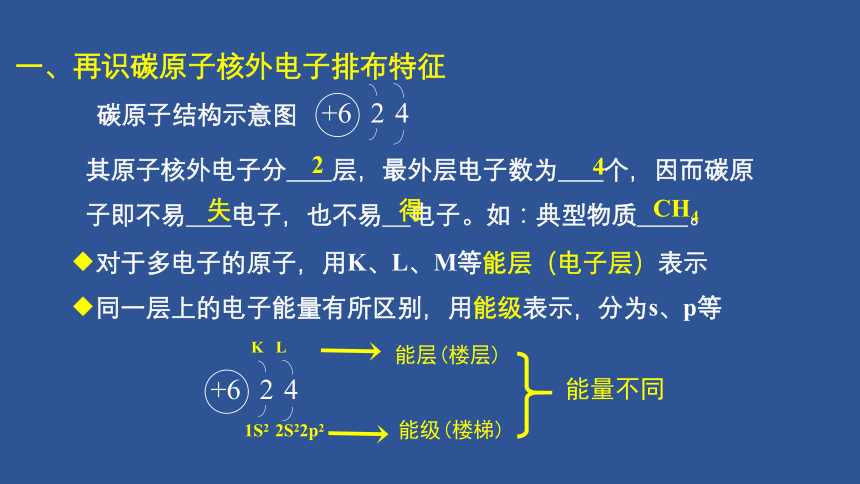
碳原子结构示意图
其原子核外电子分 层,最外层电子数为 个,因而碳原子即不易 电子,也不易 电子。如:典型物质 。
CH4
◆对于多电子的原子,用K、L、M等能层(电子层)表示
◆同一层上的电子能量有所区别,用能级表示,分为s、p等
K L
1S2 2S22p2
能量不同
一、再识碳原子核外电子排布特征
得
失
4
2
2
4
+6
2
4
+6
能层(楼层)
能级(楼梯)
S能级: 1个轨道
P能级: 3个轨道
碳原子的外围电子发生变化:
2S22p2 2S12px12py12pz1
基态 激发态 轨道杂化
K L
1S2 2S22p2
2
4
+6
能层(楼层)
能级(楼梯)
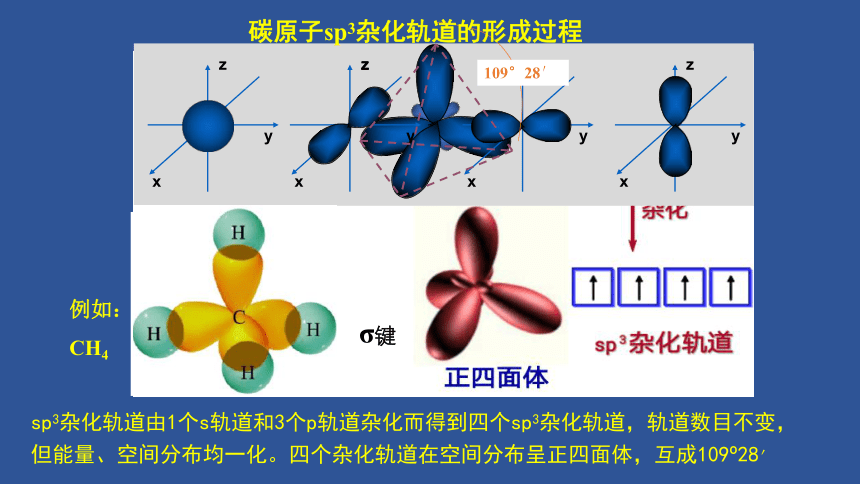
例如:
CH4
x
y
z
x
y
z
z
x
y
z
x
y
z
109°28′
sp3杂化轨道由1个s轨道和3个p轨道杂化而得到四个sp3杂化轨道,轨道数目不变,
但能量、空间分布均一化。四个杂化轨道在空间分布呈正四面体,互成109?28′
碳原子sp3杂化轨道的形成过程
σ键
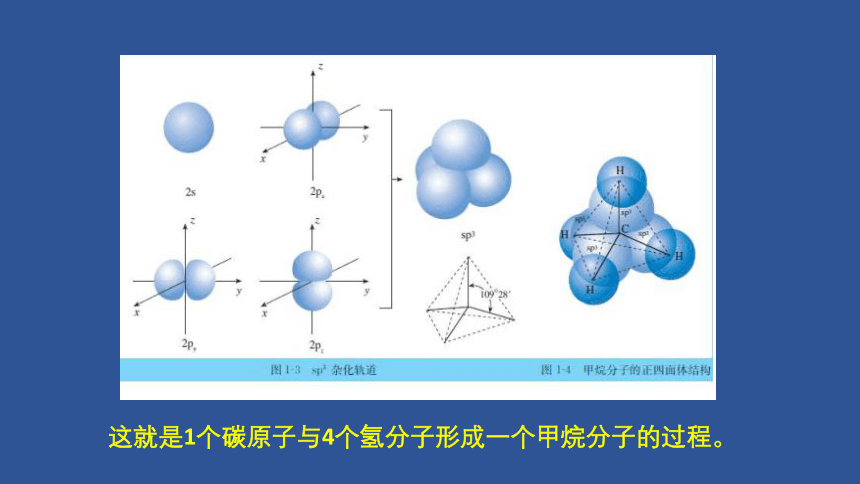
这就是1个碳原子与4个氢分子形成一个甲烷分子的过程。
小结1:碳原子与其它原子形成4个共价键
思 考:依据CH4结构特征,分析将其两个H原子
被两个Cl原子取代后的产物即CH2Cl2分子
会有几种空间结构?
(展示甲烷球棍模型)
下边我们来研究C2H4的形成
SP2杂化
x
y
z
x
y
z
z
x
y
z
x
y
z
120°
例如:
C2H4
sp2杂化轨道由1个s轨道和2个p轨道杂化,得到三个sp2杂化轨道,杂化前后轨道数目不变,但能量、空间分布均一化。三个杂化轨道在空间分布是在同一平面上,互成120?
★关于共价键:
键长:成键的2个原子原子核间的距离
键能:共价键结合的双原子裂解为原子
时吸收的能量。
键角:共价键之间的夹角。
CH4分子构型:正四面体形,键角109 ?28’
小结2:碳原子与其它原子形成4个共价键,可形成单键、双键、
三键,从碳原子角度看,一定是形成了4个共价键。
CH4分子:
四个共价键
是完全等同的单键
均为σ键(可旋转)
C2H4分子:
六个共价键
5个σ键,1个π键
(π键不可旋转)
σ键
σ键
1个σ键
1个π键
σ键
σ键
σ键
σ键
σ键
σ键
拓展提升:思考乙炔分子结构、推断分子构型。
1.有机化合物的碳原子成键特点?
2.甲烷、乙烯中碳的杂化区别?
3.共价键的键长、键能决定共价键的强弱吗?
思考:以下问题解决了吗?
一定条件下:卤化氢的共价键数据
你能得到什么信息?
键 键长/pm 键能/(kJ·mol-1)
H-F 92 568
H-Cl 127 431.8
H-Br 142 366
H-I 161 298.7
课后作业:
一、课后作业: p11-1.
课后作业:
二、选做:
1.动手实践:用牙签、橡皮泥制作甲烷、乙烯分子
球棍模型,体会单键可旋转、双键不能旋转的特点。
2.阅读理解:选修三p4~5及p28~31,巩固本节内容
高二年级 化学
选修五 第一章 第二节 第一课时
有机化合物的结构特点
---有机化合物中碳原子的成键特点
学习目标
1.能概括常见有机化合物中碳原子的成键特点
2.能结合碳原子的杂化,描述甲烷、乙烯、
乙炔的分子结构特征
3.初步掌握共价键的性质
同学们,咱们九年级和高一化学《必修2》学习过,有机物主要由C、H、O、N、S等元素组成,但有机物构成的种类却是成千上万。人们逐渐认识到这与有机物的组成与结构息息相关。
今天我们要研究有机物的最主要元素—碳元素的原子结构,并揭开有机物种类繁多的“奥秘”。
碳原子结构示意图
其原子核外电子分 层,最外层电子数为 个,因而碳原子即不易 电子,也不易 电子。如:典型物质 。
CH4
◆对于多电子的原子,用K、L、M等能层(电子层)表示
◆同一层上的电子能量有所区别,用能级表示,分为s、p等
K L
1S2 2S22p2
能量不同
一、再识碳原子核外电子排布特征
得
失
4
2
2
4
+6
2
4
+6
能层(楼层)
能级(楼梯)
S能级: 1个轨道
P能级: 3个轨道
碳原子的外围电子发生变化:
2S22p2 2S12px12py12pz1
基态 激发态 轨道杂化
K L
1S2 2S22p2
2
4
+6
能层(楼层)
能级(楼梯)
例如:
CH4
x
y
z
x
y
z
z
x
y
z
x
y
z
109°28′
sp3杂化轨道由1个s轨道和3个p轨道杂化而得到四个sp3杂化轨道,轨道数目不变,
但能量、空间分布均一化。四个杂化轨道在空间分布呈正四面体,互成109?28′
碳原子sp3杂化轨道的形成过程
σ键
这就是1个碳原子与4个氢分子形成一个甲烷分子的过程。
小结1:碳原子与其它原子形成4个共价键
思 考:依据CH4结构特征,分析将其两个H原子
被两个Cl原子取代后的产物即CH2Cl2分子
会有几种空间结构?
(展示甲烷球棍模型)
下边我们来研究C2H4的形成
SP2杂化
x
y
z
x
y
z
z
x
y
z
x
y
z
120°
例如:
C2H4
sp2杂化轨道由1个s轨道和2个p轨道杂化,得到三个sp2杂化轨道,杂化前后轨道数目不变,但能量、空间分布均一化。三个杂化轨道在空间分布是在同一平面上,互成120?
★关于共价键:
键长:成键的2个原子原子核间的距离
键能:共价键结合的双原子裂解为原子
时吸收的能量。
键角:共价键之间的夹角。
CH4分子构型:正四面体形,键角109 ?28’
小结2:碳原子与其它原子形成4个共价键,可形成单键、双键、
三键,从碳原子角度看,一定是形成了4个共价键。
CH4分子:
四个共价键
是完全等同的单键
均为σ键(可旋转)
C2H4分子:
六个共价键
5个σ键,1个π键
(π键不可旋转)
σ键
σ键
1个σ键
1个π键
σ键
σ键
σ键
σ键
σ键
σ键
拓展提升:思考乙炔分子结构、推断分子构型。
1.有机化合物的碳原子成键特点?
2.甲烷、乙烯中碳的杂化区别?
3.共价键的键长、键能决定共价键的强弱吗?
思考:以下问题解决了吗?
一定条件下:卤化氢的共价键数据
你能得到什么信息?
键 键长/pm 键能/(kJ·mol-1)
H-F 92 568
H-Cl 127 431.8
H-Br 142 366
H-I 161 298.7
课后作业:
一、课后作业: p11-1.
课后作业:
二、选做:
1.动手实践:用牙签、橡皮泥制作甲烷、乙烯分子
球棍模型,体会单键可旋转、双键不能旋转的特点。
2.阅读理解:选修三p4~5及p28~31,巩固本节内容
