2.1 炔烃和脂肪烃的来源及应用-天津市2020年空中课堂人教版高中化学选修五课件(共42张PPT)
文档属性
| 名称 | 2.1 炔烃和脂肪烃的来源及应用-天津市2020年空中课堂人教版高中化学选修五课件(共42张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 4.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-05-19 00:00:00 | ||
图片预览








文档简介
(共42张PPT)
第二章 第一节 脂肪烃
——炔烃和脂肪烃的来源及应用
高二年级 化学
三、炔烃
乙炔分子中的碳原子发生sp杂化,2个碳原子各以1个杂化轨道与氢原子形成1个碳氢δ共价键。2个碳原子之间以另一个sp杂化轨道形成1个碳碳δ共价键,未参加杂化的p轨道形成2个π键, π键易断裂。
——乙炔
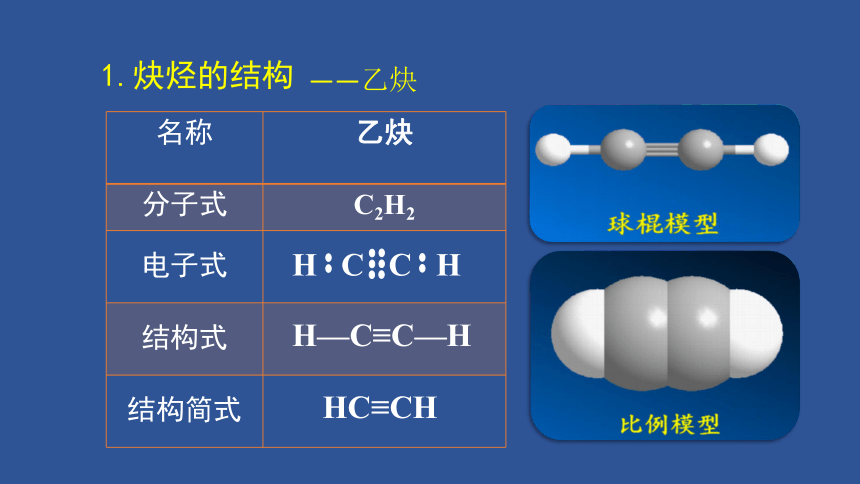
1.炔烃的结构
名称 乙炔
分子式 C2H2
电子式
结构式
结构简式
H—C≡C—H
HC≡CH
——乙炔
1.炔烃的结构
H C C H
(1)炔烃分子中的碳碳叁键为直线型结构,决定至少四 个原子共直线;
(2)炔烃分子的通式:CnH2n-2(n≥2,正整数)。
1.炔烃的结构
①乙炔是无色、无味的气体,微溶于水,易溶于有机溶剂。
②炔烃随着碳原子数的增加,
分子间作用力增大,
熔沸点逐渐升高;
③分子式相同的不同炔烃,支链越多,熔沸点越低。
2.炔烃的物理性质
药品:电石(主要成分CaC2)、水
反应原理:
CaC2+2H2O→Ca(OH)2+CH≡CH↑
实验装置:固体+液体→气体
收集:排水集气法
为了减缓反应速率,实验时常用
饱和食盐水代替。
3.乙炔的实验室制法
注意事项:
(1)实验装置在使用前要先检验气密性。
(2)饱和食盐水代替水,并用分液漏斗控制水流的速度。
(3)由于电石制得的
乙炔中常含有H2S等杂质。
使混合气体通过盛有CuSO4溶液
的洗气瓶达到除杂的目的。
3.乙炔的实验室制法
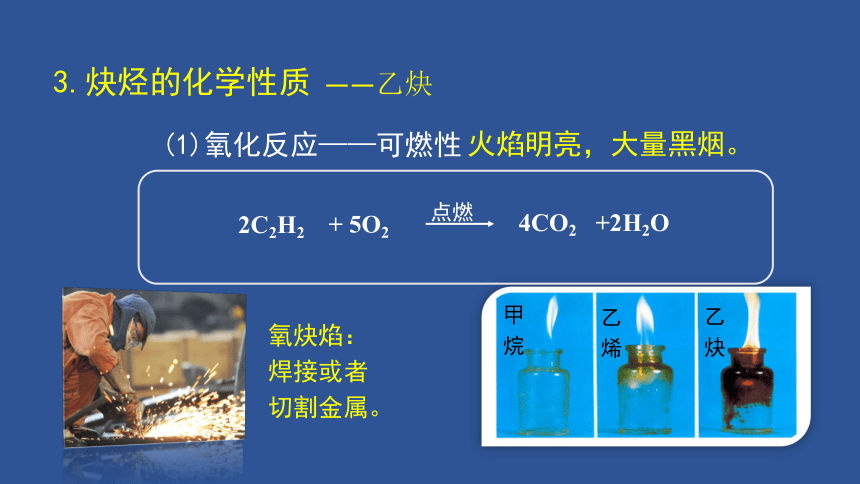
(1)氧化反应——可燃性
氧炔焰:
焊接或者
切割金属。
甲烷
乙烯
乙炔
——乙炔
火焰明亮,大量黑烟。
4CO2 +2H2O
2C2H2
+ 5O2
3.炔烃的化学性质
点燃
相同质量的下列各烃,完全燃烧后生成CO2最多的是( )
A.甲烷 B. 乙烷
C. 乙烯 D. 乙炔
D
12/16
24/30=12/15
24/28=12/14
24/26=12/13
w(C) = M (C) / M (烃)
典型例题
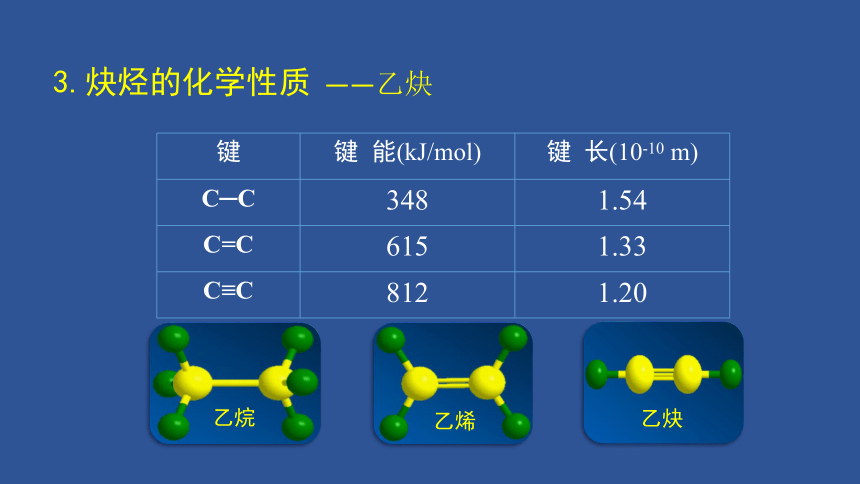
键 键 能(kJ/mol) 键 长(10-10 m)
C─C 348 1.54
C=C 615 1.33
C≡C 812 1.20
乙烯
乙烷
乙炔
——乙炔
3.炔烃的化学性质
(1)氧化反应:
在通常状况下,乙炔中的
碳碳叁键不稳定,易发生反应。
——乙炔
3.炔烃的化学性质
乙炔能使
酸性高锰酸钾溶液褪色
(3)加成反应
——乙炔
3.炔烃的化学性质
HC≡CH + Br2 CHBr=CHBr
HC≡CH + 2Br2 CHBr2-CHBr2
(3)加成反应——与H2反应
——乙炔
3.炔烃的化学性质
HC≡CH + H2 CH2=CH2
Ni
?
HC≡CH + 2H2 CH3 CH3
Ni
?
(3)加成反应
烷烃的物理性质呈规律性变化:
乙炔是一种重要的有机原料,
可以用来制备聚氯乙烯
——乙炔
3.炔烃的化学性质
HC≡CH + HCl CH2=CHCl
催化剂
?
CH2 CH
n CH2 = CHCl
催化剂
Cl
n
(4)加成聚合反应
2000年的诺贝尔化学奖授予这三位科学家。奖励他们在导电高分子、有机半导体方面的开创性工作。
聚乙炔:具有导电性能的有机高分子材料。
——乙炔
3.炔烃的化学性质
CH = CH
n CH ≡ CH
催化剂
n
氧化反应
加成反应
加聚反应
可燃性
酸性高锰酸钾
溶液
H2、X2、HX等
一定条件
3.炔烃的化学性质
丙炔按照1:1比例与HCl发生加成反应,
可以生成哪些物质?
HC≡C-CH3 + HCl
2
想一想,哪种加成产物
可以存在顺反异构呢?
1
催化剂
?
HC=CHCH3
Cl
H2C=CCH3
Cl
2
1
2
1
或
√
X
拓展训练
烷烃 烯烃 炔烃
官能团
取代反应
氧化反应
加成反应
加聚反应
归纳总结
碳碳双键
碳碳三键
√
√
√
√
√
√
√
√
下列关于有机物性质的说法正确的是?( )
A. 丙烯可以与氯气反应而丙烷不能与氯气反应
B. 丙炔和聚丙烯都能使溴的四氯化碳溶液褪色
C. 为了保证制取的氯乙烷纯度较高,最好的方法是
乙烯和氯化氢的加成反应
D. 丙烯和丙烷都可以使酸性高锰酸钾溶液褪色
C
CH3CH2Cl
CH3CH3
CH2=CH2
反馈练习
下列叙述正确的是( )
A.乙烯、苯、2-丁炔都属于脂肪烃
B.乙烷与氯气按1:2的体积比在光照条件下反应,可以制备较纯净的1,2-二氯乙烷
C.HC≡C-CH3最多4个原子共直线,5个原子共平面
D.丙烷分子式为C3H8,与丁烷互为同分异构体
C
反馈练习
H—C ≡ C—C
H
H
H
H
四、脂肪烃的来源及其应用
石油的组成
(1)组成:主要是由气态烃、液态烃和固态烃组成的混合物。
其成分主要是1~50个碳原子的烷烃和环烷烃,有的含芳香烃。
(2)物理性质:黄绿至黑褐色的黏稠液体,
特殊气味。石油的密度比水的密度小,
石油不溶于水。
1.脂肪烃的来源
天然气的成分
天然气主要是烃类气体,
以甲烷为主(按体积分
数计算约占80% ~90% )
“西气东输”工程已全线贯通
1.脂肪烃的来源
煤——也是获得有机物的源泉。
通过煤焦油的分馏可以获得各种芳香烃;通过煤的直接或间接液化,可以获得燃料油。
发展“煤制油”工程可以减少对石油
产品的依赖和直接燃烧煤引起的环境污染。
1.脂肪烃的来源
分馏
催化
裂化
裂解
催化
重整
2.石油的炼制
分馏
催化
裂化
裂解
催化
重整
定义:利用原油中各组分沸点的不同对石油
进行分离的过程。
目的:将石油中的碳氢化合物予以分离,提高产品的价值。
2.石油的炼制
分馏
催化裂化
裂解
催化
重整
常压分馏: 获得液化石油气、汽油、煤油、柴油等含碳原子少的轻质油。
2.石油的炼制
分馏
催化裂化
裂解
催化
重整
煤油比柴油沸点要低,为什么煤油所含烷烃的碳数会比柴油的多呢?
2.石油的炼制
分馏
催化裂化
裂解
催化
重整
减压分馏: 可以得到润滑油、石蜡等相对分子量较大的烷烃。
2.石油的炼制
催化裂化:将含碳原子较多、沸点较高的烃断裂成为含碳原子数较少、沸点较低的烃的过程。例如:
目的:提高轻质油(特别是汽油)的产量。
2.石油的炼制
分馏
催化裂化
裂解
催化
重整
C16H34
催化剂
加热、加压
C8H18
+
C8H16
裂化汽油与直馏汽油有区别吗?
2.石油的炼制
分馏
催化裂化
裂解
催化
重整
催化裂解:在高温下,把石油产品中具有长链分子的烃断裂成为各种短链的气态烃或液态烃的过程,是更深程度的裂化。
目的:是得到气态有机化工原料。
2.石油的炼制
分馏
催化裂化
裂解
催化
重整
在加热和催化剂作用下,通过结构的重新调整,使链状烃转化为环状烃。
这是提高汽油品质的一种方法。
分馏
催化裂化裂解
催化
重整
2.石油的炼制
分馏
催化
裂化
裂解
催化
重整
2.石油的炼制
分馏
催化裂化
裂解
催化
重整
物理变化
2.石油的炼制
分馏
催化裂化
裂解
催化
重整
物理变化
化学变化
2.石油的炼制
石油分馏实验中,一定不使用的仪器是( )
A.蒸发皿
B.酒精灯
C.冷凝管
D.蒸馏烧瓶
A
反馈练习
下列叙述不正确的是( )
A.天然气和沼气的主要成分都是甲烷,燃烧天然气较环保
B.石油中通过常压分馏、减压分馏得到的汽油比催化重整后的汽油品质高
C.重油通过裂化可获得大量的轻质油
D.轻质油的裂解也可称为深度裂化,目的是为了获得大量的气态不饱和烃
B
反馈练习
请同学们翻开书 P36.4
书后习题
CH≡CH
CH2=CHCl
Cl
[ CH2— CH ]n
CH2=CH2
CH3CH3
CH3CH2Cl
CH3CH2Cl
CH2Br=CH2Br
CHBr2CHBr2
H2,Ni?
Cl2,光照
H2,Ni?
HCl,催化剂?
Br2
Br2
HCl,催化剂?
书后习题
催化剂
1. 完成书后作业:写出下列各步变化的化学方程式,
注明反应类型。
2. 根据物质之间的联系,请绘制烷烃、烯烃与炔烃
的知识网络图。
基础作业
第二章 第一节 脂肪烃
——炔烃和脂肪烃的来源及应用
高二年级 化学
三、炔烃
乙炔分子中的碳原子发生sp杂化,2个碳原子各以1个杂化轨道与氢原子形成1个碳氢δ共价键。2个碳原子之间以另一个sp杂化轨道形成1个碳碳δ共价键,未参加杂化的p轨道形成2个π键, π键易断裂。
——乙炔
1.炔烃的结构
名称 乙炔
分子式 C2H2
电子式
结构式
结构简式
H—C≡C—H
HC≡CH
——乙炔
1.炔烃的结构
H C C H
(1)炔烃分子中的碳碳叁键为直线型结构,决定至少四 个原子共直线;
(2)炔烃分子的通式:CnH2n-2(n≥2,正整数)。
1.炔烃的结构
①乙炔是无色、无味的气体,微溶于水,易溶于有机溶剂。
②炔烃随着碳原子数的增加,
分子间作用力增大,
熔沸点逐渐升高;
③分子式相同的不同炔烃,支链越多,熔沸点越低。
2.炔烃的物理性质
药品:电石(主要成分CaC2)、水
反应原理:
CaC2+2H2O→Ca(OH)2+CH≡CH↑
实验装置:固体+液体→气体
收集:排水集气法
为了减缓反应速率,实验时常用
饱和食盐水代替。
3.乙炔的实验室制法
注意事项:
(1)实验装置在使用前要先检验气密性。
(2)饱和食盐水代替水,并用分液漏斗控制水流的速度。
(3)由于电石制得的
乙炔中常含有H2S等杂质。
使混合气体通过盛有CuSO4溶液
的洗气瓶达到除杂的目的。
3.乙炔的实验室制法
(1)氧化反应——可燃性
氧炔焰:
焊接或者
切割金属。
甲烷
乙烯
乙炔
——乙炔
火焰明亮,大量黑烟。
4CO2 +2H2O
2C2H2
+ 5O2
3.炔烃的化学性质
点燃
相同质量的下列各烃,完全燃烧后生成CO2最多的是( )
A.甲烷 B. 乙烷
C. 乙烯 D. 乙炔
D
12/16
24/30=12/15
24/28=12/14
24/26=12/13
w(C) = M (C) / M (烃)
典型例题
键 键 能(kJ/mol) 键 长(10-10 m)
C─C 348 1.54
C=C 615 1.33
C≡C 812 1.20
乙烯
乙烷
乙炔
——乙炔
3.炔烃的化学性质
(1)氧化反应:
在通常状况下,乙炔中的
碳碳叁键不稳定,易发生反应。
——乙炔
3.炔烃的化学性质
乙炔能使
酸性高锰酸钾溶液褪色
(3)加成反应
——乙炔
3.炔烃的化学性质
HC≡CH + Br2 CHBr=CHBr
HC≡CH + 2Br2 CHBr2-CHBr2
(3)加成反应——与H2反应
——乙炔
3.炔烃的化学性质
HC≡CH + H2 CH2=CH2
Ni
?
HC≡CH + 2H2 CH3 CH3
Ni
?
(3)加成反应
烷烃的物理性质呈规律性变化:
乙炔是一种重要的有机原料,
可以用来制备聚氯乙烯
——乙炔
3.炔烃的化学性质
HC≡CH + HCl CH2=CHCl
催化剂
?
CH2 CH
n CH2 = CHCl
催化剂
Cl
n
(4)加成聚合反应
2000年的诺贝尔化学奖授予这三位科学家。奖励他们在导电高分子、有机半导体方面的开创性工作。
聚乙炔:具有导电性能的有机高分子材料。
——乙炔
3.炔烃的化学性质
CH = CH
n CH ≡ CH
催化剂
n
氧化反应
加成反应
加聚反应
可燃性
酸性高锰酸钾
溶液
H2、X2、HX等
一定条件
3.炔烃的化学性质
丙炔按照1:1比例与HCl发生加成反应,
可以生成哪些物质?
HC≡C-CH3 + HCl
2
想一想,哪种加成产物
可以存在顺反异构呢?
1
催化剂
?
HC=CHCH3
Cl
H2C=CCH3
Cl
2
1
2
1
或
√
X
拓展训练
烷烃 烯烃 炔烃
官能团
取代反应
氧化反应
加成反应
加聚反应
归纳总结
碳碳双键
碳碳三键
√
√
√
√
√
√
√
√
下列关于有机物性质的说法正确的是?( )
A. 丙烯可以与氯气反应而丙烷不能与氯气反应
B. 丙炔和聚丙烯都能使溴的四氯化碳溶液褪色
C. 为了保证制取的氯乙烷纯度较高,最好的方法是
乙烯和氯化氢的加成反应
D. 丙烯和丙烷都可以使酸性高锰酸钾溶液褪色
C
CH3CH2Cl
CH3CH3
CH2=CH2
反馈练习
下列叙述正确的是( )
A.乙烯、苯、2-丁炔都属于脂肪烃
B.乙烷与氯气按1:2的体积比在光照条件下反应,可以制备较纯净的1,2-二氯乙烷
C.HC≡C-CH3最多4个原子共直线,5个原子共平面
D.丙烷分子式为C3H8,与丁烷互为同分异构体
C
反馈练习
H—C ≡ C—C
H
H
H
H
四、脂肪烃的来源及其应用
石油的组成
(1)组成:主要是由气态烃、液态烃和固态烃组成的混合物。
其成分主要是1~50个碳原子的烷烃和环烷烃,有的含芳香烃。
(2)物理性质:黄绿至黑褐色的黏稠液体,
特殊气味。石油的密度比水的密度小,
石油不溶于水。
1.脂肪烃的来源
天然气的成分
天然气主要是烃类气体,
以甲烷为主(按体积分
数计算约占80% ~90% )
“西气东输”工程已全线贯通
1.脂肪烃的来源
煤——也是获得有机物的源泉。
通过煤焦油的分馏可以获得各种芳香烃;通过煤的直接或间接液化,可以获得燃料油。
发展“煤制油”工程可以减少对石油
产品的依赖和直接燃烧煤引起的环境污染。
1.脂肪烃的来源
分馏
催化
裂化
裂解
催化
重整
2.石油的炼制
分馏
催化
裂化
裂解
催化
重整
定义:利用原油中各组分沸点的不同对石油
进行分离的过程。
目的:将石油中的碳氢化合物予以分离,提高产品的价值。
2.石油的炼制
分馏
催化裂化
裂解
催化
重整
常压分馏: 获得液化石油气、汽油、煤油、柴油等含碳原子少的轻质油。
2.石油的炼制
分馏
催化裂化
裂解
催化
重整
煤油比柴油沸点要低,为什么煤油所含烷烃的碳数会比柴油的多呢?
2.石油的炼制
分馏
催化裂化
裂解
催化
重整
减压分馏: 可以得到润滑油、石蜡等相对分子量较大的烷烃。
2.石油的炼制
催化裂化:将含碳原子较多、沸点较高的烃断裂成为含碳原子数较少、沸点较低的烃的过程。例如:
目的:提高轻质油(特别是汽油)的产量。
2.石油的炼制
分馏
催化裂化
裂解
催化
重整
C16H34
催化剂
加热、加压
C8H18
+
C8H16
裂化汽油与直馏汽油有区别吗?
2.石油的炼制
分馏
催化裂化
裂解
催化
重整
催化裂解:在高温下,把石油产品中具有长链分子的烃断裂成为各种短链的气态烃或液态烃的过程,是更深程度的裂化。
目的:是得到气态有机化工原料。
2.石油的炼制
分馏
催化裂化
裂解
催化
重整
在加热和催化剂作用下,通过结构的重新调整,使链状烃转化为环状烃。
这是提高汽油品质的一种方法。
分馏
催化裂化裂解
催化
重整
2.石油的炼制
分馏
催化
裂化
裂解
催化
重整
2.石油的炼制
分馏
催化裂化
裂解
催化
重整
物理变化
2.石油的炼制
分馏
催化裂化
裂解
催化
重整
物理变化
化学变化
2.石油的炼制
石油分馏实验中,一定不使用的仪器是( )
A.蒸发皿
B.酒精灯
C.冷凝管
D.蒸馏烧瓶
A
反馈练习
下列叙述不正确的是( )
A.天然气和沼气的主要成分都是甲烷,燃烧天然气较环保
B.石油中通过常压分馏、减压分馏得到的汽油比催化重整后的汽油品质高
C.重油通过裂化可获得大量的轻质油
D.轻质油的裂解也可称为深度裂化,目的是为了获得大量的气态不饱和烃
B
反馈练习
请同学们翻开书 P36.4
书后习题
CH≡CH
CH2=CHCl
Cl
[ CH2— CH ]n
CH2=CH2
CH3CH3
CH3CH2Cl
CH3CH2Cl
CH2Br=CH2Br
CHBr2CHBr2
H2,Ni?
Cl2,光照
H2,Ni?
HCl,催化剂?
Br2
Br2
HCl,催化剂?
书后习题
催化剂
1. 完成书后作业:写出下列各步变化的化学方程式,
注明反应类型。
2. 根据物质之间的联系,请绘制烷烃、烯烃与炔烃
的知识网络图。
基础作业
