苏教化学选修 有机化学基础专题4第三单元 醛 羧酸(第一课时)(共18张PPT)
文档属性
| 名称 | 苏教化学选修 有机化学基础专题4第三单元 醛 羧酸(第一课时)(共18张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 459.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-05-19 13:39:25 | ||
图片预览



文档简介
(共18张PPT)
第三单元 醛
【学习目标】
1.通过对乙醛性质的探究活动,学习醛的典型化学性质。
2.知道甲醛的结构,了解甲醛在日常生活、工农业生产中的用途,以及甲醛对人体健康的危害。
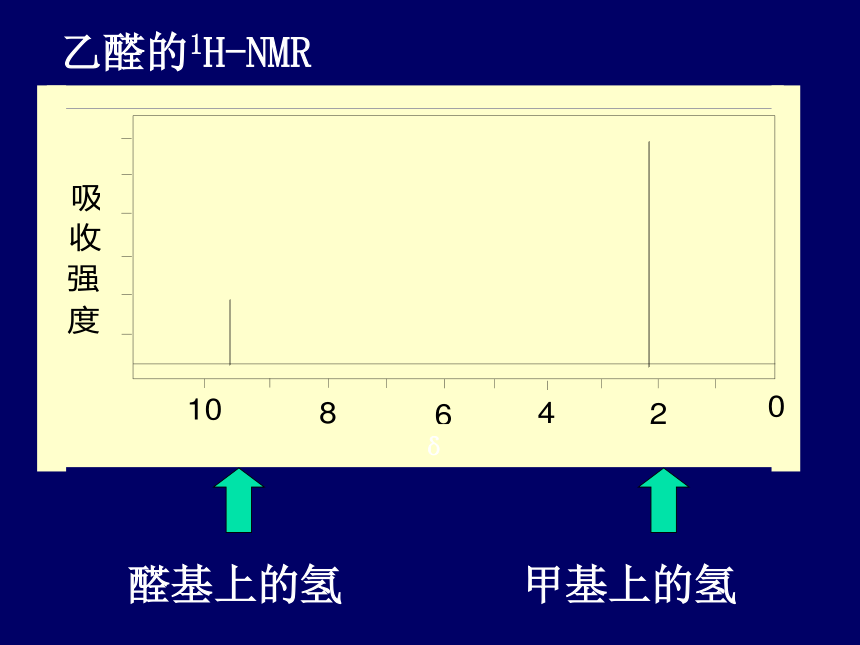
乙醛的1H-NMR
(一)组成和结构:
C2H4O
CH3CHO
一、乙醛:
分子式:
结构简式:
(二)乙醛的性质
1、物理性质:
无色有刺激性气味的液体,沸点20.8℃, 密度比水小,易挥发,易燃烧,能跟水、乙醇、氯仿等互溶。
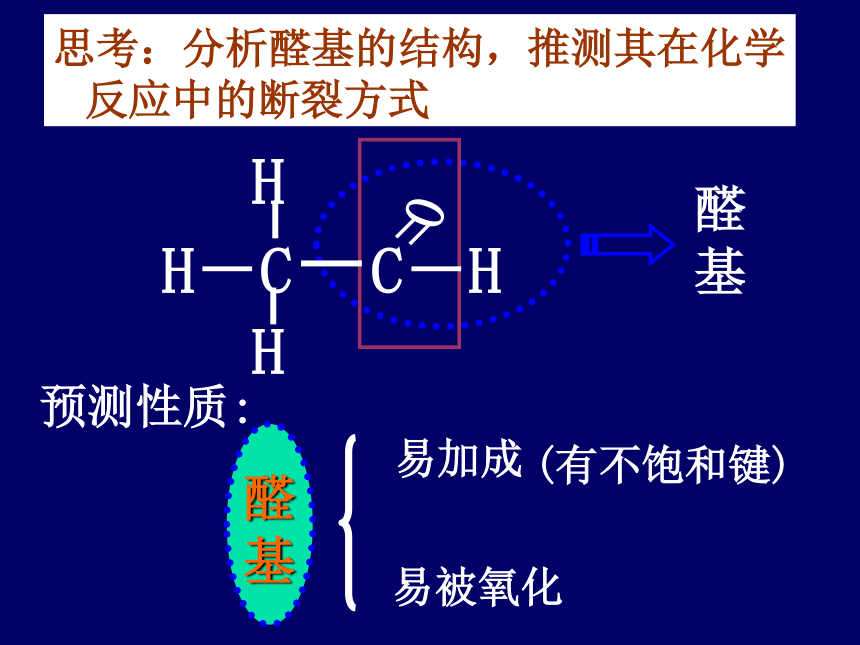
(有不饱和键)
醛
基
易被氧化
预测性质:
思考:分析醛基的结构,推测其在化学反应中的断裂方式
易加成
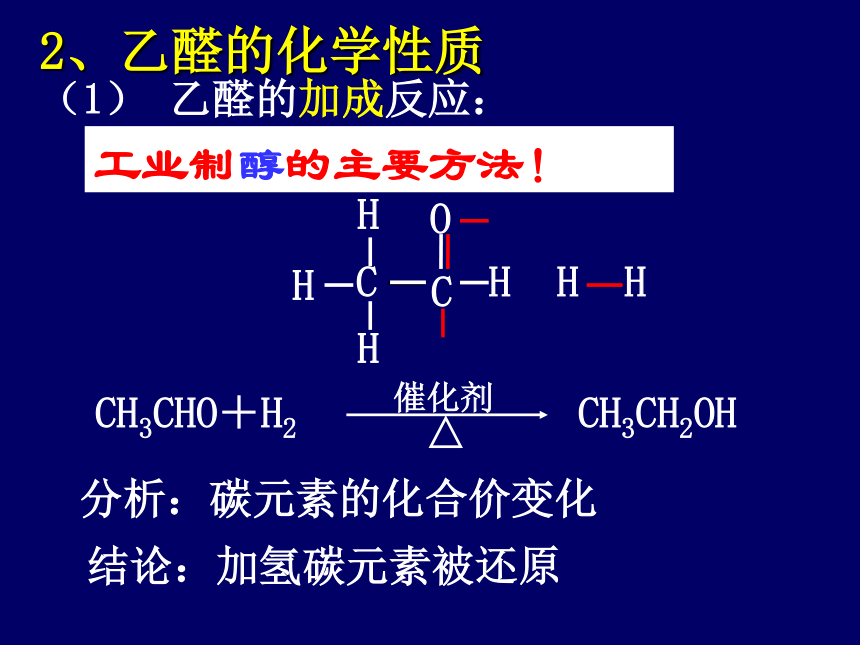
(1) 乙醛的加成反应:
2、乙醛的化学性质
O
C
H
C
H
H
H
H
H
分析:碳元素的化合价变化
结论:加氢碳元素被还原
工业制醇的主要方法!
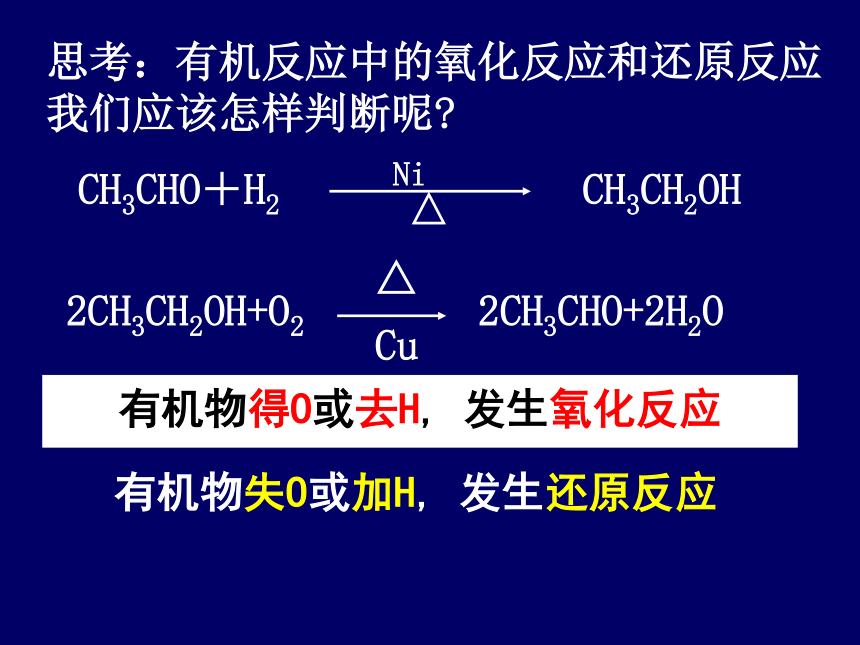
思考:有机反应中的氧化反应和还原反应
我们应该怎样判断呢?
有机物得O或去H, 发生氧化反应
有机物失O或加H, 发生还原反应
O
C
H
C
H
H
H
O
乙醛在一定的条件下被氧化为乙酸
工业制羧酸的主要方法!
B.催化氧化
(2) 乙醛的氧化反应:
①与氧气反应
A、燃烧
A.银镜反应---与银氨溶液的反应
Ag++NH3·H2O=AgOH ↓+ NH4+
AgOH+2 NH3·H2O=[Ag(NH3)2]++OH-+2H2O
或:AgOH+2 NH3·H2O=[Ag(NH3)2]OH+2H2O
银氨溶液的配制方法:
取一洁净试管,加入2ml2%的AgNO3溶液,再逐滴滴入2%的稀氨水,至生成的沉淀恰好溶解。
②与其它氧化剂反应
此反应可以用于醛基的定性和定量检测
应用:工业上用来制瓶胆和镜子
5.1mol醛基被氧化,就应有2molAg被还原
3.银氨溶液现用现制,不能久置;氨水滴加至沉淀恰好溶解,不可多加,
注意:
1.试管要洁净,
2.水浴加热时不可振荡和摇动试管
否则生不成银镜
4.试管内壁银镜的处理:稀硝酸清洗
B、被新制Cu(OH)2氧化
新制Cu(OH)2的配制方法:
2mlNaOH(5%)+4~6滴CuSO4(2%)
CH3CHO+2Cu(OH)2 CH3COOH+Cu2O+2H2O
砖红色
加热
必须过量
注意:
此反应必须在碱性条件下进行
应用:
此反应也用于醛基的检验和测定
医学上检验病人是否患糖尿病
讨论:
.乙醛能否使溴水或酸性KMnO4溶液褪色?
B、被新制Cu(OH)2氧化
新制Cu(OH)2的配制方法:
2mlNaOH(50%)+4~6滴CuSO4(2%)
CH3CHO+2Cu(OH)2 CH3COOH+Cu2O+2H2O
砖红色
加热
必须过量
C、使酸性KMnO4溶液褪色
醛基中碳氧双键能与H2发生加成反应
醛基中碳氢键较活泼,能被氧化成羧基
加成反应
氧化反应
乙 醛
小结:乙醛的化学性质
注意:和C=C双键不同的是,通
常情况下, 醛基中的C=O不能
和HX、X2、H2O发生加成反应
(四)乙醛的工业制取:
(1)乙醇的催化氧化
(2)乙烯氧化法:
(三)乙醛的用途:
是有机合成的重要原料,主要用于制取
乙酸、丁醇、乙酸乙酯
练习
1、已知柠檬醛的结构简式为
(CH3)2C=CHCH2CH2CH=C(CH3)CHO。根据已学过的知识推断,下列说法中错误的是 A.它可与新制氢氧化铜反应
B.它能使溴的四氯化碳溶液褪色
C.它能够发生银镜反应
D.它完全催化加氢产物的分子式为C10H20
2、 某学生用1mol/LCuSO4溶液2mL和0.5mol/LNaOH溶液4mL混合,然后加入40%的甲醛溶液0.5mL,加热到沸腾,未见红色沉淀产生,主要原因是 ( )
A.甲醛的量太少 B.CuSO4的量太少
C.NaOH的量太少 D.加热时间太短
第三单元 醛
【学习目标】
1.通过对乙醛性质的探究活动,学习醛的典型化学性质。
2.知道甲醛的结构,了解甲醛在日常生活、工农业生产中的用途,以及甲醛对人体健康的危害。
乙醛的1H-NMR
(一)组成和结构:
C2H4O
CH3CHO
一、乙醛:
分子式:
结构简式:
(二)乙醛的性质
1、物理性质:
无色有刺激性气味的液体,沸点20.8℃, 密度比水小,易挥发,易燃烧,能跟水、乙醇、氯仿等互溶。
(有不饱和键)
醛
基
易被氧化
预测性质:
思考:分析醛基的结构,推测其在化学反应中的断裂方式
易加成
(1) 乙醛的加成反应:
2、乙醛的化学性质
O
C
H
C
H
H
H
H
H
分析:碳元素的化合价变化
结论:加氢碳元素被还原
工业制醇的主要方法!
思考:有机反应中的氧化反应和还原反应
我们应该怎样判断呢?
有机物得O或去H, 发生氧化反应
有机物失O或加H, 发生还原反应
O
C
H
C
H
H
H
O
乙醛在一定的条件下被氧化为乙酸
工业制羧酸的主要方法!
B.催化氧化
(2) 乙醛的氧化反应:
①与氧气反应
A、燃烧
A.银镜反应---与银氨溶液的反应
Ag++NH3·H2O=AgOH ↓+ NH4+
AgOH+2 NH3·H2O=[Ag(NH3)2]++OH-+2H2O
或:AgOH+2 NH3·H2O=[Ag(NH3)2]OH+2H2O
银氨溶液的配制方法:
取一洁净试管,加入2ml2%的AgNO3溶液,再逐滴滴入2%的稀氨水,至生成的沉淀恰好溶解。
②与其它氧化剂反应
此反应可以用于醛基的定性和定量检测
应用:工业上用来制瓶胆和镜子
5.1mol醛基被氧化,就应有2molAg被还原
3.银氨溶液现用现制,不能久置;氨水滴加至沉淀恰好溶解,不可多加,
注意:
1.试管要洁净,
2.水浴加热时不可振荡和摇动试管
否则生不成银镜
4.试管内壁银镜的处理:稀硝酸清洗
B、被新制Cu(OH)2氧化
新制Cu(OH)2的配制方法:
2mlNaOH(5%)+4~6滴CuSO4(2%)
CH3CHO+2Cu(OH)2 CH3COOH+Cu2O+2H2O
砖红色
加热
必须过量
注意:
此反应必须在碱性条件下进行
应用:
此反应也用于醛基的检验和测定
医学上检验病人是否患糖尿病
讨论:
.乙醛能否使溴水或酸性KMnO4溶液褪色?
B、被新制Cu(OH)2氧化
新制Cu(OH)2的配制方法:
2mlNaOH(50%)+4~6滴CuSO4(2%)
CH3CHO+2Cu(OH)2 CH3COOH+Cu2O+2H2O
砖红色
加热
必须过量
C、使酸性KMnO4溶液褪色
醛基中碳氧双键能与H2发生加成反应
醛基中碳氢键较活泼,能被氧化成羧基
加成反应
氧化反应
乙 醛
小结:乙醛的化学性质
注意:和C=C双键不同的是,通
常情况下, 醛基中的C=O不能
和HX、X2、H2O发生加成反应
(四)乙醛的工业制取:
(1)乙醇的催化氧化
(2)乙烯氧化法:
(三)乙醛的用途:
是有机合成的重要原料,主要用于制取
乙酸、丁醇、乙酸乙酯
练习
1、已知柠檬醛的结构简式为
(CH3)2C=CHCH2CH2CH=C(CH3)CHO。根据已学过的知识推断,下列说法中错误的是 A.它可与新制氢氧化铜反应
B.它能使溴的四氯化碳溶液褪色
C.它能够发生银镜反应
D.它完全催化加氢产物的分子式为C10H20
2、 某学生用1mol/LCuSO4溶液2mL和0.5mol/LNaOH溶液4mL混合,然后加入40%的甲醛溶液0.5mL,加热到沸腾,未见红色沉淀产生,主要原因是 ( )
A.甲醛的量太少 B.CuSO4的量太少
C.NaOH的量太少 D.加热时间太短
