人教版高一年级下册化学课件 化工生产中的重要非金属元素复习人教版(71张ppt)
文档属性
| 名称 | 人教版高一年级下册化学课件 化工生产中的重要非金属元素复习人教版(71张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 36.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-05-19 12:12:33 | ||
图片预览








文档简介
(共71张PPT)
第五章
化工生产中的重要非金属元素
全章复习
高一年级 化学
复习提纲
一、基于原子结构和元素周期律的元素性质回顾
二、化工生产中重要的物质转化
三、重要的实验
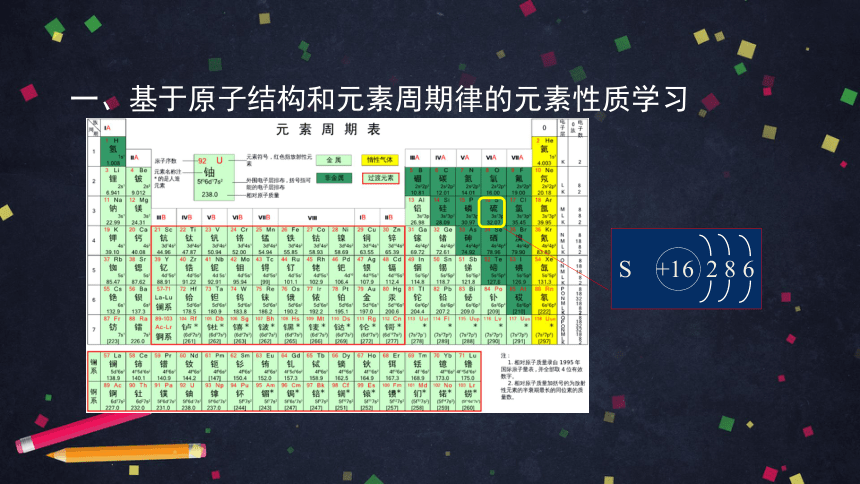
一、基于原子结构和元素周期律的元素性质学习
S +16 2 8 6
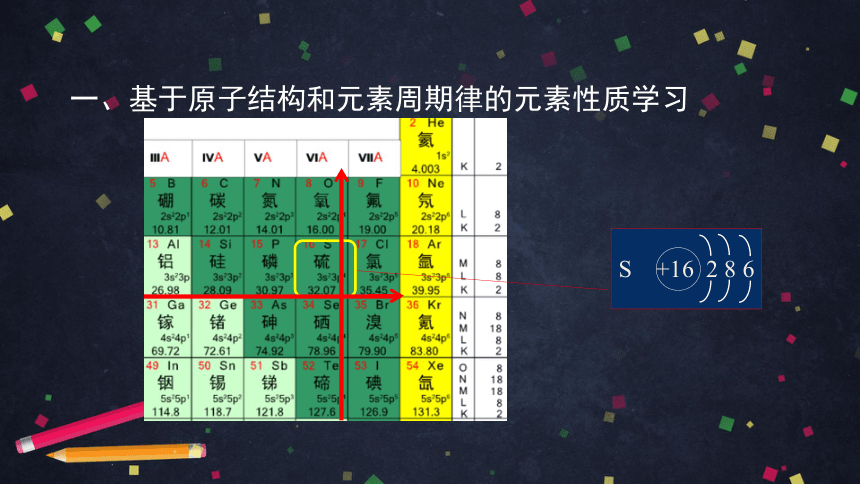
一、基于原子结构和元素周期律的元素性质学习
S +16 2 8 6
一、基于原子结构和元素周期律的元素性质学习
1. 单质硫具有氧化性,但相同条件下氧化性比
氧气和氯气的都弱
S +16 2 8 6
一、基于原子结构和元素周期律的元素性质学习
1. 单质硫具有氧化性,但相同条件下氧化性比
氧气和氯气的都弱
S + Fe FeS S + 2Cu Cu2S
S +16 2 8 6
?
?
一、基于原子结构和元素周期律的元素性质学习
1. 单质硫具有氧化性,但相同条件下氧化性比
氧气和氯气的都弱
S + Fe FeS S + 2Cu Cu2S
3Cl2 + 2Fe 2FeCl3 Cl2 + Cu CuCl2
2O2 + 3Fe Fe3O4 O2 + 2Cu 2CuO
S +16 2 8 6
?
?
?
?
?
?
一、基于原子结构和元素周期律的元素性质学习
2. 硫的氢化物H2S的稳定性比HCl和H2O的都弱
S + H2 H2S
S +16 2 8 6
?
一、基于原子结构和元素周期律的元素性质学习
3. 最高价氧化物对应的水化物的酸性:
H2SO4S +16 2 8 6
一、基于原子结构和元素周期律的元素性质学习
1.单质硫具有氧化性,但氧化性比氧气和氯
气的都弱
2.硫的氢化物H2S的稳定性比HCl和H2O的都弱
3.最高价氧化物对应的水化物的酸性:
H2SO4S +16 2 8 6
得出结论:硫元素的非金属性比氯元素和氧元素弱。
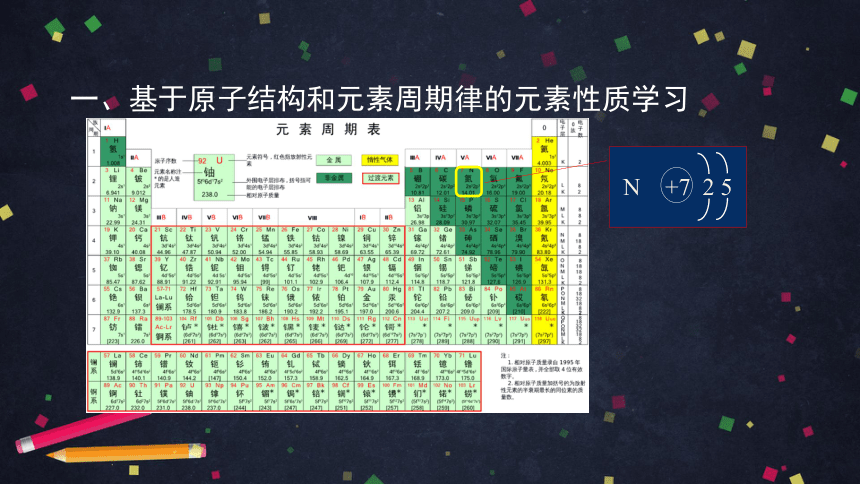
一、基于原子结构和元素周期律的元素性质学习
N +7 2 5
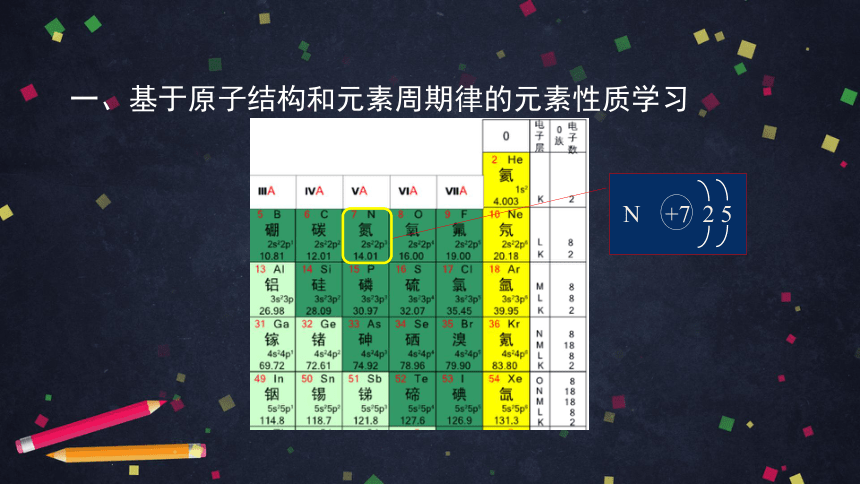
一、基于原子结构和元素周期律的元素性质学习
N +7 2 5
一、基于原子结构和元素周期律的元素性质学习
N +7 2 5
1.氮元素的非金属性强于碳元素,弱于氧元素
一、基于原子结构和元素周期律的元素性质学习
N +7 2 5
1.氮元素的非金属性强于碳元素,弱于氧元素
2.N2的分子结构:N≡N,通常情况下氮气很稳定
一、基于原子结构和元素周期律的元素性质学习
N +7 2 5
N2 + 3Mg Mg3N2
N2 + O2 2NO
N2 + 3H2 2NH3
放电或高温
点燃
催化剂
高温、高压
3.特殊条件下,氮气也能与一些物质发生反应
一、基于原子结构和元素周期律的元素性质学习
N +7 2 5
N2 + 3Mg Mg3N2
N2 + O2 2NO
N2 + 3H2 2NH3
放电或高温
点燃
催化剂
高温、高压
3.特殊条件下,氮气也能与一些物质发生反应
以上几个反应均实现了氮的固定。
一、基于原子结构和元素周期律的元素性质学习
N +7 2 5
N2 + 3Mg Mg3N2
N2 + O2 2NO
N2 + 3H2 2NH3
放电或高温
点燃
催化剂
高温、高压
3.特殊条件下,氮气也能与一些物质发生反应
得出结论:氮元素的非金属性比氧元素的弱,N≡N很稳定,
但通过控制条件,N2也可以发生一些反应。
一、基于原子结构和元素周期律的元素性质学习
2.氮元素的非金属性比氧元素的弱。
N≡N很稳定,但通过控制条件,N2也可以
发生一些反应。
1.硫元素的非金属性比氯元素和氧元素的都弱。
通过单质的氧化性、氢化物的稳定性、
最高价氧化物对应水化物的酸性强弱比较。
N +7 2 5
S +16 2 8 6
二、化工生产中重要的物质转化
1.工业合成硫酸
2.工业合成硝酸
H2SO4
1.工业合成硫酸
H2SO4
1.工业合成硫酸
SO3
H2SO4
1.工业合成硫酸
SO3
SO2
H2SO4
1.工业合成硫酸
SO3
SO2
H2SO3
H2SO4
1.工业合成硫酸
SO3
SO2
S
H2SO3
H2SO4
1.工业合成硫酸
SO3
SO2
S
或FeS2
H2SO3
H2SO4
1.工业合成硫酸
SO3
SO2
S
或FeS2
H2SO3
H2SO4
1.工业合成硫酸
SO3
SO2
S
H2SO3
H2SO4
1.工业合成硫酸
SO3
SO2
S
H2SO3
CO2
CO
C
H2SO4
含硫物质之间的重要转化关系:
SO3
SO2
S
H2S
H2SO3
H2SO4
含硫物质之间的重要转化关系:
SO3
SO2
S
H2S
H2SO3
H2SO4
含硫物质之间的重要转化关系:
SO3
SO2
S
H2S
H2SO3
Na2SO3
H2SO4
含硫物质之间的重要转化关系:
SO3
SO2
S
H2S
H2SO3
Na2SO3
含硫物质之间的重要转化关系:
物质的性质:
1.共性(基于元素周期律、元素化合价或物质类别)
含硫物质之间的重要转化关系:
物质的性质:
1.共性(基于元素周期律、元素化合价或物质类别)
2.特性
如SO2的漂白性
浓硫酸的吸水性、脱水性、强氧化性等
2.工业合成硝酸
HNO3
2.工业合成硝酸
HNO3
NO2
2.工业合成硝酸
HNO3
NO2
NO
2.工业合成硝酸
HNO3
NO2
NO
N2
2.工业合成硝酸
HNO3
NO2
NO
NH3
N2
2.工业合成硝酸
HNO3
NO2
NO
NH3
N2
2.工业合成硝酸
HNO3
NO2
NO
NH3
N2
HNO3
NO2
NO
NH3
N2
含氮物质间的重要转化关系:
HNO3
NO2
NO
N2
含氮物质间的重要转化关系:
NH3
NH3 H2O
·
HNO3
NO2
NO
N2
含氮物质间的重要转化关系:
NH3
NH3 H2O
·
NH4Cl
HNO3
NO2
NO
N2
含氮物质间的重要转化关系:
NH3
NH3 H2O
·
NH4Cl
HNO3
NO2
NO
N2
含氮物质间的重要转化关系:
NH3
NH3 H2O
·
NH4Cl
HNO3
NO2
NO
N2
含氮物质间的重要转化关系:
NH3
NH3 H2O
·
NH4Cl
含氮物质间的重要转化关系:
物质的性质:
1.共性(基于元素周期律、元素化合价或物质类别)
含氮物质间的重要转化关系:
物质的性质:
1.共性(基于元素周期律、元素化合价或物质类别)
2.特性
如铵盐的热不稳定性
氨气溶于水显碱性和极强的溶解性
硝酸的强氧化性等
非金属元素主要物质间的重要转化关系:
基于物质类别分析的转化关系
单质
氢化物
氧化物
酸
盐
非金属元素主要物质间的重要转化关系:
基于物质类别分析和化合价分析的转化关系
单质
氢化物
氧化物1
氧化物2
盐1
酸1
酸2
盐2
三、重要的实验
(一)物质性质类
(二)物质制备类
(三)物质检验类
(四)物质提纯类
三、重要的实验
(一)物质性质类
1.SO2的性质探究
水溶性 与水反应生成酸 漂白性
三、重要的实验
(一)物质性质类
1.SO2的性质探究
2.NO与氧气
3.NO2溶于水
NO难溶于水
NO与空气反应
NO2与水发生反应
SO2 + H2O H2SO3
3NO2 + H2O 2HNO3 +NO
NO + H2O
三、重要的实验
(一)物质性质类
1.SO2的性质探究
2.NO与氧气
3.NO2溶于水
4.氨气的性质探究
氨气极易溶于水
氨的水溶液显碱性
三、重要的实验
(一)物质性质类
1.SO2的性质探究
2.NO与氧气
3.NO2溶于水
4.氨气的性质探究
浓氨水和浓盐酸易挥发
产物为白色固体小颗粒
三、重要的实验
(一)物质性质类
1.SO2的性质探究
2.NO与氧气
3.NO2溶于水
4.氨气的性质探究
三、重要的实验
(一)物质性质类
1.SO2的性质探究
2.NO与氧气
3.NO2溶于水
4.氨气的性质探究
5.浓硫酸的性质探究
蔗糖变黑:浓硫酸有脱水性
有刺激性气味:浓硫酸有强氧化性
三、重要的实验
(一)物质性质类
1.SO2的性质探究
2.NO与氧气
3.NO2溶于水
4.氨气的性质探究
5.浓硫酸的性质探究
铜丝不断溶解、品红溶液褪色、紫色石蕊溶液变红:浓硫酸有强氧化性
三、重要的实验
(一)物质性质类
1.SO2的性质探究
2.NO与氧气
3.NO2溶于水
4.氨气的性质探究
5.浓硫酸的性质探究
6.硝酸与铜
浓硝酸和稀硝酸均有强氧化性
2H2SO4(浓)+ Cu CuSO4 + SO2↑+ 2H2O
H2SO4(稀)+ Cu
4HNO3(浓)+ Cu 2NO2 + Cu(NO3)2 + 2H2O
8HNO3 + 3Cu 2NO↑+ 3Cu(NO3)2 + 4H2O
4HCl(浓)+MnO2 MnCl2+Cl2↑+2H2O
HCl(稀)+MnO2
△
△
△
△
三、重要的实验
(二)物质制备类
1.NH3 的制取
反应原理及反应物状态
→发生装置→除杂装置
→收集装置→尾气处理装置
三、重要的实验
(二)物质制备类
1.NH3 的制取
2.SO2 的制取
反应原理及反应物状态
→发生装置→除杂装置
→收集装置→尾气处理装置
三、重要的实验
(二)物质制备类
1.NH3 的制取
2.SO2 的制取
反应原理及反应物状态
→发生装置→除杂装置
→收集装置→尾气处理装置
三、重要的实验
(二)物质制备类
1.NH3 的制取
2.SO2 的制取
3.NO 的制取
4.NO2 的制取
反应原理及反应物状态
→发生装置→除杂装置
→收集装置→尾气处理装置
三、重要的实验
(三)物质检验类
1.SO4 的检验 (生成白色难溶于酸的沉淀)
问题1:为什么用氯化钡溶液而不能用硝酸钡溶液?
问题2:为什么要加入酸酸化,酸化时所加的是什么酸?
2-
三、重要的实验
(三)物质检验类
1.SO4 的检验 (生成白色难溶于酸的沉淀)
2.NH4 的检验 (生成溶于水显碱性的气体)
2-
+
三、重要的实验
(四)物质提纯类
粗盐的提纯
三、重要的实验
(四)物质提纯类
粗盐的提纯
粗盐
溶解
①
BaCl2溶液
②
NaOH 溶液
③
Na2CO3溶液
④
过滤
⑤
滤液
沉淀
盐酸
⑥
蒸发、结晶
烘干
精盐
除杂试剂的添加顺序
三、重要的实验——启示
1.认识物质性质的手段
2.运用物质性质的实际过程
3.培养获取证据的素养
4.发展做出结论的能力
第五章
化工生产中的重要非金属元素
全章复习
高一年级 化学
复习提纲
一、基于原子结构和元素周期律的元素性质回顾
二、化工生产中重要的物质转化
三、重要的实验
一、基于原子结构和元素周期律的元素性质学习
S +16 2 8 6
一、基于原子结构和元素周期律的元素性质学习
S +16 2 8 6
一、基于原子结构和元素周期律的元素性质学习
1. 单质硫具有氧化性,但相同条件下氧化性比
氧气和氯气的都弱
S +16 2 8 6
一、基于原子结构和元素周期律的元素性质学习
1. 单质硫具有氧化性,但相同条件下氧化性比
氧气和氯气的都弱
S + Fe FeS S + 2Cu Cu2S
S +16 2 8 6
?
?
一、基于原子结构和元素周期律的元素性质学习
1. 单质硫具有氧化性,但相同条件下氧化性比
氧气和氯气的都弱
S + Fe FeS S + 2Cu Cu2S
3Cl2 + 2Fe 2FeCl3 Cl2 + Cu CuCl2
2O2 + 3Fe Fe3O4 O2 + 2Cu 2CuO
S +16 2 8 6
?
?
?
?
?
?
一、基于原子结构和元素周期律的元素性质学习
2. 硫的氢化物H2S的稳定性比HCl和H2O的都弱
S + H2 H2S
S +16 2 8 6
?
一、基于原子结构和元素周期律的元素性质学习
3. 最高价氧化物对应的水化物的酸性:
H2SO4
一、基于原子结构和元素周期律的元素性质学习
1.单质硫具有氧化性,但氧化性比氧气和氯
气的都弱
2.硫的氢化物H2S的稳定性比HCl和H2O的都弱
3.最高价氧化物对应的水化物的酸性:
H2SO4
得出结论:硫元素的非金属性比氯元素和氧元素弱。
一、基于原子结构和元素周期律的元素性质学习
N +7 2 5
一、基于原子结构和元素周期律的元素性质学习
N +7 2 5
一、基于原子结构和元素周期律的元素性质学习
N +7 2 5
1.氮元素的非金属性强于碳元素,弱于氧元素
一、基于原子结构和元素周期律的元素性质学习
N +7 2 5
1.氮元素的非金属性强于碳元素,弱于氧元素
2.N2的分子结构:N≡N,通常情况下氮气很稳定
一、基于原子结构和元素周期律的元素性质学习
N +7 2 5
N2 + 3Mg Mg3N2
N2 + O2 2NO
N2 + 3H2 2NH3
放电或高温
点燃
催化剂
高温、高压
3.特殊条件下,氮气也能与一些物质发生反应
一、基于原子结构和元素周期律的元素性质学习
N +7 2 5
N2 + 3Mg Mg3N2
N2 + O2 2NO
N2 + 3H2 2NH3
放电或高温
点燃
催化剂
高温、高压
3.特殊条件下,氮气也能与一些物质发生反应
以上几个反应均实现了氮的固定。
一、基于原子结构和元素周期律的元素性质学习
N +7 2 5
N2 + 3Mg Mg3N2
N2 + O2 2NO
N2 + 3H2 2NH3
放电或高温
点燃
催化剂
高温、高压
3.特殊条件下,氮气也能与一些物质发生反应
得出结论:氮元素的非金属性比氧元素的弱,N≡N很稳定,
但通过控制条件,N2也可以发生一些反应。
一、基于原子结构和元素周期律的元素性质学习
2.氮元素的非金属性比氧元素的弱。
N≡N很稳定,但通过控制条件,N2也可以
发生一些反应。
1.硫元素的非金属性比氯元素和氧元素的都弱。
通过单质的氧化性、氢化物的稳定性、
最高价氧化物对应水化物的酸性强弱比较。
N +7 2 5
S +16 2 8 6
二、化工生产中重要的物质转化
1.工业合成硫酸
2.工业合成硝酸
H2SO4
1.工业合成硫酸
H2SO4
1.工业合成硫酸
SO3
H2SO4
1.工业合成硫酸
SO3
SO2
H2SO4
1.工业合成硫酸
SO3
SO2
H2SO3
H2SO4
1.工业合成硫酸
SO3
SO2
S
H2SO3
H2SO4
1.工业合成硫酸
SO3
SO2
S
或FeS2
H2SO3
H2SO4
1.工业合成硫酸
SO3
SO2
S
或FeS2
H2SO3
H2SO4
1.工业合成硫酸
SO3
SO2
S
H2SO3
H2SO4
1.工业合成硫酸
SO3
SO2
S
H2SO3
CO2
CO
C
H2SO4
含硫物质之间的重要转化关系:
SO3
SO2
S
H2S
H2SO3
H2SO4
含硫物质之间的重要转化关系:
SO3
SO2
S
H2S
H2SO3
H2SO4
含硫物质之间的重要转化关系:
SO3
SO2
S
H2S
H2SO3
Na2SO3
H2SO4
含硫物质之间的重要转化关系:
SO3
SO2
S
H2S
H2SO3
Na2SO3
含硫物质之间的重要转化关系:
物质的性质:
1.共性(基于元素周期律、元素化合价或物质类别)
含硫物质之间的重要转化关系:
物质的性质:
1.共性(基于元素周期律、元素化合价或物质类别)
2.特性
如SO2的漂白性
浓硫酸的吸水性、脱水性、强氧化性等
2.工业合成硝酸
HNO3
2.工业合成硝酸
HNO3
NO2
2.工业合成硝酸
HNO3
NO2
NO
2.工业合成硝酸
HNO3
NO2
NO
N2
2.工业合成硝酸
HNO3
NO2
NO
NH3
N2
2.工业合成硝酸
HNO3
NO2
NO
NH3
N2
2.工业合成硝酸
HNO3
NO2
NO
NH3
N2
HNO3
NO2
NO
NH3
N2
含氮物质间的重要转化关系:
HNO3
NO2
NO
N2
含氮物质间的重要转化关系:
NH3
NH3 H2O
·
HNO3
NO2
NO
N2
含氮物质间的重要转化关系:
NH3
NH3 H2O
·
NH4Cl
HNO3
NO2
NO
N2
含氮物质间的重要转化关系:
NH3
NH3 H2O
·
NH4Cl
HNO3
NO2
NO
N2
含氮物质间的重要转化关系:
NH3
NH3 H2O
·
NH4Cl
HNO3
NO2
NO
N2
含氮物质间的重要转化关系:
NH3
NH3 H2O
·
NH4Cl
含氮物质间的重要转化关系:
物质的性质:
1.共性(基于元素周期律、元素化合价或物质类别)
含氮物质间的重要转化关系:
物质的性质:
1.共性(基于元素周期律、元素化合价或物质类别)
2.特性
如铵盐的热不稳定性
氨气溶于水显碱性和极强的溶解性
硝酸的强氧化性等
非金属元素主要物质间的重要转化关系:
基于物质类别分析的转化关系
单质
氢化物
氧化物
酸
盐
非金属元素主要物质间的重要转化关系:
基于物质类别分析和化合价分析的转化关系
单质
氢化物
氧化物1
氧化物2
盐1
酸1
酸2
盐2
三、重要的实验
(一)物质性质类
(二)物质制备类
(三)物质检验类
(四)物质提纯类
三、重要的实验
(一)物质性质类
1.SO2的性质探究
水溶性 与水反应生成酸 漂白性
三、重要的实验
(一)物质性质类
1.SO2的性质探究
2.NO与氧气
3.NO2溶于水
NO难溶于水
NO与空气反应
NO2与水发生反应
SO2 + H2O H2SO3
3NO2 + H2O 2HNO3 +NO
NO + H2O
三、重要的实验
(一)物质性质类
1.SO2的性质探究
2.NO与氧气
3.NO2溶于水
4.氨气的性质探究
氨气极易溶于水
氨的水溶液显碱性
三、重要的实验
(一)物质性质类
1.SO2的性质探究
2.NO与氧气
3.NO2溶于水
4.氨气的性质探究
浓氨水和浓盐酸易挥发
产物为白色固体小颗粒
三、重要的实验
(一)物质性质类
1.SO2的性质探究
2.NO与氧气
3.NO2溶于水
4.氨气的性质探究
三、重要的实验
(一)物质性质类
1.SO2的性质探究
2.NO与氧气
3.NO2溶于水
4.氨气的性质探究
5.浓硫酸的性质探究
蔗糖变黑:浓硫酸有脱水性
有刺激性气味:浓硫酸有强氧化性
三、重要的实验
(一)物质性质类
1.SO2的性质探究
2.NO与氧气
3.NO2溶于水
4.氨气的性质探究
5.浓硫酸的性质探究
铜丝不断溶解、品红溶液褪色、紫色石蕊溶液变红:浓硫酸有强氧化性
三、重要的实验
(一)物质性质类
1.SO2的性质探究
2.NO与氧气
3.NO2溶于水
4.氨气的性质探究
5.浓硫酸的性质探究
6.硝酸与铜
浓硝酸和稀硝酸均有强氧化性
2H2SO4(浓)+ Cu CuSO4 + SO2↑+ 2H2O
H2SO4(稀)+ Cu
4HNO3(浓)+ Cu 2NO2 + Cu(NO3)2 + 2H2O
8HNO3 + 3Cu 2NO↑+ 3Cu(NO3)2 + 4H2O
4HCl(浓)+MnO2 MnCl2+Cl2↑+2H2O
HCl(稀)+MnO2
△
△
△
△
三、重要的实验
(二)物质制备类
1.NH3 的制取
反应原理及反应物状态
→发生装置→除杂装置
→收集装置→尾气处理装置
三、重要的实验
(二)物质制备类
1.NH3 的制取
2.SO2 的制取
反应原理及反应物状态
→发生装置→除杂装置
→收集装置→尾气处理装置
三、重要的实验
(二)物质制备类
1.NH3 的制取
2.SO2 的制取
反应原理及反应物状态
→发生装置→除杂装置
→收集装置→尾气处理装置
三、重要的实验
(二)物质制备类
1.NH3 的制取
2.SO2 的制取
3.NO 的制取
4.NO2 的制取
反应原理及反应物状态
→发生装置→除杂装置
→收集装置→尾气处理装置
三、重要的实验
(三)物质检验类
1.SO4 的检验 (生成白色难溶于酸的沉淀)
问题1:为什么用氯化钡溶液而不能用硝酸钡溶液?
问题2:为什么要加入酸酸化,酸化时所加的是什么酸?
2-
三、重要的实验
(三)物质检验类
1.SO4 的检验 (生成白色难溶于酸的沉淀)
2.NH4 的检验 (生成溶于水显碱性的气体)
2-
+
三、重要的实验
(四)物质提纯类
粗盐的提纯
三、重要的实验
(四)物质提纯类
粗盐的提纯
粗盐
溶解
①
BaCl2溶液
②
NaOH 溶液
③
Na2CO3溶液
④
过滤
⑤
滤液
沉淀
盐酸
⑥
蒸发、结晶
烘干
精盐
除杂试剂的添加顺序
三、重要的实验——启示
1.认识物质性质的手段
2.运用物质性质的实际过程
3.培养获取证据的素养
4.发展做出结论的能力
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
