人教版九年级化学 课题1生活中常见的盐 课件(共43张PPT建议WPS打开)
文档属性
| 名称 | 人教版九年级化学 课题1生活中常见的盐 课件(共43张PPT建议WPS打开) |  | |
| 格式 | zip | ||
| 文件大小 | 20.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-05-20 14:14:27 | ||
图片预览









文档简介
(共43张PPT)
第十一单元 盐 化肥
课题1 生活中常见的盐
什么叫酸? 什么叫碱?
盐是如何定义的?
导入新知
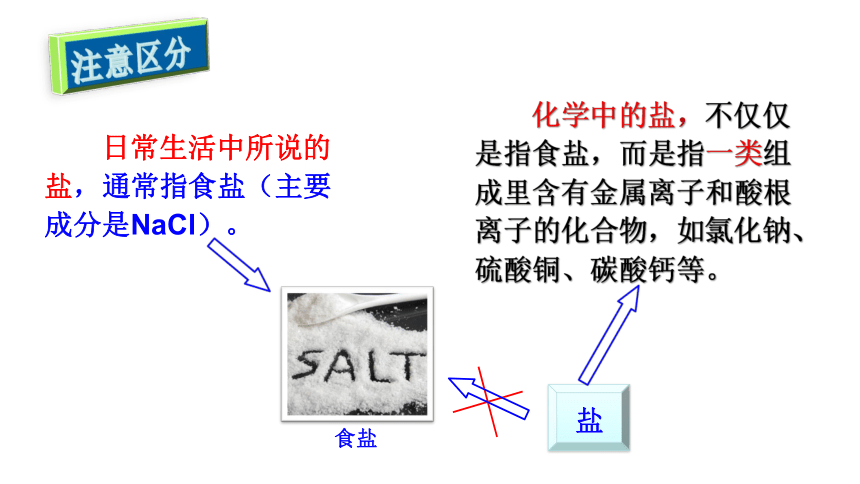
日常生活中所说的 盐,通常指食盐(主要 成分是NaCl)。
盐
食盐
化学中的盐,不仅仅 是指食盐,而是指一类组 成里含有金属离子和酸根 离子的化合物,如氯化钠、 硫酸铜、碳酸钙等。
如果对日常生活中所说的盐和化学中的 盐不加区分,有可能产生不良后果,如亚硝 酸钠(NaNO2)是一种工业用盐,具有强致癌 性,而且有剧毒,摄入0.2~0.5 g即可引起食 物中毒,3 g可致死。我国曾发生过多次将亚 硝酸钠(NaNO2)误作食盐用于烹调而引起 中毒的事件。
除食盐外,生活中你们还见过哪些盐?
碳酸钠(Na2CO3,俗称纯碱、苏打)
碳酸氢钠(NaHCO3,又叫小苏打)
高锰酸钾(KMnO4)
石灰石和大理石的 主要成分(CaCO3)
原从水中来, 不敢水中行。 人人都要我, 无我食不成。 打一物质
一、氯化钠( NaCl)
探究新知
食盐
食盐的用途
(1)食品——调味
&防腐
腌制时加入食盐可使微生物细胞脱水死 亡,进而延长食物的保质期。
用食盐腌渍蔬菜、鱼、肉、蛋等,使这 些食品风味独特,还可延长保质期。
医疗上的生理盐水是用氯化钠配制的(100mL 生理盐水中含有0.9g医用氯化钠)。
(2)生理盐水
(3)生理活动必不可少的物质
胃液的主要成分促生盐 酸、帮助消化、增进食欲
Na+
Cl-
维持细胞内外正常的水分 分布促进细胞内外物质交换
农业上用氯化
钠溶液来选种
工业上可以用 氯化钠为原料制 取多种化工产品
公路上的积雪可用氯化钠来消除
清晨喝一杯盐开水,可以治大便不通,喝盐开水 还可以治喉咙痛、牙痛;
每天用淡盐水开水漱口,可以预防各种口腔病;
误食有毒物,喝一些盐开水,有解毒作用;
豆腐易变质,如将食盐溶解在开水中,冷却后将 豆腐浸入,即使在夏天,也可保存数月;
食盐的妙用
花生油内含有水分,放久了会发臭,可将盐炒 热,凉后,按40千克油1千克盐的比例,加入 食盐,可以使花生油2~3年仍保持色香、味滑;
鲜花插入稀盐水里,可数日不谢;
新买的玻璃器皿,用盐煮一煮,不易破裂;
食盐的妙用
食盐的妙用
洗有颜色的衣服时,先用5%盐水浸泡10分钟, 然后再洗,则不易掉色;
洗有汗渍的白衣服,先在5%的盐水中揉一揉, 再用肥皂洗净,就不会出现黄色汗斑;
将胡萝卜砸碎拌上盐,可擦去衣服上的血迹;
铜器生锈或出现黑点,用盐可以擦掉。
【阅读材料】
在古罗马表示富有与贫穷,不看拥有黄 金的多少,而是比藏有食盐的数量,被历史上 称为食盐货币时代。我国的西藏过去也使用过 盐巴货币,为了换取生活必需的一小块盐巴, 需要付出昂贵的代价。贵州解放前只有少数人 家吃得起吊盐(吃完饭以后,用舌头在吊挂着 的盐块上舔一下)
黄帝克炎帝于阪泉,擒蚩尤于涿鹿,两者 实为一事。
——《中华五千年史》张其昀
炎、黄血战,实为食盐而起
氯化钠在自然界中分布很广,除海水里含有大量 的氯化钠外,盐湖、盐井和盐矿中也蕴藏着氯化钠。
波兰维莉奇卡盐矿
盐湖
盐井
我国的储盐量
我国储盐量很丰富,食盐的产地分布很广,过去很多地区缺盐, 是交通落后造成的。从东北到海南、台湾,从新疆、青海、川藏到 内蒙,出产着种类繁多的盐:海盐、井盐、岩盐、池盐等。其中辽 宁、山东、两淮、长芦各盐场盛产海盐,自古闻名。井盐则以已有 一千多年历史的四川自贡市的自流井最为有名,岩盐产于四川、云 南、湖北、湖南、新疆、青海等地。在陕西、山西、甘肃、青海、 新疆、内蒙古、黑龙江等地有很多咸水湖,盛产池盐,其中最大的 是柴达木盆地的察尔汗湖的食盐就可供我国十三亿人口食用四千多 年,那里盐层达30~60m厚,形状千姿百态,煞是壮观,人们用盐 盖房子,修公路,淹卤菜随便在地上挖个坑埋在里面就可以了。
美丽的盐景
大量粗盐从海水、盐湖水等析出
风吹日晒蒸发水分
蒸发溶剂结晶
蒸发池
结晶池
海水晒盐流程
水分 蒸发
粗盐
母液
继续 蒸发 水分
晾晒海水
煮盐井水、盐湖水
粗盐
蒸发溶剂结晶
NaCl
难溶性杂质 如泥沙等
可溶性杂质
(如CaCl2, MgCl2等)
粗盐
初步提纯
含有可溶性和不溶性杂质
视频:在三支分别盛有少量稀盐酸(HCl) 、氯化钠 (NaCl)溶液、氯化钾(KCl)
溶液的试管里,各滴入几滴硝酸银(AgNO3 )溶液和几滴稀硝酸( HNO3 ),观
察发生的现象。
AgNO3 + HCl = AgCl↓ + HNO3
不溶于稀硝酸 的白色沉淀
Ag+ +/NO3- + H+ +Cl- =AgCl↓ + H+ +N/O3-
AgNO3 + NaCl = AgCl↓ + NaNO3
Ag+ +/NO3- + Na+ +Cl- = AgCl↓ + Na+ +N/O3-
AgNO3 + KCl = AgCl↓ + KNO3
Ag+ +N/O3- + K+ +Cl- = AgCl↓ + K+ +N/O3-
Ag+ + Cl- = AgCl↓
Ag+ 和 Cl-不能在同一种溶液中共存
二、碳酸钠、碳酸氢钠和碳酸钙 碳酸钠( Na2CO3 )的用途
制造玻璃
造纸
纺 织
洗涤剂的生产
食品制造
天安门前的华表、人民大会堂 的许多柱子就是用大理石做的
碳酸钙(CaCO3)的用途
碳酸钙大量用于建筑业,天然存在的石灰石、大理石的 主要成分就是碳酸钙,它们都是重要的建筑材料。
碳酸钙还用 作补钙剂
在医疗上,它是 治疗胃酸过多症 的一种药剂
碳酸氢钠( NaHCO3 )的用途
碳酸氢钠是焙制糕点所用的 发酵粉的主要成分之一
CaCO3+2HCl=CaCl2+H2O+CO2↑
回忆实验室制取二氧化碳的化学反应原理 CaCO3+2HCl=CaCl2+H2CO3 H2CO3=H2O+CO2↑
盐酸腐蚀含碳酸钙的建材
【讨论】比较碳酸钙(CaCO3)与碳酸钠( Na2CO3 )和碳酸氢 钠( NaHCO3 )的组成,推断碳酸钠和碳酸氢钠是否也能发生 类似的反应。
碳酸钠+盐酸 碳酸氢钠+盐酸
现象 反应剧烈,产生大量气 泡,澄清的石灰水变浑浊 反应更剧烈,产生大量气
泡,澄清的石灰水变浑浊
分析 生成了二氧化碳 生成了二氧化碳
实验11-1
Na2CO3 +2HCl= 2NaCl+ H2O+CO2↑ NaHCO3+HCl = NaCl + H2O+CO2↑ CaCO3 +2HCl= CaCl2 + H2O+CO2↑
组成里含有碳酸根离子(CO32-)或碳酸氢根离子(HCO3-)的盐 跟盐酸等酸反应都能生成二氧化碳,利用这种反应可以检验盐中是 否含有碳酸根离子(CO32-)或碳酸氢根离子(HCO3-)。
碳酸氢钠( NaHCO3 ) 在医疗上可作治疗胃酸过多 症的一种药剂的化学反应原 理是什么?
NaHCO3+HCl = NaCl + H2O+CO2↑
【讨论】浓硫酸沾在皮肤或衣服上,立 即用大量的水冲洗,还要涂上3%-5%的 碳酸氢钠溶液的原因是什么?
2 NaHCO3 + H2SO4= Na2SO4+ 2 H2O +2 CO2↑
类 比
NaHCO3+HCl = NaCl + H2O+CO2↑
实验11-2
现 象 产生白色沉淀
分 析 白色沉淀是CaCO3
Ca(OH)2+Na2CO3= CaCO3↓+2NaOH
这个反应可用 来制造氢氧化钠
碳酸钠溶液
澄清石灰水
一种盐转化为另一种盐
一种碱转化为另一种碱
Na2CO3 +2HCl= 2NaCl+ H2O+CO2↑
H2CO3
Ca(OH)2+Na2CO3= CaCO3↓+2NaOH CaCO3 +2HCl= CaCl2 + H2O+CO2↑
NaHCO3+HCl = NaCl + H2O+CO2↑
【讨论】 上述反应中,生成物的成分与反应物的成分有什么特点? 上述反应都发生在溶液中,反应物都是酸、碱、盐,酸、
碱、盐溶液中两种化合物之间互相交换成分,生成另外两种化
酸、碱、盐
合物的反应叫复分解反应。
+ +
AB + CD → AD + CB
实验11-3
CuSO4溶液+ NaOH溶液 CuSO4溶液+ BaCl2溶液
现 象 有蓝色沉淀生成 有沉淀生成
化学方程式 CuSO4+2NaOH= Cu(OH)2↓+ Na2SO4 CuSO4+BaCl2=
BaSO4↓ + CuCl2
生成物是什么?
3.碳酸钠、碳酸钙等含碳酸根的盐与盐酸发生复分解反应时,可观察到的共同现象
是什么?
都有气体产生。
【讨论】
上述两个反应是否属于复分解反应?观察到的现象有什么共同之处?
是复分解反应, 都有沉淀生成
前面学过的酸碱中和反应是否也属于复分解反应?中和反应的生成物中,相同的
是复分解反应, 都有水生成
复分解反应发生的条件
酸、碱、盐之间并不是都能发 生复分解反应。只有当两种化合物 互相交换成分,生成物中有沉淀或 有气体或有水生成时,复分解反应 才可能发生。
Fe2O3 + 3 H2SO4 =
Fe2(SO4)3
+ 3 H2O
CuO + H2SO4 = CuSO4 + H2O
CuO + 2HCl = CuCl2 + H2O
Na2O + H2SO4 = Na2SO4 + H2O
Na2O + 2HCl = 2NaCl + H2O
Fe2O3 + 6 HCl =2 FeCl3 + 3 H2O
酸、碱、盐之间的反应是复分解反应,酸跟
一些金属氧化物的反应也是复分解反应。
根据复分解反应发生的条件,并利用书后附录Ⅰ所提供
的有关酸、碱、盐溶解性的信息,判断下列化合物的溶液两两之 间是否能发生反应。
探究
NaOH溶液 NaCl溶液 K2CO3溶液 Ba(NO3)2溶液
稀硫酸 能反应 不能反应 能反应 能反应
判断依据 有水生成 没有沉淀、气 体或水生成 有气体、 水生成 有沉淀生成
H2SO4 + 2NaOH = Na2SO4 + 2H2O NaCl + H2SO4/→ Na2SO4 + HCl
K2CO3 + H2SO4 = K2SO4 + H2O + CO2↑
Ba(NO3)2 + H2SO4 = BaSO4 ↓+ 2HNO3
在复分解反应中,元素的化合价
Fe2O3 + 3 H2SO4 = Fe2(SO4)3 +3 H2O
NaOH + HCl = NaCl + H2O
复分解反应的特点:双交换,价不变
+1 -2
+1 -1
+1 -2
-2
+3 -2 +1 +3 -2
+1 -2 +1 +1 -1
部分酸、碱和盐的溶解性表(室温)
酸、碱和盐
的溶解性口诀 钾钠铵盐硝盐溶; 盐酸盐不溶氯化银; 硫酸盐不溶硫酸钡; 碳酸盐可溶钾钠铵; 酸类多数可溶解; 碱类可溶钾钠钡。
说明:“溶”表示那种物质可溶于水,“不”表示不溶于水,“微”表示微溶 于水,“挥”表示挥发性,“—”表示那种物质不存在或者遇到水就分解了。
指“硝酸盐”
一些不溶性碱的制取
2NaOH+MgCl2 =Mg(OH)2↓+2NaCl
3NaOH+AlCl3=Al(OH)3↓+3NaCl
2NaOH+FeSO4=Fe(OH)2↓+Na2SO4
3NaOH+FeCl3= Fe(OH)3↓+3NaCl
2NaOH+CuSO4=Cu(OH)2↓+Na2SO4
化 合 反 应 分 解 反 应 置 换 反 应 复 分 解 反 应
定
义 由两种或 两种以上 物质生成 另一种物 质的反应 由一种物质 生成两种或 两种以上其 它物质的反 应 由一种单质与 一种化合物反 应,生成另一 种单质与另一 种化合物的反 应 由两种化合物 互相交换成分 生成另外两种 化合物的反应
类 型 A+B→AB AB→A+B+ … . AB + C→ A + CB AB + CD→ AD+ CB
特 征 反应物为多 种而生成物 只有一种, 即“多变一 ” 反应物只有 一种而生成 物有多种, 即“一变多 反应物与生 成物都是两 种,且都是 ” 单质和化合
物 反应物和生成 物都为化合物
化学反应的基本类型
利 用 分 类 的 方 法 学 习 化 学
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
利 用 分 类 的 方 法 学 习 化 学
我国制碱工业的先驱—侯德榜
碳酸钠用途非常广泛。纯碱工业创 始于18世纪,在很长一段时间内制碱技 术把持在英、法德、美等西方国家手中
。1921年正在美国留学的侯德榜先生为 了发展我国的民族工业,应爱国实业家 范旭东先生之邀毅然回国,潜心研究制 碱技术,成功地摸索和改进了西方的制 碱方法,发明了将制碱与制氨结合起来 的联合制碱法(又称侯氏制碱法)。侯德 榜为纯碱和氮肥工业技术的发展做出了 杰出的贡献。
指“纯碱”
课堂小结
氯化钠、碳酸钠、碳酸氢钠和碳酸钙等盐在生 活和生产中都有广泛的用途。
可以通过过滤、蒸发等方法分离混合物,例如 使粗盐提纯。
组成里含有碳酸根离子(CO32-)或碳酸氢根离
子(HCO3-)的盐都能与盐酸反应,生成二氧化碳气体。
盐、酸、碱之间可以发生复分解反应,反应发 生的条件是有沉淀或气体或水生成。
第十一单元 盐 化肥
课题1 生活中常见的盐
什么叫酸? 什么叫碱?
盐是如何定义的?
导入新知
日常生活中所说的 盐,通常指食盐(主要 成分是NaCl)。
盐
食盐
化学中的盐,不仅仅 是指食盐,而是指一类组 成里含有金属离子和酸根 离子的化合物,如氯化钠、 硫酸铜、碳酸钙等。
如果对日常生活中所说的盐和化学中的 盐不加区分,有可能产生不良后果,如亚硝 酸钠(NaNO2)是一种工业用盐,具有强致癌 性,而且有剧毒,摄入0.2~0.5 g即可引起食 物中毒,3 g可致死。我国曾发生过多次将亚 硝酸钠(NaNO2)误作食盐用于烹调而引起 中毒的事件。
除食盐外,生活中你们还见过哪些盐?
碳酸钠(Na2CO3,俗称纯碱、苏打)
碳酸氢钠(NaHCO3,又叫小苏打)
高锰酸钾(KMnO4)
石灰石和大理石的 主要成分(CaCO3)
原从水中来, 不敢水中行。 人人都要我, 无我食不成。 打一物质
一、氯化钠( NaCl)
探究新知
食盐
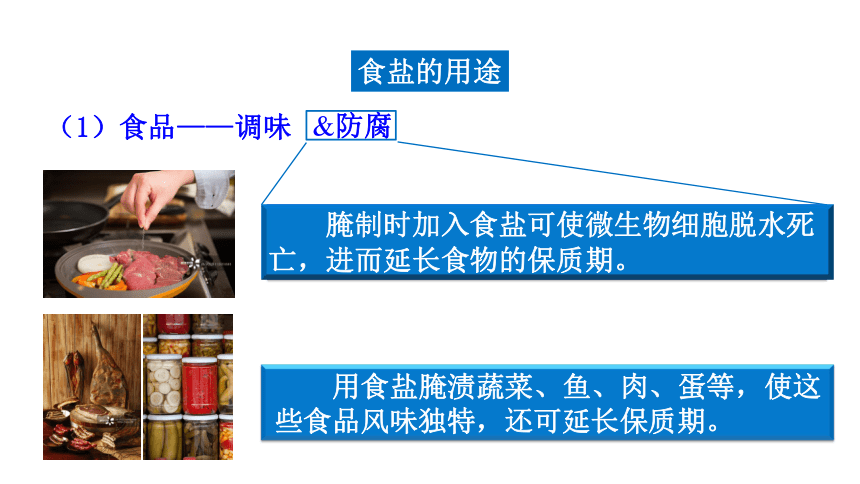
食盐的用途
(1)食品——调味
&防腐
腌制时加入食盐可使微生物细胞脱水死 亡,进而延长食物的保质期。
用食盐腌渍蔬菜、鱼、肉、蛋等,使这 些食品风味独特,还可延长保质期。
医疗上的生理盐水是用氯化钠配制的(100mL 生理盐水中含有0.9g医用氯化钠)。
(2)生理盐水
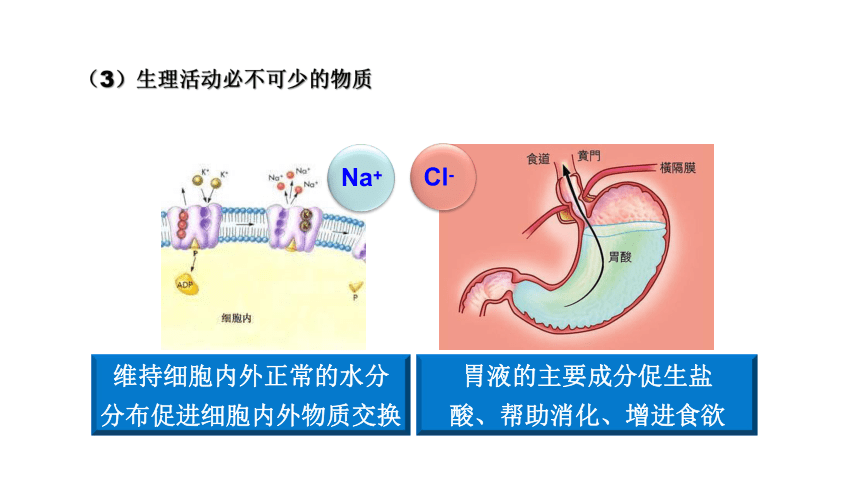
(3)生理活动必不可少的物质
胃液的主要成分促生盐 酸、帮助消化、增进食欲
Na+
Cl-
维持细胞内外正常的水分 分布促进细胞内外物质交换
农业上用氯化
钠溶液来选种
工业上可以用 氯化钠为原料制 取多种化工产品
公路上的积雪可用氯化钠来消除
清晨喝一杯盐开水,可以治大便不通,喝盐开水 还可以治喉咙痛、牙痛;
每天用淡盐水开水漱口,可以预防各种口腔病;
误食有毒物,喝一些盐开水,有解毒作用;
豆腐易变质,如将食盐溶解在开水中,冷却后将 豆腐浸入,即使在夏天,也可保存数月;
食盐的妙用
花生油内含有水分,放久了会发臭,可将盐炒 热,凉后,按40千克油1千克盐的比例,加入 食盐,可以使花生油2~3年仍保持色香、味滑;
鲜花插入稀盐水里,可数日不谢;
新买的玻璃器皿,用盐煮一煮,不易破裂;
食盐的妙用
食盐的妙用
洗有颜色的衣服时,先用5%盐水浸泡10分钟, 然后再洗,则不易掉色;
洗有汗渍的白衣服,先在5%的盐水中揉一揉, 再用肥皂洗净,就不会出现黄色汗斑;
将胡萝卜砸碎拌上盐,可擦去衣服上的血迹;
铜器生锈或出现黑点,用盐可以擦掉。
【阅读材料】
在古罗马表示富有与贫穷,不看拥有黄 金的多少,而是比藏有食盐的数量,被历史上 称为食盐货币时代。我国的西藏过去也使用过 盐巴货币,为了换取生活必需的一小块盐巴, 需要付出昂贵的代价。贵州解放前只有少数人 家吃得起吊盐(吃完饭以后,用舌头在吊挂着 的盐块上舔一下)
黄帝克炎帝于阪泉,擒蚩尤于涿鹿,两者 实为一事。
——《中华五千年史》张其昀
炎、黄血战,实为食盐而起
氯化钠在自然界中分布很广,除海水里含有大量 的氯化钠外,盐湖、盐井和盐矿中也蕴藏着氯化钠。
波兰维莉奇卡盐矿
盐湖
盐井
我国的储盐量
我国储盐量很丰富,食盐的产地分布很广,过去很多地区缺盐, 是交通落后造成的。从东北到海南、台湾,从新疆、青海、川藏到 内蒙,出产着种类繁多的盐:海盐、井盐、岩盐、池盐等。其中辽 宁、山东、两淮、长芦各盐场盛产海盐,自古闻名。井盐则以已有 一千多年历史的四川自贡市的自流井最为有名,岩盐产于四川、云 南、湖北、湖南、新疆、青海等地。在陕西、山西、甘肃、青海、 新疆、内蒙古、黑龙江等地有很多咸水湖,盛产池盐,其中最大的 是柴达木盆地的察尔汗湖的食盐就可供我国十三亿人口食用四千多 年,那里盐层达30~60m厚,形状千姿百态,煞是壮观,人们用盐 盖房子,修公路,淹卤菜随便在地上挖个坑埋在里面就可以了。
美丽的盐景
大量粗盐从海水、盐湖水等析出
风吹日晒蒸发水分
蒸发溶剂结晶
蒸发池
结晶池
海水晒盐流程
水分 蒸发
粗盐
母液
继续 蒸发 水分
晾晒海水
煮盐井水、盐湖水
粗盐
蒸发溶剂结晶
NaCl
难溶性杂质 如泥沙等
可溶性杂质
(如CaCl2, MgCl2等)
粗盐
初步提纯
含有可溶性和不溶性杂质
视频:在三支分别盛有少量稀盐酸(HCl) 、氯化钠 (NaCl)溶液、氯化钾(KCl)
溶液的试管里,各滴入几滴硝酸银(AgNO3 )溶液和几滴稀硝酸( HNO3 ),观
察发生的现象。
AgNO3 + HCl = AgCl↓ + HNO3
不溶于稀硝酸 的白色沉淀
Ag+ +/NO3- + H+ +Cl- =AgCl↓ + H+ +N/O3-
AgNO3 + NaCl = AgCl↓ + NaNO3
Ag+ +/NO3- + Na+ +Cl- = AgCl↓ + Na+ +N/O3-
AgNO3 + KCl = AgCl↓ + KNO3
Ag+ +N/O3- + K+ +Cl- = AgCl↓ + K+ +N/O3-
Ag+ + Cl- = AgCl↓
Ag+ 和 Cl-不能在同一种溶液中共存
二、碳酸钠、碳酸氢钠和碳酸钙 碳酸钠( Na2CO3 )的用途
制造玻璃
造纸
纺 织
洗涤剂的生产
食品制造
天安门前的华表、人民大会堂 的许多柱子就是用大理石做的
碳酸钙(CaCO3)的用途
碳酸钙大量用于建筑业,天然存在的石灰石、大理石的 主要成分就是碳酸钙,它们都是重要的建筑材料。
碳酸钙还用 作补钙剂
在医疗上,它是 治疗胃酸过多症 的一种药剂
碳酸氢钠( NaHCO3 )的用途
碳酸氢钠是焙制糕点所用的 发酵粉的主要成分之一
CaCO3+2HCl=CaCl2+H2O+CO2↑
回忆实验室制取二氧化碳的化学反应原理 CaCO3+2HCl=CaCl2+H2CO3 H2CO3=H2O+CO2↑
盐酸腐蚀含碳酸钙的建材
【讨论】比较碳酸钙(CaCO3)与碳酸钠( Na2CO3 )和碳酸氢 钠( NaHCO3 )的组成,推断碳酸钠和碳酸氢钠是否也能发生 类似的反应。
碳酸钠+盐酸 碳酸氢钠+盐酸
现象 反应剧烈,产生大量气 泡,澄清的石灰水变浑浊 反应更剧烈,产生大量气
泡,澄清的石灰水变浑浊
分析 生成了二氧化碳 生成了二氧化碳
实验11-1
Na2CO3 +2HCl= 2NaCl+ H2O+CO2↑ NaHCO3+HCl = NaCl + H2O+CO2↑ CaCO3 +2HCl= CaCl2 + H2O+CO2↑
组成里含有碳酸根离子(CO32-)或碳酸氢根离子(HCO3-)的盐 跟盐酸等酸反应都能生成二氧化碳,利用这种反应可以检验盐中是 否含有碳酸根离子(CO32-)或碳酸氢根离子(HCO3-)。
碳酸氢钠( NaHCO3 ) 在医疗上可作治疗胃酸过多 症的一种药剂的化学反应原 理是什么?
NaHCO3+HCl = NaCl + H2O+CO2↑
【讨论】浓硫酸沾在皮肤或衣服上,立 即用大量的水冲洗,还要涂上3%-5%的 碳酸氢钠溶液的原因是什么?
2 NaHCO3 + H2SO4= Na2SO4+ 2 H2O +2 CO2↑
类 比
NaHCO3+HCl = NaCl + H2O+CO2↑
实验11-2
现 象 产生白色沉淀
分 析 白色沉淀是CaCO3
Ca(OH)2+Na2CO3= CaCO3↓+2NaOH
这个反应可用 来制造氢氧化钠
碳酸钠溶液
澄清石灰水
一种盐转化为另一种盐
一种碱转化为另一种碱
Na2CO3 +2HCl= 2NaCl+ H2O+CO2↑
H2CO3
Ca(OH)2+Na2CO3= CaCO3↓+2NaOH CaCO3 +2HCl= CaCl2 + H2O+CO2↑
NaHCO3+HCl = NaCl + H2O+CO2↑
【讨论】 上述反应中,生成物的成分与反应物的成分有什么特点? 上述反应都发生在溶液中,反应物都是酸、碱、盐,酸、
碱、盐溶液中两种化合物之间互相交换成分,生成另外两种化
酸、碱、盐
合物的反应叫复分解反应。
+ +
AB + CD → AD + CB
实验11-3
CuSO4溶液+ NaOH溶液 CuSO4溶液+ BaCl2溶液
现 象 有蓝色沉淀生成 有沉淀生成
化学方程式 CuSO4+2NaOH= Cu(OH)2↓+ Na2SO4 CuSO4+BaCl2=
BaSO4↓ + CuCl2
生成物是什么?
3.碳酸钠、碳酸钙等含碳酸根的盐与盐酸发生复分解反应时,可观察到的共同现象
是什么?
都有气体产生。
【讨论】
上述两个反应是否属于复分解反应?观察到的现象有什么共同之处?
是复分解反应, 都有沉淀生成
前面学过的酸碱中和反应是否也属于复分解反应?中和反应的生成物中,相同的
是复分解反应, 都有水生成
复分解反应发生的条件
酸、碱、盐之间并不是都能发 生复分解反应。只有当两种化合物 互相交换成分,生成物中有沉淀或 有气体或有水生成时,复分解反应 才可能发生。
Fe2O3 + 3 H2SO4 =
Fe2(SO4)3
+ 3 H2O
CuO + H2SO4 = CuSO4 + H2O
CuO + 2HCl = CuCl2 + H2O
Na2O + H2SO4 = Na2SO4 + H2O
Na2O + 2HCl = 2NaCl + H2O
Fe2O3 + 6 HCl =2 FeCl3 + 3 H2O
酸、碱、盐之间的反应是复分解反应,酸跟
一些金属氧化物的反应也是复分解反应。
根据复分解反应发生的条件,并利用书后附录Ⅰ所提供
的有关酸、碱、盐溶解性的信息,判断下列化合物的溶液两两之 间是否能发生反应。
探究
NaOH溶液 NaCl溶液 K2CO3溶液 Ba(NO3)2溶液
稀硫酸 能反应 不能反应 能反应 能反应
判断依据 有水生成 没有沉淀、气 体或水生成 有气体、 水生成 有沉淀生成
H2SO4 + 2NaOH = Na2SO4 + 2H2O NaCl + H2SO4/→ Na2SO4 + HCl
K2CO3 + H2SO4 = K2SO4 + H2O + CO2↑
Ba(NO3)2 + H2SO4 = BaSO4 ↓+ 2HNO3
在复分解反应中,元素的化合价
Fe2O3 + 3 H2SO4 = Fe2(SO4)3 +3 H2O
NaOH + HCl = NaCl + H2O
复分解反应的特点:双交换,价不变
+1 -2
+1 -1
+1 -2
-2
+3 -2 +1 +3 -2
+1 -2 +1 +1 -1
部分酸、碱和盐的溶解性表(室温)
酸、碱和盐
的溶解性口诀 钾钠铵盐硝盐溶; 盐酸盐不溶氯化银; 硫酸盐不溶硫酸钡; 碳酸盐可溶钾钠铵; 酸类多数可溶解; 碱类可溶钾钠钡。
说明:“溶”表示那种物质可溶于水,“不”表示不溶于水,“微”表示微溶 于水,“挥”表示挥发性,“—”表示那种物质不存在或者遇到水就分解了。
指“硝酸盐”
一些不溶性碱的制取
2NaOH+MgCl2 =Mg(OH)2↓+2NaCl
3NaOH+AlCl3=Al(OH)3↓+3NaCl
2NaOH+FeSO4=Fe(OH)2↓+Na2SO4
3NaOH+FeCl3= Fe(OH)3↓+3NaCl
2NaOH+CuSO4=Cu(OH)2↓+Na2SO4
化 合 反 应 分 解 反 应 置 换 反 应 复 分 解 反 应
定
义 由两种或 两种以上 物质生成 另一种物 质的反应 由一种物质 生成两种或 两种以上其 它物质的反 应 由一种单质与 一种化合物反 应,生成另一 种单质与另一 种化合物的反 应 由两种化合物 互相交换成分 生成另外两种 化合物的反应
类 型 A+B→AB AB→A+B+ … . AB + C→ A + CB AB + CD→ AD+ CB
特 征 反应物为多 种而生成物 只有一种, 即“多变一 ” 反应物只有 一种而生成 物有多种, 即“一变多 反应物与生 成物都是两 种,且都是 ” 单质和化合
物 反应物和生成 物都为化合物
化学反应的基本类型
利 用 分 类 的 方 法 学 习 化 学
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
利 用 分 类 的 方 法 学 习 化 学
我国制碱工业的先驱—侯德榜
碳酸钠用途非常广泛。纯碱工业创 始于18世纪,在很长一段时间内制碱技 术把持在英、法德、美等西方国家手中
。1921年正在美国留学的侯德榜先生为 了发展我国的民族工业,应爱国实业家 范旭东先生之邀毅然回国,潜心研究制 碱技术,成功地摸索和改进了西方的制 碱方法,发明了将制碱与制氨结合起来 的联合制碱法(又称侯氏制碱法)。侯德 榜为纯碱和氮肥工业技术的发展做出了 杰出的贡献。
指“纯碱”
课堂小结
氯化钠、碳酸钠、碳酸氢钠和碳酸钙等盐在生 活和生产中都有广泛的用途。
可以通过过滤、蒸发等方法分离混合物,例如 使粗盐提纯。
组成里含有碳酸根离子(CO32-)或碳酸氢根离
子(HCO3-)的盐都能与盐酸反应,生成二氧化碳气体。
盐、酸、碱之间可以发生复分解反应,反应发 生的条件是有沉淀或气体或水生成。
同课章节目录
