苏教版高二化学选修5 有机化学基础专题4第三单元 醛 羧酸(共22张PPT)
文档属性
| 名称 | 苏教版高二化学选修5 有机化学基础专题4第三单元 醛 羧酸(共22张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 491.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-05-19 21:17:35 | ||
图片预览



文档简介
(共22张PPT)
乙 醛
教学目的
1.了解乙醛的物理性质
2.理解乙醛的分子组成
3.理解乙醛的性质(加氢还原、催化氧化),有机氧化还原反应的判断
4.记住乙醛与银氨溶液、新制氢氧化铜反应的现象,学会醛基的检验方法。
教学重点
乙醛的化学性质
教学难点
乙醛的银镜反应与乙醛和新制氢氧化铜的反应
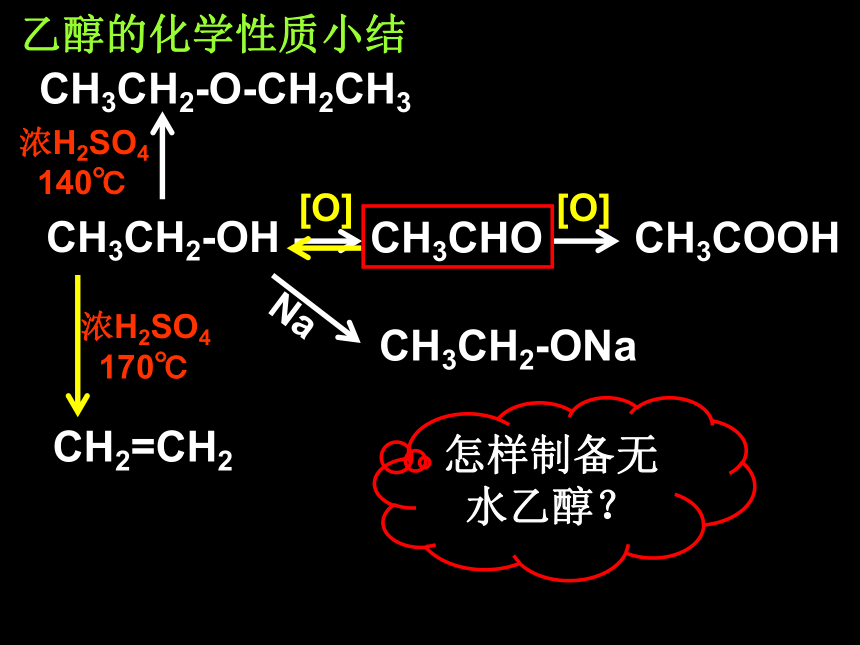
怎样制备无水乙醇?
CH3CH2-OH
CH3CHO
CH3COOH
[O]
[O]
CH3CH2-ONa
CH2=CH2
CH3CH2-O-CH2CH3
乙醇的化学性质小结
Na
浓H2SO4
170℃
浓H2SO4
140℃
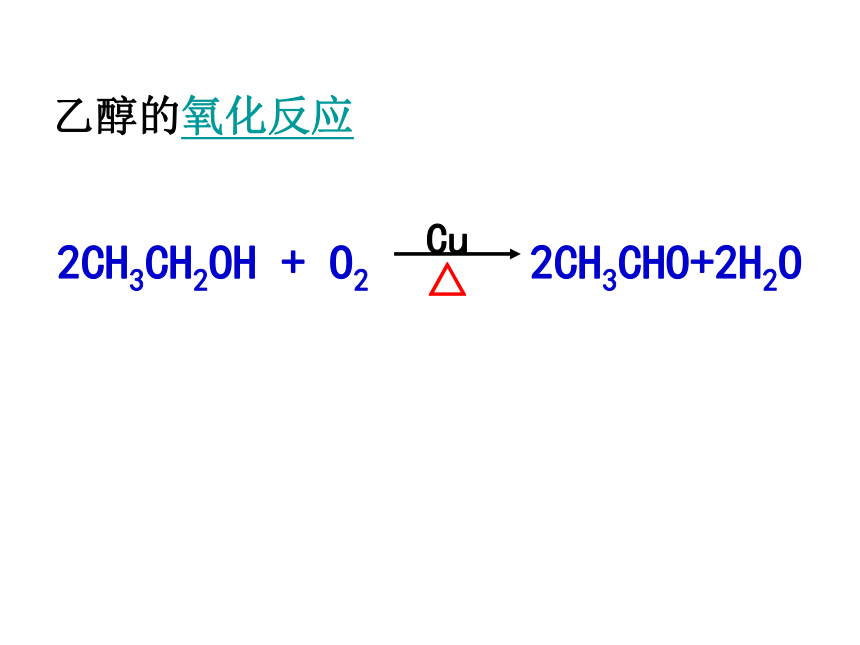
乙醇的氧化反应
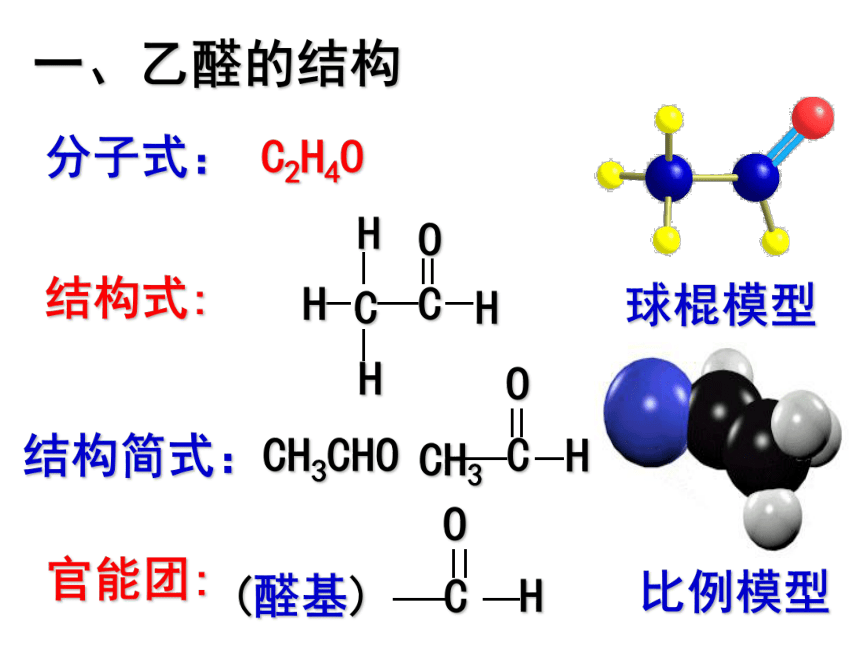
一、乙醛的结构
结构式:
比例模型
球棍模型
分子式: C2H4O
官能团:
乙醛是无色、有刺激性气味的液体,易挥发,密度比水小,熔沸点低,沸点是 20.80C,易溶于水、乙醇、乙醚、氯仿等。
二、乙醛的物理性质
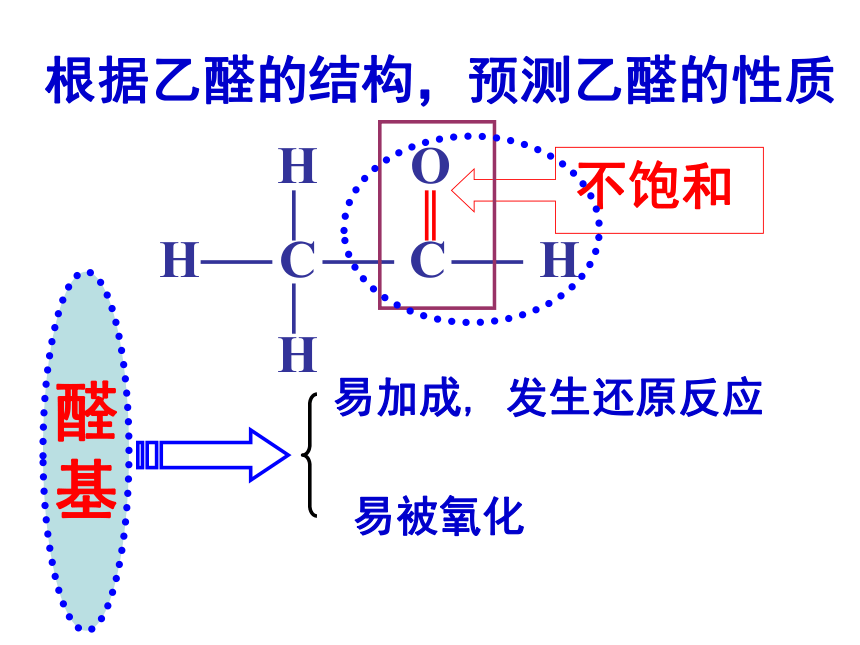
根据乙醛的结构,预测乙醛的性质
H O
H C C H
H
醛
基
易被氧化
三、乙醛的化学性质
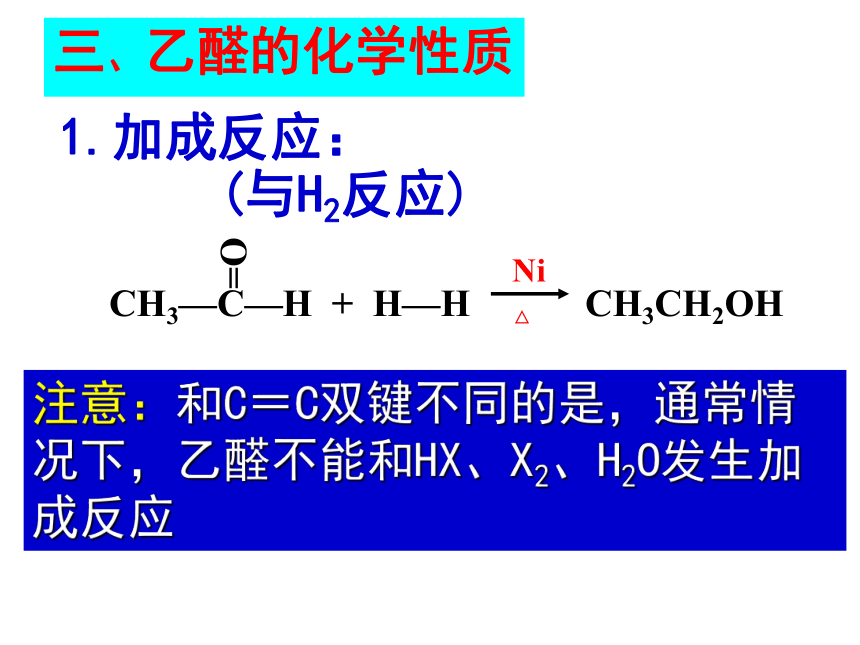
1、加成反应
加成反应:
(与H2反应)
有机物只得氢或去氧, 发生还原反应
有机物只得氧或去氢, 发生氧化反应
注意:和C=C双键不同的是,通常情况下,乙醛不能和HX、X2、H2O发生加成反应
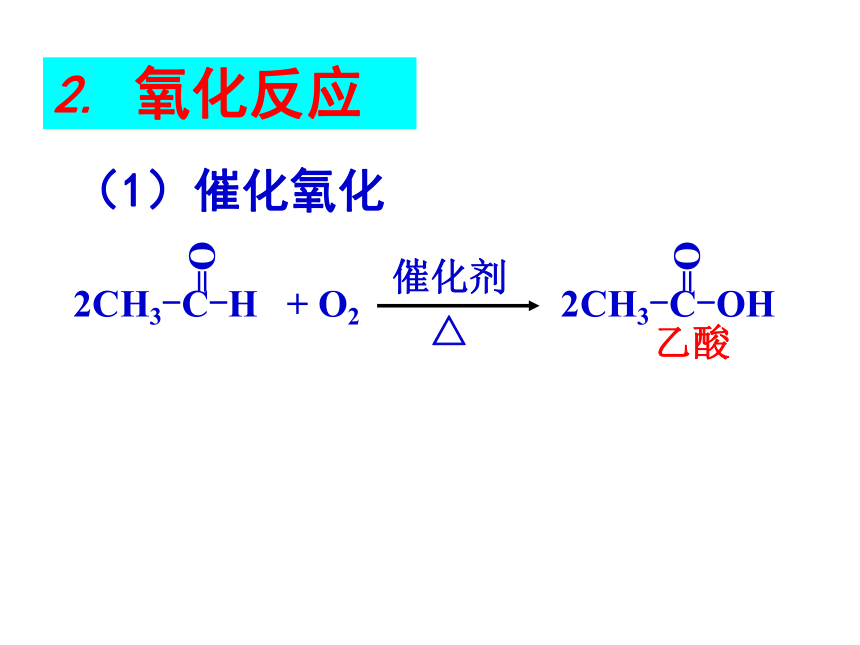
2. 氧化反应
(1)催化氧化
乙酸
Ag++NH3·H2O=AgOH ↓+ NH4+
AgOH+2 NH3·H2O=[Ag(NH3)2] OH+2H2O
实验步骤:
1.在洁净的试管里加入1 mL2%的AgNO3溶液,
2. 一边逐滴滴入2%的稀氨水,一边摇动试管,至最初产生的沉淀恰好溶解为止(这时得到的溶液叫做银氨溶液)。
3.滴入3滴乙醛,振荡后把试管放在热水中温热,静置。观察实验现象。
(2) 银镜反应---与银氨溶液的反应
(2) 银镜反应---与银氨溶液的反应
1.试管内壁应洁净。
2.必须用水浴加热,不能用酒精灯加热。
3.加热时不能振荡试管和摇动试管。
4.配制银氨溶液时,氨水不能过多或过少[只能加到沉淀刚好消失]。
做银镜反应的注意几个事项
思考
银镜反应的条件一般控制在碱性。如果反应条件为酸性,实验结果将如何?
在试管里加入5%的NaOH溶液2 mL,滴入2%的CuSO4溶液4滴~6滴,振荡后加入乙醛溶液0.5?mL,加热至沸腾。
观察实验现象。
可以看到,溶液中有红色沉淀产生。该红色沉淀是Cu2O。
(3)乙醛与新制Cu(OH)2悬浊液的反应
Cu2++2OH- = Cu(OH)2(新制蓝色絮状)
△
2Cu(OH)2+CH3CHO+NaOH
该实验可用于检验醛基的存在.
1.Cu(OH)2应现配现用;
2.成功条件:碱性环境、加热.
注意
CH3COONa+Cu2O↓+3H2O
取1mol/L的CuSO4溶液2mL和0.4mol/L的NaOH溶液2mL,在一个试管里混合后加入0.5mL 40%的乙醛溶液加热至沸腾,无砖红色沉淀产生。实验失败的原因是( ) A.NaOH的量不够?????????? B.CuSO4的量不够 C.乙醛浓度低 D.加热时间短
A
练一练
醛基的检验方法:
(1)与新制的银氨溶液反应有光亮的银镜生成
(2)与新制的Cu(OH)2共热煮沸有红色沉淀生成
思考:
乙醛能否使酸性KMnO4溶液褪色?
.甲醛
⑴分子结构:分子式为CH2O;结构式为
结构简式为HCHO; 甲醛的结构:
可看成是含有两个醛基,甲醛分子中的4个原子是共平面的。
⑵物理性质和用途
甲醛是蚂蚁体内分泌出的一种物质,所以又叫蚁醛。是一种无色具有强烈刺激性气味、有毒的气体,易溶于水。质量分数为35%~40%的甲醛水溶液叫福尔马林,具有杀菌和防腐能力。
注意:烃的含氧衍生物中,常温下甲醛是惟一的气态物质。
(生活常识)甲醛具有强烈的致癌作用和促癌作用,低浓度时会发生气喘、刺激眼睛流泪,高浓度时引起恶心、呕吐、咳嗽、胸闷甚至死亡,我国室内空气甲醛浓度的最大允许值为0.08mg/m3,而美国、英国等则不允许有。
加成反应
氧化反应
乙 醛
小结:乙醛的化学性质
与氧气反应
与银氨溶液反应
与新制的氢氧化铜反应
与氢气反应
反馈练习
1、下列混合溶液可以用分液漏斗分离的一组是 ( )
A、乙醛和水 B、乙醛和乙醇 C、乙醇和水 D、苯和水
D
2.关于CH2=CH-CHO的说法错误的是( )
A.能使酸性高锰酸钾和溴水褪色
B.在一定条件下能被空气氧化
C.能发生银镜反应,表现出氧化性
D.在一定条件下,能与氢气反应生成1-丙醇
C
乙 醛
教学目的
1.了解乙醛的物理性质
2.理解乙醛的分子组成
3.理解乙醛的性质(加氢还原、催化氧化),有机氧化还原反应的判断
4.记住乙醛与银氨溶液、新制氢氧化铜反应的现象,学会醛基的检验方法。
教学重点
乙醛的化学性质
教学难点
乙醛的银镜反应与乙醛和新制氢氧化铜的反应
怎样制备无水乙醇?
CH3CH2-OH
CH3CHO
CH3COOH
[O]
[O]
CH3CH2-ONa
CH2=CH2
CH3CH2-O-CH2CH3
乙醇的化学性质小结
Na
浓H2SO4
170℃
浓H2SO4
140℃
乙醇的氧化反应
一、乙醛的结构
结构式:
比例模型
球棍模型
分子式: C2H4O
官能团:
乙醛是无色、有刺激性气味的液体,易挥发,密度比水小,熔沸点低,沸点是 20.80C,易溶于水、乙醇、乙醚、氯仿等。
二、乙醛的物理性质
根据乙醛的结构,预测乙醛的性质
H O
H C C H
H
醛
基
易被氧化
三、乙醛的化学性质
1、加成反应
加成反应:
(与H2反应)
有机物只得氢或去氧, 发生还原反应
有机物只得氧或去氢, 发生氧化反应
注意:和C=C双键不同的是,通常情况下,乙醛不能和HX、X2、H2O发生加成反应
2. 氧化反应
(1)催化氧化
乙酸
Ag++NH3·H2O=AgOH ↓+ NH4+
AgOH+2 NH3·H2O=[Ag(NH3)2] OH+2H2O
实验步骤:
1.在洁净的试管里加入1 mL2%的AgNO3溶液,
2. 一边逐滴滴入2%的稀氨水,一边摇动试管,至最初产生的沉淀恰好溶解为止(这时得到的溶液叫做银氨溶液)。
3.滴入3滴乙醛,振荡后把试管放在热水中温热,静置。观察实验现象。
(2) 银镜反应---与银氨溶液的反应
(2) 银镜反应---与银氨溶液的反应
1.试管内壁应洁净。
2.必须用水浴加热,不能用酒精灯加热。
3.加热时不能振荡试管和摇动试管。
4.配制银氨溶液时,氨水不能过多或过少[只能加到沉淀刚好消失]。
做银镜反应的注意几个事项
思考
银镜反应的条件一般控制在碱性。如果反应条件为酸性,实验结果将如何?
在试管里加入5%的NaOH溶液2 mL,滴入2%的CuSO4溶液4滴~6滴,振荡后加入乙醛溶液0.5?mL,加热至沸腾。
观察实验现象。
可以看到,溶液中有红色沉淀产生。该红色沉淀是Cu2O。
(3)乙醛与新制Cu(OH)2悬浊液的反应
Cu2++2OH- = Cu(OH)2(新制蓝色絮状)
△
2Cu(OH)2+CH3CHO+NaOH
该实验可用于检验醛基的存在.
1.Cu(OH)2应现配现用;
2.成功条件:碱性环境、加热.
注意
CH3COONa+Cu2O↓+3H2O
取1mol/L的CuSO4溶液2mL和0.4mol/L的NaOH溶液2mL,在一个试管里混合后加入0.5mL 40%的乙醛溶液加热至沸腾,无砖红色沉淀产生。实验失败的原因是( ) A.NaOH的量不够?????????? B.CuSO4的量不够 C.乙醛浓度低 D.加热时间短
A
练一练
醛基的检验方法:
(1)与新制的银氨溶液反应有光亮的银镜生成
(2)与新制的Cu(OH)2共热煮沸有红色沉淀生成
思考:
乙醛能否使酸性KMnO4溶液褪色?
.甲醛
⑴分子结构:分子式为CH2O;结构式为
结构简式为HCHO; 甲醛的结构:
可看成是含有两个醛基,甲醛分子中的4个原子是共平面的。
⑵物理性质和用途
甲醛是蚂蚁体内分泌出的一种物质,所以又叫蚁醛。是一种无色具有强烈刺激性气味、有毒的气体,易溶于水。质量分数为35%~40%的甲醛水溶液叫福尔马林,具有杀菌和防腐能力。
注意:烃的含氧衍生物中,常温下甲醛是惟一的气态物质。
(生活常识)甲醛具有强烈的致癌作用和促癌作用,低浓度时会发生气喘、刺激眼睛流泪,高浓度时引起恶心、呕吐、咳嗽、胸闷甚至死亡,我国室内空气甲醛浓度的最大允许值为0.08mg/m3,而美国、英国等则不允许有。
加成反应
氧化反应
乙 醛
小结:乙醛的化学性质
与氧气反应
与银氨溶液反应
与新制的氢氧化铜反应
与氢气反应
反馈练习
1、下列混合溶液可以用分液漏斗分离的一组是 ( )
A、乙醛和水 B、乙醛和乙醇 C、乙醇和水 D、苯和水
D
2.关于CH2=CH-CHO的说法错误的是( )
A.能使酸性高锰酸钾和溴水褪色
B.在一定条件下能被空气氧化
C.能发生银镜反应,表现出氧化性
D.在一定条件下,能与氢气反应生成1-丙醇
C
