鲁科版高中化学必修二 2.1化学键与物质构成 课件(34张ppt)
文档属性
| 名称 | 鲁科版高中化学必修二 2.1化学键与物质构成 课件(34张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-05-19 21:57:05 | ||
图片预览









文档简介
(共34张PPT)
第二章 第一节
化学键与物质构成(2)
高一年级 化学
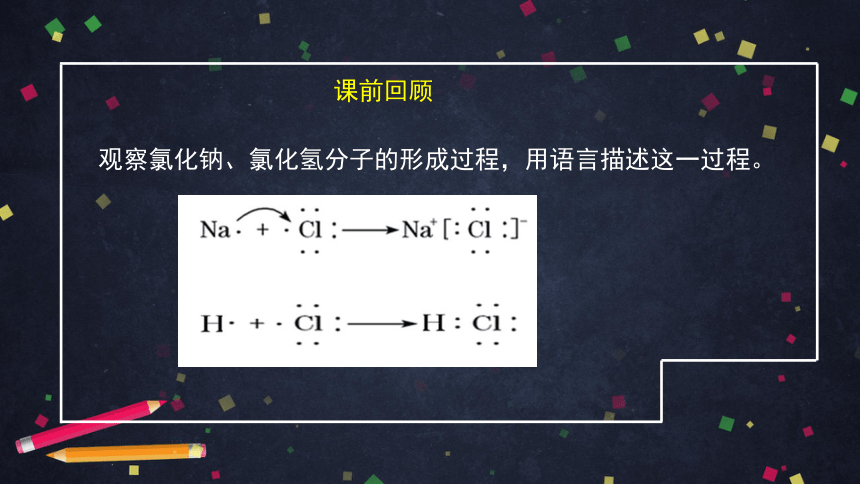
课前回顾
观察氯化钠、氯化氢分子的形成过程,用语言描述这一过程。
离子键
阳离子 阴离子
易失电子 易得电子
静电作用
活泼金属元素原子 活泼非金属元素原子
共价键
原子 原子
易得电子 易得电子
共用电子
非金属元素原子 非金属元素原子
请分析下列化合物的构成情况。
化合物 化学式 形成化学键的微粒 化学键类型
水
氨气
氯化钾
氯化钙
氢氧化钠
迁移·应用
化合物 化学式 形成化学键的微粒 化学键类型
水
学生1:水中有氢离子、氢氧根离子,所以离子形成离子键。
学生2:水由水分子构成,水分子又由氢原子和氧原子构
成,所以水分子中氢原子和氧原子形成共价键。
H、O
共价键
H2O
√
×
你能书写水分子的电子式吗?
化合物 化学式 形成化学键的微粒 化学键类型
水 H2O H、O 共价键
化合物 化学式 形成化学键的微粒 化学键类型
氨气
N、H
共价键
NH3
你能书写氨气分子的电子式吗?
化合物 化学式 形成化学键的微粒 化学键类型
氯化钾
你能书写氯化钾的电子式吗?
K+、Cl-
离子键
KCl
化合物 化学式 形成化学键的微粒 化学键类型
氯化钾 KCl K+、Cl- 离子键
氯化钙
Ca2+、Cl-
离子键
CaCl2
你能书写CaCl2的电子式吗?
化合物 化学式 形成化学键的微粒 化学键类型
氢氧化钠
Na+、OH-
离子键、共价键
NaOH
学生1:氢氧化钠中有活泼金属元素原子,钠原子易失电子,所
以也应该是离子键。
学生2:钠原子失去的电子去哪了?
学生3:那氢原子的作用是什么?
化合物 化学式 形成化学键的微粒 化学键类型
氢氧化钠 NaOH Na+、OH- 离子键 共价键
你能书写NaOH的电子式吗?
√
×
学生1:
学生2:
化合物 化学式 形成化学键的微粒 化学键类型
水 H2O H、O 共价键
氨气 NH3 N、H 共价键
氯化钾 KCl K+、Cl- 离子键
氯化钙 CaCl2 Ca2+、Cl- 离子键
氢氧化钠 NaOH Na+、OH- 离子键 共价键
判断化学键的一般思路:原子结构→原子得失电子趋势→成键微
粒→化学键类型
思考:你能对这些化合物进行分类吗?
物质类别
元素组成
化学键
化合物 化学式 形成化学键的微粒 化学键类型
水 H2O H、O 共价键
氨气 NH3 N、H 共价键
氯化钾 KCl K+、Cl- 离子键
氯化钙 CaCl2 Ca2+、Cl- 离子键
氢氧化钠 NaOH Na+、OH- 离子键 共价键
化合物 化学式 形成化学键的微粒 化学键类型 化合物类别
水 H2O H、O 共价键
氨气 NH3 N、H 共价键
氯化钾 KCl K+、Cl- 离子键
氯化钙 CaCl2 Ca2+、Cl- 离子键
氢氧化钠 NaOH Na+、OH- 离子键 共价键
共价化合物
共价化合物
离子化合物
离子化合物
离子化合物
离子化合物:由阳离子和阴离子构成的化合物。
共价化合物:由原子通过共价键构成的化合物。
化合物类型与化学键类型的关系
1.离子化合物中一定存在离子键。
2.离子化合物中一定不存在共价键。
3.共价化合物中一定存在共价键。
4.共价化合物中一定不存在离子键。
概念辨析
√
√
√
×
思考:你还能举出其他的离子化合物和共价化合物吗?
学生1:离子化合物还有MgCl2、KOH等
学生3:共价化合物还有盐酸、CO2、H2、NH3、Cl2、CH4等
学生2:离子化合物还有CaO、Na2O、Na2O2等
思考:你还能举出其他的离子化合物和共价化合物吗?
学生4:共价化合物好像都是由非金属元素组成的,NH4Cl是
共价化合物吗?
学生5:共价化合物都是由非金属元素组成的,但是由非金属
元素组成的化合物不一定是共价化合物。我可以这样
认为吗?
有下列一组物质:
HCl CO2 H2O H2 NaOH
Cl2 NaF CH4 CaO MgCl2
思考:这些物质中分别存在哪些类型的化学键?
哪些物质属于离子化合物?
哪些物质属于共价化合物?
巩固提升
化学式 化学键类型 化合物类别
HCl
CO2
H2O
H2
NaOH
Cl2
NaF
CH4
MgCl2
共价键
离子键 共价键
共价键
共价键
共价键
离子键
离子键
共价键
共价键
离子化合物
共价化合物
共价化合物
共价化合物
共价化合物
离子化合物
离子化合物
现有下列一组物质:
HCl CO2 H2O H2 NaOH
Cl2 NaF CH4 CaO MgCl2
这些物质是否还有其他的分类方法?分类的标准是什么?
离子化合物:强碱、大部分盐、活泼金属氧化物
共价化合物:非金属氧化物、非金属氢化物、含氧酸、大部分有机化合物
在溶液中,氯化钠、氯化氢分子都可以在水分子的作用下电离出离子而导电。熔融状态的氯化钠可以导电,液态氯化氢不可以导电。
拓展视野
离子化合物在熔融状态下导电
共价化合物在熔融状态下不导电
拓展视野
问题:在含有共价键的物质中,根据共用电子对的偏移情况,你还
可以怎样分类?
非极性共价键(非极性键):
极性共价键(极性键):
H2O CO2 CH4
H2 Cl2
分子结构相似的HF、HCl、HBr、HI中共价键强度从HF到HI
逐渐减弱,因此这4种氢化物的热稳定性从HF到HI也逐渐减弱。
拓展视野
思考:你能总结化合物的构成与分类的关系吗?
应用实践
下列物质中含有共价键的离子化合物是 ( )
① MgF2 ② Na2O2 ③ NaOH ④ NH4Cl
⑤ CO2 ⑥ H2O2 ⑦ N2 ⑧ H2SO4
A.②④⑤⑦⑧ B.②③④
C.①②③④⑧ D.①③⑤⑥
B
应用实践
下列说法中正确的是 ( )
A.含有共价键的化合物一定是共价化合物
B.分子中只有共价键的化合物一定是共价化合物
C.由共价键构成的物质一定是共价化合物
D.一种金属元素和一种非金属元素形成的ABn型化合物,
一定是离子化合物
B
应用实践
下列用电子式表示化合物的形成过程,正确的是( )
B
应用实践
同主族元素形成的同一类型化合物,其结构和性质往往相似。
PH4I是一种白色晶体,下列对PH4I的叙述正确的是( )
A.是一种共价化合物
B.既含离子键又含共价键
C.不可能与NaOH溶液反应
D.受热时不会分解
B
应用实践
Q、W、X、Y、Z为5种短周期元素,且原子序数依次增大。W、
X与Y同周期,Y与Z同主族。Q与W可以按照原子个数比4∶1形成
化合物甲,且甲分子中含有10个电子。Q与X形成化合物乙,乙
可与Z的最高价氧化物对应的水化物按照物质的量之比2∶1反
应形成盐丙。
Q、W、X、Y、Z分别为什么元素?
甲 CH4
乙 NH3
丙 (NH4)2SO4
应用实践
Q、W、X、Y、Z为5种短周期元素,且原子序数依次增大。W、
X与Y同周期,Y与Z同主族。Q与W可以按照原子个数比4∶1形成
化合物甲,且甲分子中含有10个电子。Q与X形成化合物乙,乙
可与Z的最高价氧化物对应的水化物按照物质的量之比2∶1反
应形成盐丙。
Q、W、X、Y、Z分别为什么元素?
Q:H W:C
X:N Y: O
Z: S
应用实践
Q、W、X、Y、Z为5种短周期元素,且原子序数依次增大。W、
X与Y同周期,Y与Z同主族。Q与W可以按照原子个数比4∶1形成
化合物甲,且甲分子中含有10个电子。Q与X形成化合物乙,乙
可与Z的最高价氧化物对应的水化物按照物质的量之比2∶1反
应形成盐丙。
甲的电子式为 。
应用实践
Q、W、X、Y、Z为5种短周期元素,且原子序数依次增大。W、
X与Y同周期,Y与Z同主族。Q与W可以按照原子个数比4∶1形成
化合物甲,且甲分子中含有10个电子。Q与X形成化合物乙,乙
可与Z的最高价氧化物对应的水化物按照物质的量之比2∶1反
应形成盐丙。
Q和Y形成的原子个数之比为1∶1的化合物是共价化合物
还是离子化合物?
共价化合物
H2O2
应用实践
Q、W、X、Y、Z为5种短周期元素,且原子序数依次增大。W、
X与Y同周期,Y与Z同主族。Q与W可以按照原子个数比4∶1形成
化合物甲,且甲分子中含有10个电子。Q与X形成化合物乙,乙
可与Z的最高价氧化物对应的水化物按照物质的量之比2∶1反
应形成盐丙。
盐丙中含有的化学键类型有 。
离子键、共价键
丙 (NH4)2SO4
第二章 第一节
化学键与物质构成(2)
高一年级 化学
课前回顾
观察氯化钠、氯化氢分子的形成过程,用语言描述这一过程。
离子键
阳离子 阴离子
易失电子 易得电子
静电作用
活泼金属元素原子 活泼非金属元素原子
共价键
原子 原子
易得电子 易得电子
共用电子
非金属元素原子 非金属元素原子
请分析下列化合物的构成情况。
化合物 化学式 形成化学键的微粒 化学键类型
水
氨气
氯化钾
氯化钙
氢氧化钠
迁移·应用
化合物 化学式 形成化学键的微粒 化学键类型
水
学生1:水中有氢离子、氢氧根离子,所以离子形成离子键。
学生2:水由水分子构成,水分子又由氢原子和氧原子构
成,所以水分子中氢原子和氧原子形成共价键。
H、O
共价键
H2O
√
×
你能书写水分子的电子式吗?
化合物 化学式 形成化学键的微粒 化学键类型
水 H2O H、O 共价键
化合物 化学式 形成化学键的微粒 化学键类型
氨气
N、H
共价键
NH3
你能书写氨气分子的电子式吗?
化合物 化学式 形成化学键的微粒 化学键类型
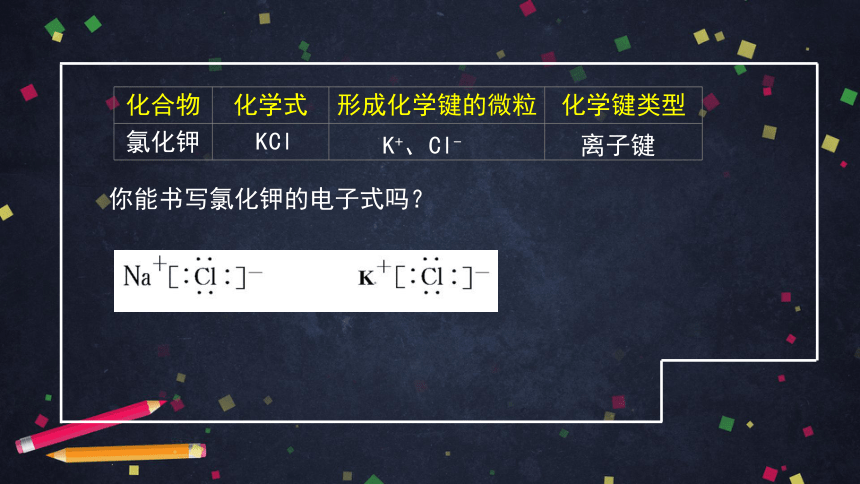
氯化钾
你能书写氯化钾的电子式吗?
K+、Cl-
离子键
KCl
化合物 化学式 形成化学键的微粒 化学键类型
氯化钾 KCl K+、Cl- 离子键
氯化钙
Ca2+、Cl-
离子键
CaCl2
你能书写CaCl2的电子式吗?
化合物 化学式 形成化学键的微粒 化学键类型
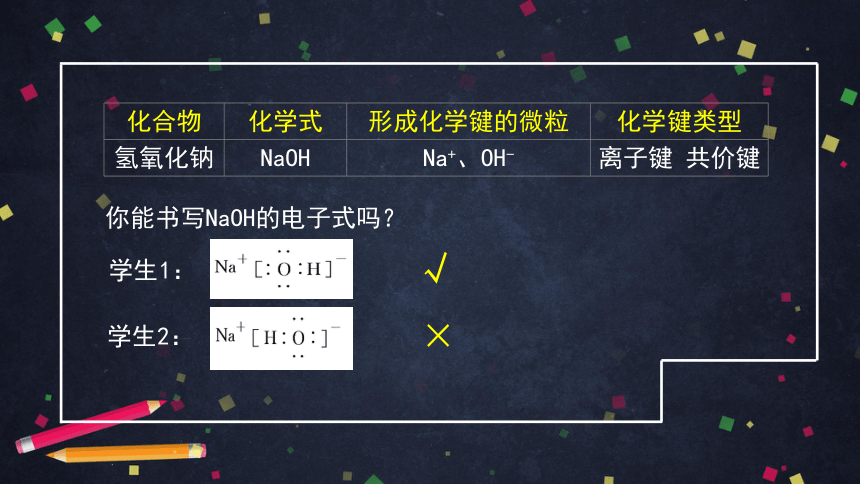
氢氧化钠
Na+、OH-
离子键、共价键
NaOH
学生1:氢氧化钠中有活泼金属元素原子,钠原子易失电子,所
以也应该是离子键。
学生2:钠原子失去的电子去哪了?
学生3:那氢原子的作用是什么?
化合物 化学式 形成化学键的微粒 化学键类型
氢氧化钠 NaOH Na+、OH- 离子键 共价键
你能书写NaOH的电子式吗?
√
×
学生1:
学生2:
化合物 化学式 形成化学键的微粒 化学键类型
水 H2O H、O 共价键
氨气 NH3 N、H 共价键
氯化钾 KCl K+、Cl- 离子键
氯化钙 CaCl2 Ca2+、Cl- 离子键
氢氧化钠 NaOH Na+、OH- 离子键 共价键
判断化学键的一般思路:原子结构→原子得失电子趋势→成键微
粒→化学键类型
思考:你能对这些化合物进行分类吗?
物质类别
元素组成
化学键
化合物 化学式 形成化学键的微粒 化学键类型
水 H2O H、O 共价键
氨气 NH3 N、H 共价键
氯化钾 KCl K+、Cl- 离子键
氯化钙 CaCl2 Ca2+、Cl- 离子键
氢氧化钠 NaOH Na+、OH- 离子键 共价键
化合物 化学式 形成化学键的微粒 化学键类型 化合物类别
水 H2O H、O 共价键
氨气 NH3 N、H 共价键
氯化钾 KCl K+、Cl- 离子键
氯化钙 CaCl2 Ca2+、Cl- 离子键
氢氧化钠 NaOH Na+、OH- 离子键 共价键
共价化合物
共价化合物
离子化合物
离子化合物
离子化合物
离子化合物:由阳离子和阴离子构成的化合物。
共价化合物:由原子通过共价键构成的化合物。
化合物类型与化学键类型的关系
1.离子化合物中一定存在离子键。
2.离子化合物中一定不存在共价键。
3.共价化合物中一定存在共价键。
4.共价化合物中一定不存在离子键。
概念辨析
√
√
√
×
思考:你还能举出其他的离子化合物和共价化合物吗?
学生1:离子化合物还有MgCl2、KOH等
学生3:共价化合物还有盐酸、CO2、H2、NH3、Cl2、CH4等
学生2:离子化合物还有CaO、Na2O、Na2O2等
思考:你还能举出其他的离子化合物和共价化合物吗?
学生4:共价化合物好像都是由非金属元素组成的,NH4Cl是
共价化合物吗?
学生5:共价化合物都是由非金属元素组成的,但是由非金属
元素组成的化合物不一定是共价化合物。我可以这样
认为吗?
有下列一组物质:
HCl CO2 H2O H2 NaOH
Cl2 NaF CH4 CaO MgCl2
思考:这些物质中分别存在哪些类型的化学键?
哪些物质属于离子化合物?
哪些物质属于共价化合物?
巩固提升
化学式 化学键类型 化合物类别
HCl
CO2
H2O
H2
NaOH
Cl2
NaF
CH4
MgCl2
共价键
离子键 共价键
共价键
共价键
共价键
离子键
离子键
共价键
共价键
离子化合物
共价化合物
共价化合物
共价化合物
共价化合物
离子化合物
离子化合物
现有下列一组物质:
HCl CO2 H2O H2 NaOH
Cl2 NaF CH4 CaO MgCl2
这些物质是否还有其他的分类方法?分类的标准是什么?
离子化合物:强碱、大部分盐、活泼金属氧化物
共价化合物:非金属氧化物、非金属氢化物、含氧酸、大部分有机化合物
在溶液中,氯化钠、氯化氢分子都可以在水分子的作用下电离出离子而导电。熔融状态的氯化钠可以导电,液态氯化氢不可以导电。
拓展视野
离子化合物在熔融状态下导电
共价化合物在熔融状态下不导电
拓展视野
问题:在含有共价键的物质中,根据共用电子对的偏移情况,你还
可以怎样分类?
非极性共价键(非极性键):
极性共价键(极性键):
H2O CO2 CH4
H2 Cl2
分子结构相似的HF、HCl、HBr、HI中共价键强度从HF到HI
逐渐减弱,因此这4种氢化物的热稳定性从HF到HI也逐渐减弱。
拓展视野
思考:你能总结化合物的构成与分类的关系吗?
应用实践
下列物质中含有共价键的离子化合物是 ( )
① MgF2 ② Na2O2 ③ NaOH ④ NH4Cl
⑤ CO2 ⑥ H2O2 ⑦ N2 ⑧ H2SO4
A.②④⑤⑦⑧ B.②③④
C.①②③④⑧ D.①③⑤⑥
B
应用实践
下列说法中正确的是 ( )
A.含有共价键的化合物一定是共价化合物
B.分子中只有共价键的化合物一定是共价化合物
C.由共价键构成的物质一定是共价化合物
D.一种金属元素和一种非金属元素形成的ABn型化合物,
一定是离子化合物
B
应用实践
下列用电子式表示化合物的形成过程,正确的是( )
B
应用实践
同主族元素形成的同一类型化合物,其结构和性质往往相似。
PH4I是一种白色晶体,下列对PH4I的叙述正确的是( )
A.是一种共价化合物
B.既含离子键又含共价键
C.不可能与NaOH溶液反应
D.受热时不会分解
B
应用实践
Q、W、X、Y、Z为5种短周期元素,且原子序数依次增大。W、
X与Y同周期,Y与Z同主族。Q与W可以按照原子个数比4∶1形成
化合物甲,且甲分子中含有10个电子。Q与X形成化合物乙,乙
可与Z的最高价氧化物对应的水化物按照物质的量之比2∶1反
应形成盐丙。
Q、W、X、Y、Z分别为什么元素?
甲 CH4
乙 NH3
丙 (NH4)2SO4
应用实践
Q、W、X、Y、Z为5种短周期元素,且原子序数依次增大。W、
X与Y同周期,Y与Z同主族。Q与W可以按照原子个数比4∶1形成
化合物甲,且甲分子中含有10个电子。Q与X形成化合物乙,乙
可与Z的最高价氧化物对应的水化物按照物质的量之比2∶1反
应形成盐丙。
Q、W、X、Y、Z分别为什么元素?
Q:H W:C
X:N Y: O
Z: S
应用实践
Q、W、X、Y、Z为5种短周期元素,且原子序数依次增大。W、
X与Y同周期,Y与Z同主族。Q与W可以按照原子个数比4∶1形成
化合物甲,且甲分子中含有10个电子。Q与X形成化合物乙,乙
可与Z的最高价氧化物对应的水化物按照物质的量之比2∶1反
应形成盐丙。
甲的电子式为 。
应用实践
Q、W、X、Y、Z为5种短周期元素,且原子序数依次增大。W、
X与Y同周期,Y与Z同主族。Q与W可以按照原子个数比4∶1形成
化合物甲,且甲分子中含有10个电子。Q与X形成化合物乙,乙
可与Z的最高价氧化物对应的水化物按照物质的量之比2∶1反
应形成盐丙。
Q和Y形成的原子个数之比为1∶1的化合物是共价化合物
还是离子化合物?
共价化合物
H2O2
应用实践
Q、W、X、Y、Z为5种短周期元素,且原子序数依次增大。W、
X与Y同周期,Y与Z同主族。Q与W可以按照原子个数比4∶1形成
化合物甲,且甲分子中含有10个电子。Q与X形成化合物乙,乙
可与Z的最高价氧化物对应的水化物按照物质的量之比2∶1反
应形成盐丙。
盐丙中含有的化学键类型有 。
离子键、共价键
丙 (NH4)2SO4
