人教版化学九年级下册 第十二单元课题2《 化学元素与人体健康》同步测试
文档属性
| 名称 | 人教版化学九年级下册 第十二单元课题2《 化学元素与人体健康》同步测试 |  | |
| 格式 | zip | ||
| 文件大小 | 146.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-05-19 18:48:56 | ||
图片预览


文档简介
【中考题原创】
钾元素与人体健康
湖北省石首市文峰中学 刘 涛
【背景资料】钾是人体必需的的常量元素,钾是细胞内最主要的阳离子之一。正常人体内约含钾175克,其中98%的钾以钾离子的形式贮存于细胞内液中,对于维持人体内的水分和维持体液恒定的pH起重要的作用,这是人体维持正常生命活动的必要条件。
【知识链接】钾可以调节细胞内适宜的渗透压和体液的酸碱平衡,参与细胞内糖和蛋白质的代谢。有助于维持神经健康、心跳规律正常,可以预防中风,并协助肌肉正常收缩。在摄入高钠而导致高血压时,钾具有降血压作用。
【中考题原创】
1.某品牌饮用水标签标明水中钾、钠、钙等的含量,这里的钾、钠、钙是指( )
A.原子 B.分子 C.元素 D.单质
2.分析钾原子、钾离子的结构示意图,下列说法正确的是( )
A.两者质子数不同 B.两者电子层数相同
C.两者元素种类相同 D.两者最外层电子数相同
3.如图是钾元素在元素周期表中的部分信息及钾原子的原子结构示意图,根据图示判断下列表述正确的是( )
A.x=2 B.钾元素属于非金属元素
C.钾原子的质量为39.10g D.它形成的离子是K+
4.如图A是钾元素在元素周期表中的部分信息,图B是钾原子的结构示意图,下列判断不正确的是( )
A.钾的相对原子质量是39.10
B.钾原子在化学反应中容易失去电子
C.钾元素在元素周期表中排在第四周期
D.钾元素和钾离子的电子层数相同
5.下面有关“化学与健康”的说法中正确的是( )
A.人体维生素都需要从外界摄入
B.人体胃液的pH约为0.9~1.5
C.钙、磷、钾、铁都是人体中的微量元素
D.霉变花生油炸后可以食用
6.《中国居民膳食指南》建议成人平均每天食盐摄入量应在6g以下。
⑴硫酸镁可以改变钠盐的“口味”,硫酸镁的化学式为______。
⑵氯化钾是临床常用的电解质平衡调节药,氯化钾结构与氯化钠相似,则构成氯化钾的微粒是 (填“分子”“原子”或离子“”)。
⑶某品牌低钠盐含氯化钠70%,氯化钾30%。若某人每天摄入食盐6g,现以该低钠盐代替食盐,则每天可减少______g钠元素的摄入?(结果精确到0.1)
7.氯化钾(KCl)是一种常用试剂,其水溶液呈中性。某KCl 样品中含有杂质CaCl2 和MgCl2,设计提纯的流程图如下:
请认真分析流程中各步骤的信息作答:
⑴溶剂X 是水;则Y 溶液中溶质的化学式为 ,加入Y 溶液后发生的化学反应方程式为 。
⑵加入过量KOH 溶液的目的是 ;KOH 溶液还可以用 代替(填序号)
A.NaOH 溶液 B.Ca(OH)2 溶液? C.Ba(OH)2 溶液
⑶本实验中蒸发是为了除去溶液中的 (填化学式)。
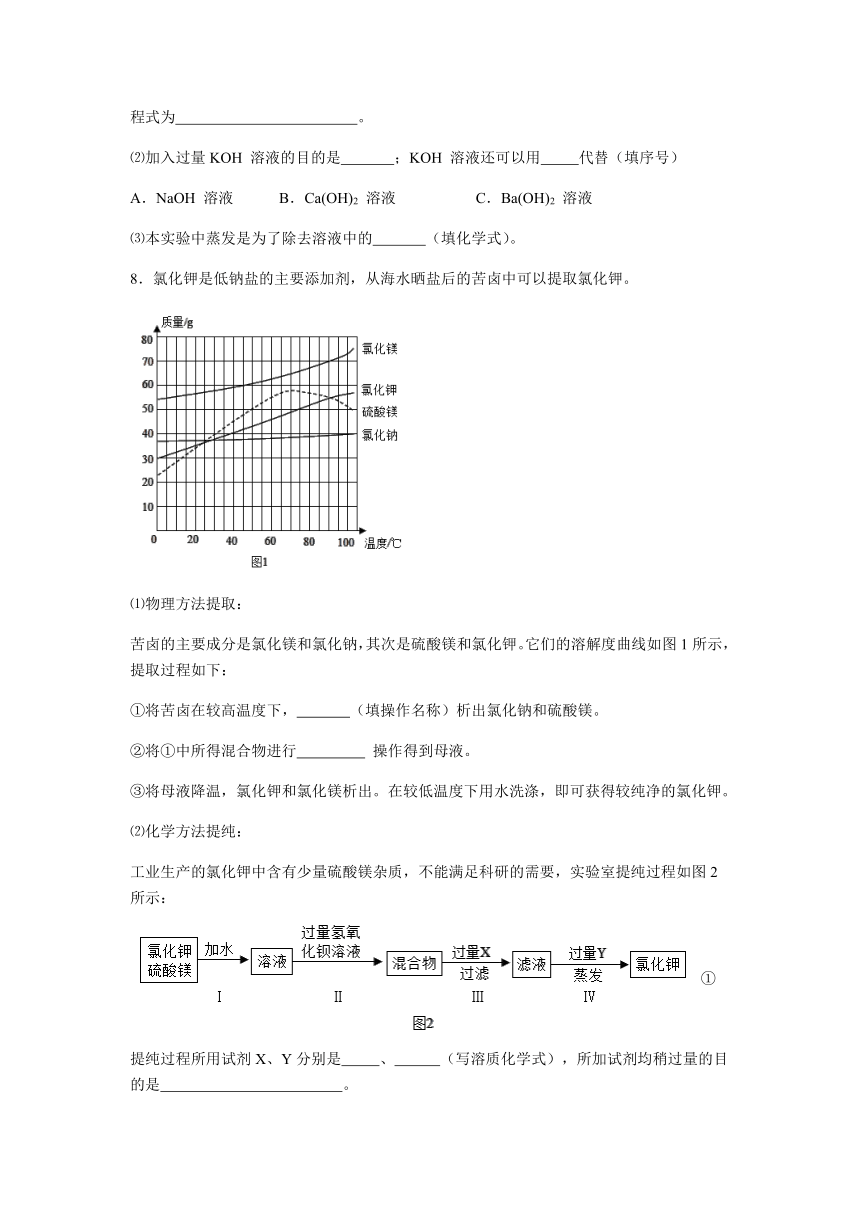
8.氯化钾是低钠盐的主要添加剂,从海水晒盐后的苦卤中可以提取氯化钾。
⑴物理方法提取:
苦卤的主要成分是氯化镁和氯化钠,其次是硫酸镁和氯化钾。它们的溶解度曲线如图1所示,提取过程如下:
①将苦卤在较高温度下, (填操作名称)析出氯化钠和硫酸镁。
②将①中所得混合物进行 操作得到母液。
③将母液降温,氯化钾和氯化镁析出。在较低温度下用水洗涤,即可获得较纯净的氯化钾。
⑵化学方法提纯:
工业生产的氯化钾中含有少量硫酸镁杂质,不能满足科研的需要,实验室提纯过程如图2所示: ①提纯过程所用试剂X、Y分别是 、 (写溶质化学式),所加试剂均稍过量的目的是 。
②写出提纯过程中发生反应的化学方程式 。
③步骤Ⅲ中实际参加反应的离子有 (写符号)。
9.“低钠盐”可以控制钠的摄入量从而防治高血压等疾病。制备“低钠盐”在食盐中用NaCl中按照配方比例添加食用KCl。国内某些生产厂家为改变“低钠盐”口味还会加入少量镁盐(仅限MgSO4或MgCl2)。
⑴测得某“低钠盐”样品a中含有NaCl和KCl的质量分数均为50%。该样品a的水溶液中,含量最多的离子是______(填离子符号)。
⑵探究某“低钠盐”样品b中是否添加镁盐,以及添加的是何种镁盐(MgSO4或MgCl2中的一种).请设计实验方案,完成下列表格.
限选试剂:BaCl2溶液、NaOH溶液、AgNO3溶液、蒸馏水。
实验操作 预测现象及结论
步骤1:取少量样品a于烧杯中, ① , 样品溶解,形成无色溶液
步骤2:取步骤1形成的溶液于烧杯中,在滴加少量NaOH溶液,振荡 ② ,说明样品b中添加了镁盐
步骤2: ③ , ④
10.若钠摄入过量或钾摄入不足,都是导致高血压的风险因素。日常生活中选择食用低钠盐能实现减钠补钾。如图为某品牌低钠盐的标签,请你根据标签回答以下问题:
⑴氯化钾的相对分子质量为 。
⑵人体每天摄入钠元素的质量不宜超过2.3g。如果人体所需的钠元素全部来自该品牌食盐,那么一个人每天摄入该品牌低钠盐的质量不宜超过多少g?(结果保留一位小数)
11.低钠盐适合患有高血压、肾病、心脏病的患者服用,苹果酸钠盐(C4H5O5Na)是低钠盐的一种。请回答:
⑴果酸钠盐中各元素的质量比为C:H:O:Na= 。
⑵若某病人每天食用5.85g苹果酸钠盐,比食用相同质量的食盐(NaCl)少摄入钠元素多少克?(计算结果保留一位小数)。
12.氯化钾为无色细长菱形或成一立方晶体,或白色结晶小颗粒粉末,外观如同食盐,无臭、味咸。常用于低钠盐、矿物质水的添加剂。氯化钾是临床常用的电解质平衡调节药,临床疗效确切,广泛运用于临床各科。
⑴氯化钾中氯元素和钾元素的质量比为 。
⑵氯化钾中钾元素的质量分数为 (计算结果精确至0.1%)。
⑶已知氯化钾在40℃时的溶解度为40g,则该温度时氯化钾饱和溶液的溶质质量分数是 。
13.低钠盐是一种健康食盐,以普通钠盐为基础添加一定量氯化钠(氯化钠70%左右,氯化钾30%左右),有助于人体钠、钾平衡,降低高血压、心血管疾病的患病风险.另外,由于食盐中导致咸味的是氯离子,因此,低钠盐能较好实现减钠补钾不减咸味的目的。
课外探究小组为调查市场售低钠盐是否合格,选用一种常见低钠盐进行实验分析:
步骤一:用电子天平准确称取低钠盐样品2.00g,放入洁净小烧杯中加水,搅拌至样品充分溶解;
步骤二:向上述小烧杯中逐滴加入足量的硝酸银溶液,边滴边搅拌至不再生成沉淀为止;
步骤三:将沉淀经过滤、干燥后,称得沉淀质量为4.51g。
⑴某同学参照样品配比,计算出2.00g低钠盐样品中氯化钠(氯化钠70%)与硝酸银反应所得沉淀的质量为3.43g,请你计算出样品中氯化钾与硝酸银反应所得沉淀的质量;(简单写出计算过程,计算结果精确到0.01)
⑵经计算,你认为样品是否合格?______;
⑶该探究小组在教师指导下,取同质量样品再次精确实验,最终得到沉淀的质量为4.5g,比较两次实验所得沉淀的质量。请分析造成误差的主要原因 。
参考答案
1~2.C、C、D、D、B。
6.⑴MgSO4;⑵离子;⑶0.7
7.⑴K2CO3;K2CO3+CaCl2=CaCO3↓+2KCl;⑵完全除去Mg2+;B、C ;⑶HCl、H2O。
8.⑴物①蒸发结晶;②过滤;⑵化学方法提纯 ①K2CO3;HCl;把要除去的杂质全部除去;②MgSO4+Ba(OH)2=BaSO4↓+Mg(OH)2↓; ③Ba2+和CO32﹣。
9.⑴Cl﹣;⑵①并用玻璃棒搅拌;②有白色沉淀生成;③取少量步骤1形成的溶液,再滴加少量的BaCl2溶液振荡;④有白色沉淀生成,则添加的是MgSO4,否则是MgCl2
10.⑴74.5;⑵8.4g。
11.⑴48:5:80:23;⑵1.4g。
12.⑴71:78;⑵52.3%;⑶28.6%
13.⑴1.16g; ⑵不合格;⑶第一次进行过滤时,滤纸上的沉淀没有全部被称量。
同课章节目录
