人教版(2019)高中化学必修第一册:第三章综合测试 (含答案)
文档属性
| 名称 | 人教版(2019)高中化学必修第一册:第三章综合测试 (含答案) |  | |
| 格式 | zip | ||
| 文件大小 | 607.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-05-19 22:31:41 | ||
图片预览



文档简介
第三章综合测试
一、选择题(本题包括16小题,每题3分,共48分,每题只有一个选项符合题意)
1.青铜是我国使用最早的合金。下列关于青铜性质的说法,不正确的是( )
A.熔点比纯铜低 B.能够导电 C.能够导热 D.硬度比纯铜小
2.下列有关金属及其合金的说法不正确的是( )
A.目前我国流通的硬币是由合金材料制造的
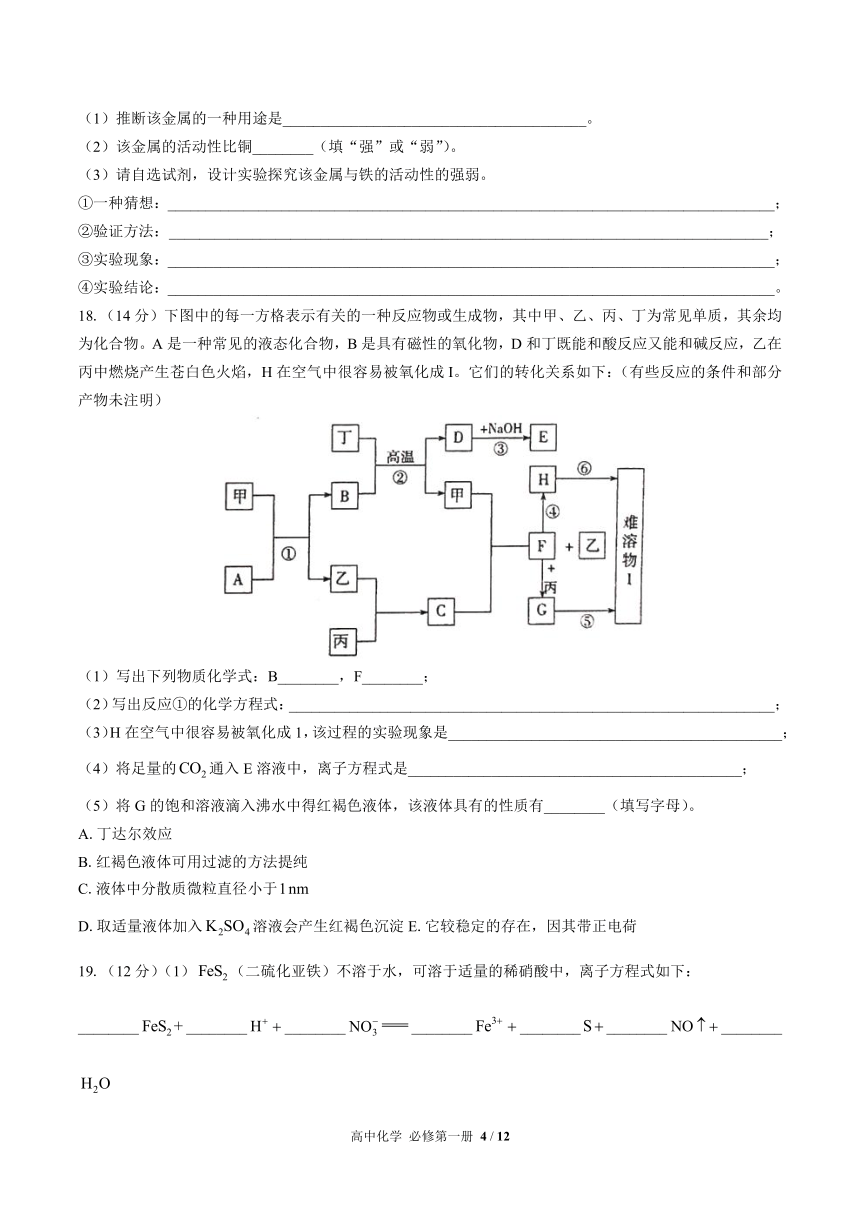
B.生铁、普通钢和不锈钢中的碳含量依次增加
C.镁在空气中燃烧发出耀眼的白光,可用于制作照明弹
D.日用铝制品表面的氧化膜对内部金属起保护作用
3.下列关于金属材料的说法,正确的是( )
A.导电性最好的金属是铜 B.钢的性能比生铁的好,所以钢是很纯的铁
C.合金的抗腐蚀性能不如成分金属好 D.焊锡(锡铅合金)的熔点比锡、铅的熔点都低
4.化学行业把材料分为金属材料、无机非金属材料、有机高分子材料等。金属材料在现实生活中有极为重要的作用。下列金属材料的用途与金属所具有的性质不相符的是( )
A.制造白炽灯灯丝——熔点高 B.制造飞机——硬度大而密度小
C.制造保险丝——硬度大 D.制造盛装化工原料的容器——耐腐蚀
5.下列对于金属的叙述不正确的是( )
A.在点燃镁、铝之前,应先用砂纸打磨,除去表面的氧化膜
B.用砂纸打磨的铝条,放在酒精灯上加热至熔化,铝会滴落下来
C.铁在氧气中燃烧生成的氧化物的主要成分是四氧化三铁
D.金属单质在自然界中多以化合态的形式存在,因为它们大多有较强的还原性
6.化学在生产和日常生活中有着重要的应用,下表中用途与解释不正确的是( )
选项 用途 解释
A 常用于潜水艇或呼吸面具的供氧剂 与反应产生
B 常用铁盐作净水剂 生成吸附能力强的胶体
C 溶液可用于刻制印刷铜电路板 发生反应
D 在医疗上烧碱可用于治疗胃酸过多 烧碱可与胃酸反应
7.下列各试剂中,不能用来鉴别溶液和溶液的是( )
A.溶液 B.酸性溶液
C.溶液 D.溶液
8.某学习小组进行了下图所示的实验,实验后组员之间的交流不合理的是( )
A.甲同学认为试管b中收集到的气体可点燃,且产生淡蓝色火焰
B.乙同学认为试管a中生成的黑色固体可能为四氧化三铁
C.丙同学认为将少量还原铁粉放入试管中,加适量的水,加热也可实现该反应
D.丁同学认为用盐酸溶解固体生成物所得溶液有颜色
9.下列推理正确的是( )
A.铝粉在氧气中燃烧生成,故钠在氧气中燃烧生成
B.铁能从硫酸铜溶液中置换出铜,故钠也能从硫酸铜溶液中置换出铜
C.活泼金属钠保存在煤油中,故活泼金属铝也保存在煤油中
D.钠与氧气、水等反应时钠均作还原剂,故金属单质参与反应时金属单质均作还原剂
10.下列实验现象描述错误的是( )
选项 实验 现象
A 加热放在坩锅中的小块钠 钠先熔化成光亮的小球,燃烧时,火焰为黄色,燃烧后,生成淡黄色固体
B 在酒精灯上加热铝箔 铝箔熔化,失去光泽,熔化的铝并不滴落,好像有一层膜兜着
C 在溶液中滴入溶液 先生成白色沉淀,沉淀很快变为灰绿色,最后变为红褐色
D 在空气中久置的铝条放入溶液中 立刻产生大量无色气体,铝条逐渐变细,铝条逐渐发热
11.用铝箱包裹金属钠,用针扎若干个小孔,放入水中,完全反应后,放出的气体体积(标准状况)为( )
A.无法确定 B. C.大于 D.小于
12.镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)的关系如图所示。反应中镁和铝的( )
A.物质的量之比为 B.质量之比为
C.摩尔质量之比为 D.消耗硫酸的物质的量之比为
13.一定质量的铝铁合金溶于足量的溶液中,完全反应后产生(标准状况下)气体;用同样质量的铝铁合金完全溶于足量的盐酸中,在标准状况下产生的气体,则该合金中铝、铁的物质的量之比为( )
A. B. C. D.
14.将固体X投入过量的Y中,能生成白色沉淀并放出一种无色气体,该气体能燃烧,不易溶于水,则X和Y分别可能是( )
A.钠和氯化铝溶液 B.铝和烧碱溶液
C.过氧化钠和氯化亚铁溶液 D.锌和稀硫酸
15.在和的混合液中逐渐加入铁粉,溶液中的物质的量浓度和加入铁粉的物质的量之间的关系如图所示。则该溶液中与的物质的量浓度之比为( )
A. B. C. D.
16.铁粉溶于稀盐酸中,然后加入足量的固体,充分反应后过滤,将滤渣加强热,最终得到的固体质量为( )
A. B. C. D.
二、非选择题(本题包括4小题,共52分)
17.(12分)下表是某种常见金属的部分性质:
颜色和状态 硬度 密度 熔点 导电性 导热性 延展性
银白色固体 较软 良好 良好 良好
将该金属投入稀盐酸中,可产生大量的无色气体。根据上述信息回答下列问题:
(1)推断该金属的一种用途是________________________________________。
(2)该金属的活动性比铜________(填“强”或“弱”)。
(3)请自选试剂,设计实验探究该金属与铁的活动性的强弱。
①一种猜想:________________________________________________________________________________;
②验证方法:_______________________________________________________________________________;
③实验现象:________________________________________________________________________________;
④实验结论:________________________________________________________________________________。
18.(14分)下图中的每一方格表示有关的一种反应物或生成物,其中甲、乙、丙、丁为常见单质,其余均为化合物。A是一种常见的液态化合物,B是具有磁性的氧化物,D和丁既能和酸反应又能和碱反应,乙在丙中燃烧产生苍白色火焰,H在空气中很容易被氧化成I。它们的转化关系如下:(有些反应的条件和部分产物未注明)
(1)写出下列物质化学式:B________,F________;
(2)写出反应①的化学方程式:________________________________________________________________;
(3)H在空气中很容易被氧化成1,该过程的实验现象是____________________________________________;
(4)将足量的通入E溶液中,离子方程式是____________________________________________;
(5)将G的饱和溶液滴入沸水中得红褐色液体,该液体具有的性质有________(填写字母)。
A.丁达尔效应
B.红褐色液体可用过滤的方法提纯
C.液体中分散质微粒直径小于
D.取适量液体加入溶液会产生红褐色沉淀E.它较稳定的存在,因其带正电荷
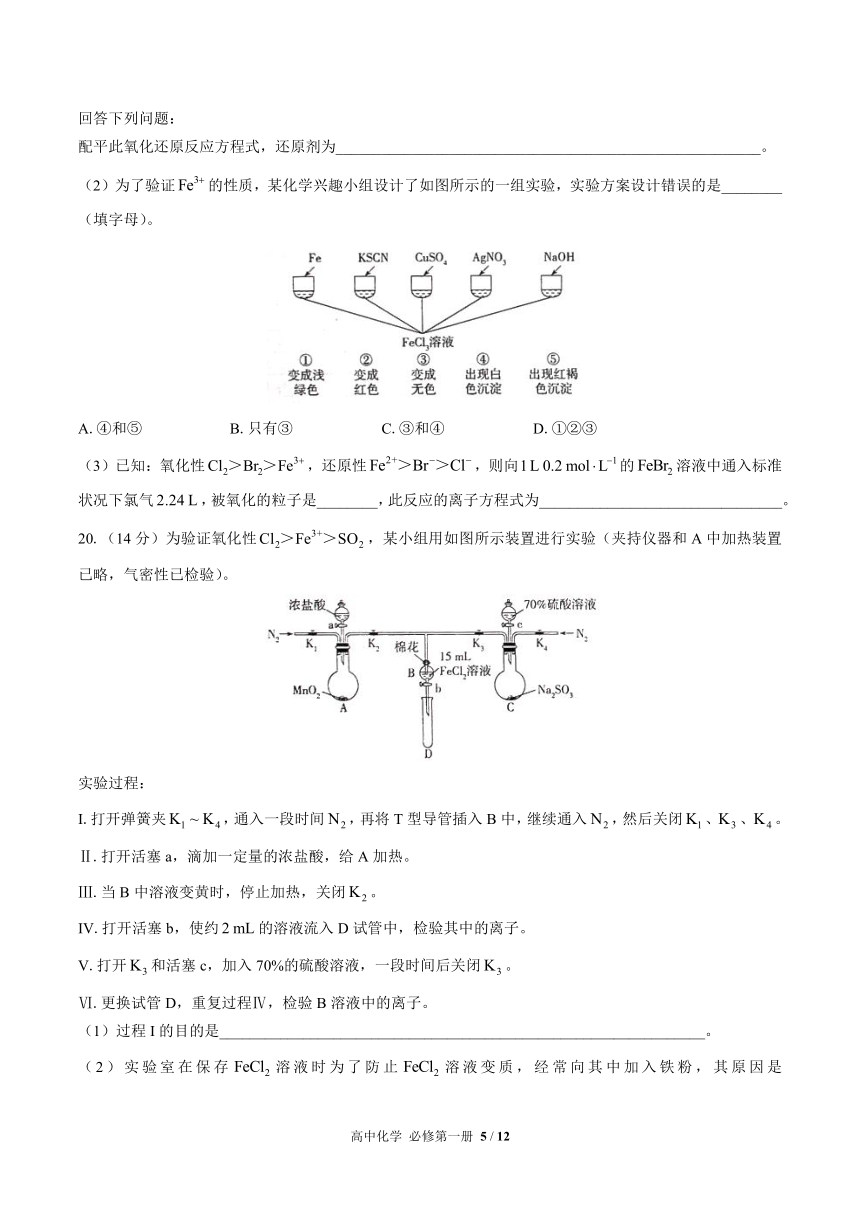
19.(12分)(1)(二硫化亚铁)不溶于水,可溶于适量的稀硝酸中,离子方程式如下:
________________________________________________________
回答下列问题:
配平此氧化还原反应方程式,还原剂为________________________________________________________。
(2)为了验证的性质,某化学兴趣小组设计了如图所示的一组实验,实验方案设计错误的是________(填字母)。
A.④和⑤ B.只有③ C.③和④ D.①②③
(3)已知:氧化性,还原性,则向的溶液中通入标准状况下氯气,被氧化的粒子是________,此反应的离子方程式为________________________________。
20.(14分)为验证氧化性,某小组用如图所示装置进行实验(夹持仪器和A中加热装置已略,气密性已检验)。
实验过程:
I.打开弹簧夹,通入一段时间,再将T型导管插入B中,继续通入,然后关闭、、。
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热。
Ⅲ.当B中溶液变黄时,停止加热,关闭。
IV.打开活塞b,使约的溶液流入D试管中,检验其中的离子。
V.打开和活塞c,加入70%的硫酸溶液,一段时间后关闭。
Ⅵ.更换试管D,重复过程Ⅳ,检验B溶液中的离子。
(1)过程I的目的是________________________________________________________________。
(2)实验室在保存溶液时为了防止溶液变质,经常向其中加入铁粉,其原因是________________________________________________________。
(3)若向过程ⅢB中的黄色溶液中通入气体,会观察到有淡黄色沉淀生成,写出该反应的化学方程式:________________________________________________________________________________________。
(4)若将制取的通入硫酸酸化的高锰酸钾溶液可使溶液褪色,其反应的离子方程式为________________________________________________________。
(5)甲、乙、丙三位同学分别完成了上述实验,结论如下表所示。他们的检测结果一定能够证明氧化性的是________(填“甲”“乙”或“丙”)。
过程Ⅳ,B溶液中含有的离子 过程Ⅵ,B溶液中含有的离子
甲 有无 有
乙 既有又有 有
丙 有无 有
(6)将B中的溶液换成溶液并向其中通入,(标准状况下),若溶液中有1/2的被氧化成单质Br2,则原溶液中的物质的量浓度为________。
第三章综合测试
答案解析
一、选择题
1.【答案】D
【解析】青铜是铜的合金,具有导电性、导热性,其熔点比纯铜低,硬度比纯铜大,A、B、C正确,D错误。
2.【答案】B
【解析】生铁、普通钢和不锈钢中的碳含量依次降低,故B错误。
3.【答案】D
【解析】银的导电性能比铜好,A错误;钢是铁合金,B错误;合金的机械性能比成分金属好,多数合金的抗腐蚀性能比成分金属好,C错误;合金的熔点一般比成分金属低,焊锡的熔点比成分金属锡、铅的熔点都低,D正确。
4.【答案】C
【解析】做灯丝的材料不但要求能导电,而且要求熔点高,若熔点不够高则灯丝寿命不长,A正确;飞机在空中飞行,环境复杂,所以制造飞机的材料要坚硬而质轻,B正确;制造保险丝,关键是熔点低,电流超过正常范围,瞬间温度升高,在较低温度下就能够熔断,保护用电器不被烧毁,而不是需要金属的硬度大,C错误;化工原料一般具有腐蚀性,所以装化工原料的容器一定要耐腐蚀,D正确。
5.【答案】B
【解析】金属镁和铝易与氧气反应生成氧化物,所以在点燃之前,应先用砂纸打磨,除去表面的氧化膜,A对;用砂纸打磨的铝条,放在酒精灯上加热,金属铝的表面会形成氧化膜,氧化铝的熔点很高,所以不会滴落,B错;金属铁在氧气中燃烧生成四氧化三铁,C对;大多数金属单质具有较强的还原性,在自然界以化合态形式存在,D对。
6.【答案】D
【解析】烧碱腐蚀性强,不适合治疗胃酸过多,应选用弱碱性物质。
7.【答案】C
【解析】A项,溶液与溶液反应生成白色沉淀,白色沉淀迅速变为灰绿色,最后变成红褐色,溶液与溶液生成红褐色沉淀,可鉴别;B项,能使酸性溶液褪色的是硫酸亚铁溶液,没有明显现象的是硫酸铁溶液,可鉴别;C项,二者均与氯化钡溶液反应生成硫酸钡白色沉淀,不能鉴别;D项,加入溶液呈红色的是硫酸铁溶液,没有明显现象的是硫酸亚铁溶液,可鉴别。
8.【答案】C
【解析】在高温下铁与水蒸气反应生成氢气和四氧化三铁,故丙同学的观点不正确。
9.【答案】D
【解析】在氧气中燃烧生成,A错误:与水剧烈反应,故不能置换出溶液中的,B错误;铝与反应生成薄膜起保护作用,铝不用保存在煤油中,C错误。
10.【答案】D
【解析】在空气中久置的铝条表面有一层致密的薄膜,放入溶液中,不会立刻产生大量无色气体。
11.【答案】C
【解析】首先发生的反应是,标准状况下与水反应产生的体积为,然后发生的反应是,此反应又能产生部分,故最后放出的的体积大于。
12.【答案】A
【解析】镁和铝分别与等浓度、等体积的稀硫酸反应,化学方程式为、相同条件下产生的体积相等,则物质的量相等,根据化学方程式可得与的物质的量之比为,A对;与的质量之比为,B错;镁、铝的摩尔质量之比为,C错;由于反应生成的氢气一样多,则消耗硫酸的物质的量之比为,D错。
13.【答案】A
【解析】合金溶于足量的溶液中,铝发生反应:,产生氢气(标准状况),其物质的量,由方程式可知,铁合金溶于足量的盐酸中,都反应产生氢气,与足量的氢氧化钠溶液、盐酸反应产生氢气体积相等,则与盐酸反应生成氢气体积,其物质的量,根据可知,故合金中铝、铁的物质的量之比。
14.【答案】A
【解析】A项中Na与水反应生成和,与过量的溶液反应生成白色沉淀;B项中,无沉淀生成;C项中,与过量溶液反应,生成白色沉淀,然后迅速变成灰绿色,最终变为红褐色沉淀;D项中,无沉淀生成。
15.【答案】C
【解析】根据氧化性:,加入铁后会依次发生氧化还原反应:①,②,从题图中可知加入时,发生反应①生成的物质的量为,反应的的物质的量为,即为;再加入铁发生反应②,此时生成物质的量为,原溶液中的物质的量为,即为;同一溶液中浓度之比等于物质的量之比,所以原溶液中的浓度之比为。
16.【答案】B
【解析】铁粉的物质的量是,溶于稀盐酸中生成氯化亚铁,然后加入足量的固体,充分反应后过滤得到氢氧化铁,将滤渣加强热,最终得到的固体是氧化铁,根据铁原子守恒可知氧化铁的质量为。
二、非选择题
17.【答案】(1)用于制电线或实验室制氢气等(合理即可)
(2)强
(3)①该金属的活动性比铁强 ②取两支大小相同的试管,分别注入同体积、同浓度的稀盐酸;向两支试管中同时分别加入大小和表面积相同的铁片和该金属片,比较反应快慢 ③都有气泡放出,被测金属产生气泡更快④被测金属的活动性比铁强
【解析】(1)该金属具有良好的导电性,且能与盐酸反应生成无色气体,因此可以用于制电线,也可以用来制取氢气等。
(2)由于该金属可以和盐酸反应,说明其金属活动性在氢前,比铜活动性强。
(3)为了探究该金属和铁的金属活动性强弱,可以采用和酸溶液反应,也可以和盐溶液反应。
18.【答案】(1)
(2)
(3)白色沉淀迅速变为灰绿色,最终变为红褐色
(4)
(5)AD
【解析】甲、乙、丙、丁为常见单质,其余均为化合物,A是一种常见的液态化合物,则A为,B是具有磁性的氧化物,则B为,D和丁既能和酸反应又能和碱反应,则丁为,D为,E为,结合转化关系可知,甲为,乙为,丙为,C为HCI,F为,H在空气中很容易被氧化成I,则H为,I为,G为。
(1)通过以上分析知,B、F分别是、。
(2)A与甲反应的化学方程式为。
(3)H为,I为,是白色沉淀,是红褐色沉淀,不稳定,极易被空气中的0,氧化成红褐色沉淀,看到的现象是白色沉淀迅速变为灰绿色,最终变为红褐色。
(4)E是偏铝酸钠,足量二氧化碳通入偏铝酸钠溶液中反应生成氢氧化铝沉淀和碳酸氢钠,离子方程式为。
(5)将G的饱和溶液滴入沸水中得红褐色液体,该液体是胶体,具有丁达尔效应,其分散质微粒直径在之间,能透过滤纸但不能透过半透膜,能和电解质溶液发生聚沉现象,故选AD。
19.【答案】(1)1 4 1 1 2 1 2
(2)C
(3)
【解析】(1)中铁元素的化合价为价,硫元素的化合价为价,反应后硫元素化合价为0价,铁元素化合价为价,氮元素化合价由价变化为价,结合原子守恒和得失电子守恒配平化学方程式,还原剂为。
(2)①与溶液反应的离子方程式为,溶液变成浅绿色;②与溶液反应的离子方程式为溶液变成红色;③硫酸铜与溶液不反应;④硝酸银与溶液反应的离子方程式为,产生白色沉淀,但不是的性质;③氢氧化钠与溶液反应的离子方程式为,出现红褐色沉淀。
(3)还原性,向溶液中通入时,先与反应,消耗完后再反应。溶液中的物质的量为,通入的物质的量为,则被氧化的粒子是,反应的离子方程式为。
20.【答案】(1)排出装置中的空气,防止干扰
(2)容易被空气中的氧气氧化,铁粉可以将氧化得到的还原为
(3)
(4)
(5)甲、乙
(6)
【解析】(1)打开通入一段时间,目的是排出装置中的空气,防止其氧化,干扰实验。
(2)被空气中的氧化变为、若加入铁粉、会发生反应:,从而可以起到防止变质的作用。
(3)具有强氧化性,可以与反应,生成S单质、、,反应的化学方程式为。
(4)具有还原性,酸性高锰酸钾溶液具有强氧化性,将通入酸性高锰酸钾溶液中,被氧化成硫酸,被还原变为,根据得失电子守恒、电荷守恒及原子守恒,可得离子方程式为。
(5)乙中过程Ⅳ,说明氯气不足、氯气氧化性大于铁离子,过程Ⅵ有硫酸根离子,说明发生与的反应,则氧化性:,甲中过程Ⅳ有,无则氧化性:,过程Ⅵ有,说明发生与的反应,则氧化性:。(6)设的物质的量浓度为,根据得失电子守恒可知,,解得。
W
高中化学 必修第一册 6 / 6
一、选择题(本题包括16小题,每题3分,共48分,每题只有一个选项符合题意)
1.青铜是我国使用最早的合金。下列关于青铜性质的说法,不正确的是( )
A.熔点比纯铜低 B.能够导电 C.能够导热 D.硬度比纯铜小
2.下列有关金属及其合金的说法不正确的是( )
A.目前我国流通的硬币是由合金材料制造的
B.生铁、普通钢和不锈钢中的碳含量依次增加
C.镁在空气中燃烧发出耀眼的白光,可用于制作照明弹
D.日用铝制品表面的氧化膜对内部金属起保护作用
3.下列关于金属材料的说法,正确的是( )
A.导电性最好的金属是铜 B.钢的性能比生铁的好,所以钢是很纯的铁
C.合金的抗腐蚀性能不如成分金属好 D.焊锡(锡铅合金)的熔点比锡、铅的熔点都低
4.化学行业把材料分为金属材料、无机非金属材料、有机高分子材料等。金属材料在现实生活中有极为重要的作用。下列金属材料的用途与金属所具有的性质不相符的是( )
A.制造白炽灯灯丝——熔点高 B.制造飞机——硬度大而密度小
C.制造保险丝——硬度大 D.制造盛装化工原料的容器——耐腐蚀
5.下列对于金属的叙述不正确的是( )
A.在点燃镁、铝之前,应先用砂纸打磨,除去表面的氧化膜
B.用砂纸打磨的铝条,放在酒精灯上加热至熔化,铝会滴落下来
C.铁在氧气中燃烧生成的氧化物的主要成分是四氧化三铁
D.金属单质在自然界中多以化合态的形式存在,因为它们大多有较强的还原性
6.化学在生产和日常生活中有着重要的应用,下表中用途与解释不正确的是( )
选项 用途 解释
A 常用于潜水艇或呼吸面具的供氧剂 与反应产生
B 常用铁盐作净水剂 生成吸附能力强的胶体
C 溶液可用于刻制印刷铜电路板 发生反应
D 在医疗上烧碱可用于治疗胃酸过多 烧碱可与胃酸反应
7.下列各试剂中,不能用来鉴别溶液和溶液的是( )
A.溶液 B.酸性溶液
C.溶液 D.溶液
8.某学习小组进行了下图所示的实验,实验后组员之间的交流不合理的是( )
A.甲同学认为试管b中收集到的气体可点燃,且产生淡蓝色火焰
B.乙同学认为试管a中生成的黑色固体可能为四氧化三铁
C.丙同学认为将少量还原铁粉放入试管中,加适量的水,加热也可实现该反应
D.丁同学认为用盐酸溶解固体生成物所得溶液有颜色
9.下列推理正确的是( )
A.铝粉在氧气中燃烧生成,故钠在氧气中燃烧生成
B.铁能从硫酸铜溶液中置换出铜,故钠也能从硫酸铜溶液中置换出铜
C.活泼金属钠保存在煤油中,故活泼金属铝也保存在煤油中
D.钠与氧气、水等反应时钠均作还原剂,故金属单质参与反应时金属单质均作还原剂
10.下列实验现象描述错误的是( )
选项 实验 现象
A 加热放在坩锅中的小块钠 钠先熔化成光亮的小球,燃烧时,火焰为黄色,燃烧后,生成淡黄色固体
B 在酒精灯上加热铝箔 铝箔熔化,失去光泽,熔化的铝并不滴落,好像有一层膜兜着
C 在溶液中滴入溶液 先生成白色沉淀,沉淀很快变为灰绿色,最后变为红褐色
D 在空气中久置的铝条放入溶液中 立刻产生大量无色气体,铝条逐渐变细,铝条逐渐发热
11.用铝箱包裹金属钠,用针扎若干个小孔,放入水中,完全反应后,放出的气体体积(标准状况)为( )
A.无法确定 B. C.大于 D.小于
12.镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)的关系如图所示。反应中镁和铝的( )
A.物质的量之比为 B.质量之比为
C.摩尔质量之比为 D.消耗硫酸的物质的量之比为
13.一定质量的铝铁合金溶于足量的溶液中,完全反应后产生(标准状况下)气体;用同样质量的铝铁合金完全溶于足量的盐酸中,在标准状况下产生的气体,则该合金中铝、铁的物质的量之比为( )
A. B. C. D.
14.将固体X投入过量的Y中,能生成白色沉淀并放出一种无色气体,该气体能燃烧,不易溶于水,则X和Y分别可能是( )
A.钠和氯化铝溶液 B.铝和烧碱溶液
C.过氧化钠和氯化亚铁溶液 D.锌和稀硫酸
15.在和的混合液中逐渐加入铁粉,溶液中的物质的量浓度和加入铁粉的物质的量之间的关系如图所示。则该溶液中与的物质的量浓度之比为( )
A. B. C. D.
16.铁粉溶于稀盐酸中,然后加入足量的固体,充分反应后过滤,将滤渣加强热,最终得到的固体质量为( )
A. B. C. D.
二、非选择题(本题包括4小题,共52分)
17.(12分)下表是某种常见金属的部分性质:
颜色和状态 硬度 密度 熔点 导电性 导热性 延展性
银白色固体 较软 良好 良好 良好
将该金属投入稀盐酸中,可产生大量的无色气体。根据上述信息回答下列问题:
(1)推断该金属的一种用途是________________________________________。
(2)该金属的活动性比铜________(填“强”或“弱”)。
(3)请自选试剂,设计实验探究该金属与铁的活动性的强弱。
①一种猜想:________________________________________________________________________________;
②验证方法:_______________________________________________________________________________;
③实验现象:________________________________________________________________________________;
④实验结论:________________________________________________________________________________。
18.(14分)下图中的每一方格表示有关的一种反应物或生成物,其中甲、乙、丙、丁为常见单质,其余均为化合物。A是一种常见的液态化合物,B是具有磁性的氧化物,D和丁既能和酸反应又能和碱反应,乙在丙中燃烧产生苍白色火焰,H在空气中很容易被氧化成I。它们的转化关系如下:(有些反应的条件和部分产物未注明)
(1)写出下列物质化学式:B________,F________;
(2)写出反应①的化学方程式:________________________________________________________________;
(3)H在空气中很容易被氧化成1,该过程的实验现象是____________________________________________;
(4)将足量的通入E溶液中,离子方程式是____________________________________________;
(5)将G的饱和溶液滴入沸水中得红褐色液体,该液体具有的性质有________(填写字母)。
A.丁达尔效应
B.红褐色液体可用过滤的方法提纯
C.液体中分散质微粒直径小于
D.取适量液体加入溶液会产生红褐色沉淀E.它较稳定的存在,因其带正电荷
19.(12分)(1)(二硫化亚铁)不溶于水,可溶于适量的稀硝酸中,离子方程式如下:
________________________________________________________
回答下列问题:
配平此氧化还原反应方程式,还原剂为________________________________________________________。
(2)为了验证的性质,某化学兴趣小组设计了如图所示的一组实验,实验方案设计错误的是________(填字母)。
A.④和⑤ B.只有③ C.③和④ D.①②③
(3)已知:氧化性,还原性,则向的溶液中通入标准状况下氯气,被氧化的粒子是________,此反应的离子方程式为________________________________。
20.(14分)为验证氧化性,某小组用如图所示装置进行实验(夹持仪器和A中加热装置已略,气密性已检验)。
实验过程:
I.打开弹簧夹,通入一段时间,再将T型导管插入B中,继续通入,然后关闭、、。
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热。
Ⅲ.当B中溶液变黄时,停止加热,关闭。
IV.打开活塞b,使约的溶液流入D试管中,检验其中的离子。
V.打开和活塞c,加入70%的硫酸溶液,一段时间后关闭。
Ⅵ.更换试管D,重复过程Ⅳ,检验B溶液中的离子。
(1)过程I的目的是________________________________________________________________。
(2)实验室在保存溶液时为了防止溶液变质,经常向其中加入铁粉,其原因是________________________________________________________。
(3)若向过程ⅢB中的黄色溶液中通入气体,会观察到有淡黄色沉淀生成,写出该反应的化学方程式:________________________________________________________________________________________。
(4)若将制取的通入硫酸酸化的高锰酸钾溶液可使溶液褪色,其反应的离子方程式为________________________________________________________。
(5)甲、乙、丙三位同学分别完成了上述实验,结论如下表所示。他们的检测结果一定能够证明氧化性的是________(填“甲”“乙”或“丙”)。
过程Ⅳ,B溶液中含有的离子 过程Ⅵ,B溶液中含有的离子
甲 有无 有
乙 既有又有 有
丙 有无 有
(6)将B中的溶液换成溶液并向其中通入,(标准状况下),若溶液中有1/2的被氧化成单质Br2,则原溶液中的物质的量浓度为________。
第三章综合测试
答案解析
一、选择题
1.【答案】D
【解析】青铜是铜的合金,具有导电性、导热性,其熔点比纯铜低,硬度比纯铜大,A、B、C正确,D错误。
2.【答案】B
【解析】生铁、普通钢和不锈钢中的碳含量依次降低,故B错误。
3.【答案】D
【解析】银的导电性能比铜好,A错误;钢是铁合金,B错误;合金的机械性能比成分金属好,多数合金的抗腐蚀性能比成分金属好,C错误;合金的熔点一般比成分金属低,焊锡的熔点比成分金属锡、铅的熔点都低,D正确。
4.【答案】C
【解析】做灯丝的材料不但要求能导电,而且要求熔点高,若熔点不够高则灯丝寿命不长,A正确;飞机在空中飞行,环境复杂,所以制造飞机的材料要坚硬而质轻,B正确;制造保险丝,关键是熔点低,电流超过正常范围,瞬间温度升高,在较低温度下就能够熔断,保护用电器不被烧毁,而不是需要金属的硬度大,C错误;化工原料一般具有腐蚀性,所以装化工原料的容器一定要耐腐蚀,D正确。
5.【答案】B
【解析】金属镁和铝易与氧气反应生成氧化物,所以在点燃之前,应先用砂纸打磨,除去表面的氧化膜,A对;用砂纸打磨的铝条,放在酒精灯上加热,金属铝的表面会形成氧化膜,氧化铝的熔点很高,所以不会滴落,B错;金属铁在氧气中燃烧生成四氧化三铁,C对;大多数金属单质具有较强的还原性,在自然界以化合态形式存在,D对。
6.【答案】D
【解析】烧碱腐蚀性强,不适合治疗胃酸过多,应选用弱碱性物质。
7.【答案】C
【解析】A项,溶液与溶液反应生成白色沉淀,白色沉淀迅速变为灰绿色,最后变成红褐色,溶液与溶液生成红褐色沉淀,可鉴别;B项,能使酸性溶液褪色的是硫酸亚铁溶液,没有明显现象的是硫酸铁溶液,可鉴别;C项,二者均与氯化钡溶液反应生成硫酸钡白色沉淀,不能鉴别;D项,加入溶液呈红色的是硫酸铁溶液,没有明显现象的是硫酸亚铁溶液,可鉴别。
8.【答案】C
【解析】在高温下铁与水蒸气反应生成氢气和四氧化三铁,故丙同学的观点不正确。
9.【答案】D
【解析】在氧气中燃烧生成,A错误:与水剧烈反应,故不能置换出溶液中的,B错误;铝与反应生成薄膜起保护作用,铝不用保存在煤油中,C错误。
10.【答案】D
【解析】在空气中久置的铝条表面有一层致密的薄膜,放入溶液中,不会立刻产生大量无色气体。
11.【答案】C
【解析】首先发生的反应是,标准状况下与水反应产生的体积为,然后发生的反应是,此反应又能产生部分,故最后放出的的体积大于。
12.【答案】A
【解析】镁和铝分别与等浓度、等体积的稀硫酸反应,化学方程式为、相同条件下产生的体积相等,则物质的量相等,根据化学方程式可得与的物质的量之比为,A对;与的质量之比为,B错;镁、铝的摩尔质量之比为,C错;由于反应生成的氢气一样多,则消耗硫酸的物质的量之比为,D错。
13.【答案】A
【解析】合金溶于足量的溶液中,铝发生反应:,产生氢气(标准状况),其物质的量,由方程式可知,铁合金溶于足量的盐酸中,都反应产生氢气,与足量的氢氧化钠溶液、盐酸反应产生氢气体积相等,则与盐酸反应生成氢气体积,其物质的量,根据可知,故合金中铝、铁的物质的量之比。
14.【答案】A
【解析】A项中Na与水反应生成和,与过量的溶液反应生成白色沉淀;B项中,无沉淀生成;C项中,与过量溶液反应,生成白色沉淀,然后迅速变成灰绿色,最终变为红褐色沉淀;D项中,无沉淀生成。
15.【答案】C
【解析】根据氧化性:,加入铁后会依次发生氧化还原反应:①,②,从题图中可知加入时,发生反应①生成的物质的量为,反应的的物质的量为,即为;再加入铁发生反应②,此时生成物质的量为,原溶液中的物质的量为,即为;同一溶液中浓度之比等于物质的量之比,所以原溶液中的浓度之比为。
16.【答案】B
【解析】铁粉的物质的量是,溶于稀盐酸中生成氯化亚铁,然后加入足量的固体,充分反应后过滤得到氢氧化铁,将滤渣加强热,最终得到的固体是氧化铁,根据铁原子守恒可知氧化铁的质量为。
二、非选择题
17.【答案】(1)用于制电线或实验室制氢气等(合理即可)
(2)强
(3)①该金属的活动性比铁强 ②取两支大小相同的试管,分别注入同体积、同浓度的稀盐酸;向两支试管中同时分别加入大小和表面积相同的铁片和该金属片,比较反应快慢 ③都有气泡放出,被测金属产生气泡更快④被测金属的活动性比铁强
【解析】(1)该金属具有良好的导电性,且能与盐酸反应生成无色气体,因此可以用于制电线,也可以用来制取氢气等。
(2)由于该金属可以和盐酸反应,说明其金属活动性在氢前,比铜活动性强。
(3)为了探究该金属和铁的金属活动性强弱,可以采用和酸溶液反应,也可以和盐溶液反应。
18.【答案】(1)
(2)
(3)白色沉淀迅速变为灰绿色,最终变为红褐色
(4)
(5)AD
【解析】甲、乙、丙、丁为常见单质,其余均为化合物,A是一种常见的液态化合物,则A为,B是具有磁性的氧化物,则B为,D和丁既能和酸反应又能和碱反应,则丁为,D为,E为,结合转化关系可知,甲为,乙为,丙为,C为HCI,F为,H在空气中很容易被氧化成I,则H为,I为,G为。
(1)通过以上分析知,B、F分别是、。
(2)A与甲反应的化学方程式为。
(3)H为,I为,是白色沉淀,是红褐色沉淀,不稳定,极易被空气中的0,氧化成红褐色沉淀,看到的现象是白色沉淀迅速变为灰绿色,最终变为红褐色。
(4)E是偏铝酸钠,足量二氧化碳通入偏铝酸钠溶液中反应生成氢氧化铝沉淀和碳酸氢钠,离子方程式为。
(5)将G的饱和溶液滴入沸水中得红褐色液体,该液体是胶体,具有丁达尔效应,其分散质微粒直径在之间,能透过滤纸但不能透过半透膜,能和电解质溶液发生聚沉现象,故选AD。
19.【答案】(1)1 4 1 1 2 1 2
(2)C
(3)
【解析】(1)中铁元素的化合价为价,硫元素的化合价为价,反应后硫元素化合价为0价,铁元素化合价为价,氮元素化合价由价变化为价,结合原子守恒和得失电子守恒配平化学方程式,还原剂为。
(2)①与溶液反应的离子方程式为,溶液变成浅绿色;②与溶液反应的离子方程式为溶液变成红色;③硫酸铜与溶液不反应;④硝酸银与溶液反应的离子方程式为,产生白色沉淀,但不是的性质;③氢氧化钠与溶液反应的离子方程式为,出现红褐色沉淀。
(3)还原性,向溶液中通入时,先与反应,消耗完后再反应。溶液中的物质的量为,通入的物质的量为,则被氧化的粒子是,反应的离子方程式为。
20.【答案】(1)排出装置中的空气,防止干扰
(2)容易被空气中的氧气氧化,铁粉可以将氧化得到的还原为
(3)
(4)
(5)甲、乙
(6)
【解析】(1)打开通入一段时间,目的是排出装置中的空气,防止其氧化,干扰实验。
(2)被空气中的氧化变为、若加入铁粉、会发生反应:,从而可以起到防止变质的作用。
(3)具有强氧化性,可以与反应,生成S单质、、,反应的化学方程式为。
(4)具有还原性,酸性高锰酸钾溶液具有强氧化性,将通入酸性高锰酸钾溶液中,被氧化成硫酸,被还原变为,根据得失电子守恒、电荷守恒及原子守恒,可得离子方程式为。
(5)乙中过程Ⅳ,说明氯气不足、氯气氧化性大于铁离子,过程Ⅵ有硫酸根离子,说明发生与的反应,则氧化性:,甲中过程Ⅳ有,无则氧化性:,过程Ⅵ有,说明发生与的反应,则氧化性:。(6)设的物质的量浓度为,根据得失电子守恒可知,,解得。
W
高中化学 必修第一册 6 / 6
