人教版化学选修五第一章第四节研究有机化合物的一般步骤和方法 (共31张PPT)
文档属性
| 名称 | 人教版化学选修五第一章第四节研究有机化合物的一般步骤和方法 (共31张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 894.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-05-20 09:59:22 | ||
图片预览










文档简介
(共31张PPT)
白云一高:陈永财
第一章:认识有机化合物
第四节研究有机化合物的一般步
骤和方法
null
一、分离、提纯
研究有机化合物一般要经过以下几个基本步骤:
分离、提纯→元素定量分析→测定相对分子质量→波谱分析
元素定量分析确定实验式,测定相对分子质量确定分子式,波谱分析确定结构式。
1.蒸馏
蒸馏是分离、提纯液态有机物的常用方法。
适用条件:
①有机物的热稳定性较强;
②有机物与杂质的沸点相差较大(一般相差大于30 ℃)。
第四节研究有机化合物的一般步骤和方法
第1课时 有机物的分离与提纯
null
2.重结晶
重结晶是提纯固态有机物的常用方法。
适用条件:
①杂质在所选溶剂中溶解度很小或溶解度很大,易于除去
②被提纯的有机物在所选溶剂中的溶解度受温度的影响较大。该有机物在热溶液中的溶解度较大,在冷溶液中的溶解度较小,冷却后易于结晶析出。
实验装置与操作步骤
加热溶解→趁热过滤→冷却结晶
null
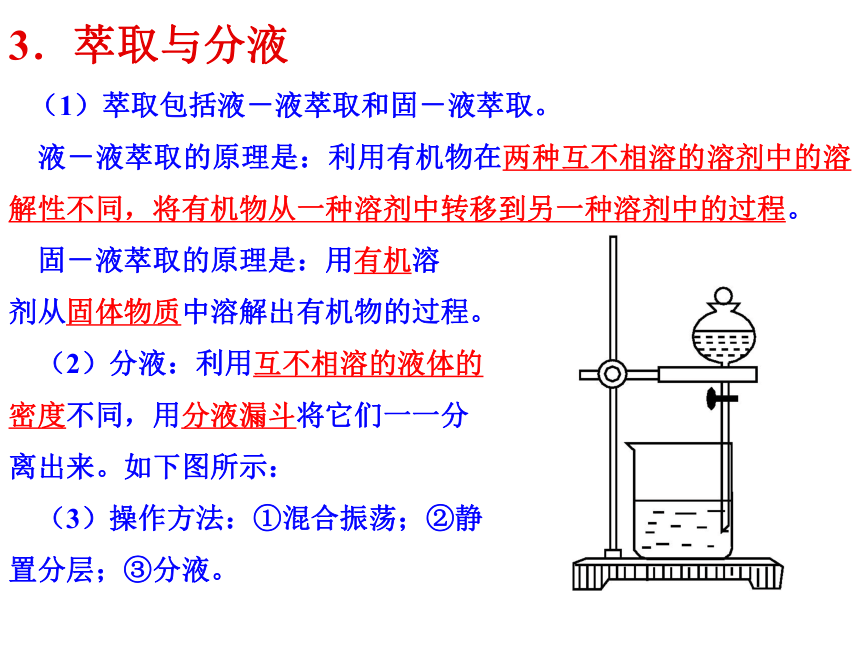
3.萃取与分液
(1)萃取包括液-液萃取和固-液萃取。
液-液萃取的原理是:利用有机物在两种互不相溶的溶剂中的溶解性不同,将有机物从一种溶剂中转移到另一种溶剂中的过程。
固-液萃取的原理是:用有机溶
剂从固体物质中溶解出有机物的过程。
(2)分液:利用互不相溶的液体的
密度不同,用分液漏斗将它们一一分
离出来。如下图所示:
(3)操作方法:①混合振荡;②静
置分层;③分液。
null
4.色谱法
原理:利用吸附剂对不同有机物吸附作用的不同,分离、提纯有机物,这种方法就是色谱法。
常用吸附剂:碳酸钙、硅胶、氯化铝、活性炭等。
null
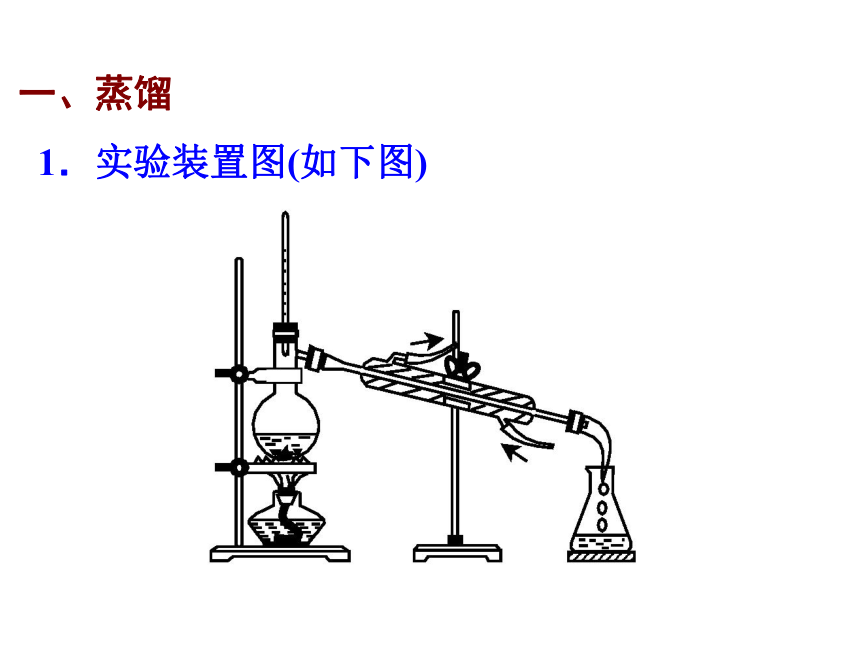
一、蒸馏
1.实验装置图(如下图)
null
2.实验(含有杂质的工业乙醇的蒸馏)注意事项
(1)安装顺序:安装蒸馏仪器时要注意先从蒸馏烧瓶装起,根据加热器的高低确定蒸馏烧瓶的位置,然后再接水冷凝管、尾接管、接受器(锥形瓶),即“自下而上”、“先左后右”。拆卸蒸馏装置时顺序相反,即“先右后左”。
(2)加入几片碎瓷片,防止液体暴沸。
(3)加入乙醇的量占蒸馏烧瓶容积1/3~2/3,一般1/2为宜。
(4)温度计的水银球应置于蒸馏烧瓶的支管口处。
(5)冷凝管中的冷却水应从下口进,上口出。
(6)收集到的馏出物叫馏分,它只是某一温度范围内的蒸馏产物,仍然含有少量杂质。
null
二、重结晶
1.重结晶可以使不纯净的物质纯化,或使混合在一起的物质彼此分离。
2.重结晶的效果与溶剂选择大有关系,最好选择对主要化合物是可溶性的,对杂质是微溶或不溶的溶剂。滤去杂质后,将溶液浓缩、冷却,即得纯制的物质。
3.对杂质的溶解度非常大或非常小,前一种情况杂质留于母液内,后一种情况趁热过滤时杂质被滤除。
4.溶剂的用量不能太大,如果太大,析出时留在溶剂中的物质会增加。应将不纯固体物质溶解于适当的热的溶剂中制成接近饱和的溶液。
5.多次重结晶得到物质的纯度更高。
null
【实验】苯甲酸的重结晶
步骤:高温溶解、趁热过滤、冷却结晶。
将1 g粗苯甲酸加到100 mL的烧杯中,再加入50 mL蒸馏水,在石棉网上边搅拌边加热,使粗苯甲酸溶解,全溶解后再加入少量蒸馏水。然后使用短颈玻璃漏斗趁热将溶液过滤到另一个100 mL的烧杯中,将滤液静置,使其缓慢冷却结晶,滤出晶体。
【探究】在苯甲酸重结晶的实验中温度越低,苯甲酸溶解度越小,为了得到更多的苯甲酸晶体,结晶时温度是不是越低越好?
提示:冷却结晶时,并不是温度越低越好。因为温度过低,杂质的溶解度也会降低,部分杂质也会析出,达不到提纯苯甲酸的目的;温度极低时,溶剂(水)也会结晶,给实验操作带来麻烦。
null
三、萃取
1.液-液萃取是分离、提纯有机物常用的方法,一般是用有机溶剂从水中萃取有机物。
①常用的仪器:分液漏斗、烧杯、铁架台。
②操作:加萃取剂后充分振荡,放到铁架台的铁圈上静止分层后,先打开分液漏斗上端活塞,再打开下端的旋塞,从下口将下层液体放出,并及时关闭旋塞(以防上层液体进入下层液体),上层液体从上口倒出。
2.选用萃取剂的原则:①和原溶液中溶剂互不相溶;②溶质在萃取剂中的溶解度要大于原溶剂中的溶解度;
③萃取剂与被萃取的物质要易于分离。
null
知识点1:混合物的分离、提纯的方法
例1、将除去下列括号内的杂质通常采用的方法填在横线上:
(1)CH3COONa(NaCl):__________________。
(2) (Br2):____________________。
(3)C2H5OH(CH3COOH):________________。
解析 蒸馏是根据液体沸点的不同,重结晶是根据固体溶解度的不同,而萃取是根据液态物质在不同溶剂中溶解度的不同进行的分离操作。
答案(1)重结晶(2)萃取分液(常选用的是NaOH溶液)
(3)加NaOH后蒸馏
null
练习1、将除去下列括号内的杂质通常采用的方法填在横线上。
(1)H2O(NaCl、MgCl2):__________________。
(2)CH3OH(H2O):______________________。
(注:CH3OH为甲醇,沸点为64.7 ℃)
(3)KNO3(NaCl):________________。
答案(1)蒸馏 (2)蒸馏(可加入生石灰) (3)重结晶
null
知识点2:混合物的分离、提纯试剂的选择
例2下图是分离乙酸乙酯、乙酸、乙醇的混合物操作步骤流程图。请在图中圆括号内填入适当的试剂,在方括号内填入适当的分离方法,在方框内填入所分离的有关物质的化学式。
解析三者为互溶的液体,CH3COOCH2CH3不溶于水,CH3COOH、CH3CH2OH均易溶于水,故可先用水溶液分离出CH3COOCH2CH3;乙醇、乙酸的沸点相差不大(78 ℃,117 ℃)且极易互溶,故设法将CH3COOH转化为盐类,而后利用蒸馏法得到CH3CH2OH,最后将乙酸盐再转化为CH3COOH,蒸馏得到即可。
答案a:饱和Na2CO3 ①分液②蒸馏b:H2SO4 ③蒸馏A:CH3COOCH2CH3
B:CH3CH2OH、CH3COONa C:CH3COONa D:CH3COOH E:CH3CH2OH
null
一、元素分析与相对分子质量的测定
1.元素分析
定性分析:用化学方法鉴定有机物分子的元素组成,如燃烧后C→CO2,H→H2O,Cl→HCl。
定量分析:将一定量有机物燃烧后分解为简单有机物,并测定各产物的量,从而推算出各组成元素的质量分数。
实验式:表示有机物分子所含元素原子最简单的整数比。
null
(1)实验方法
①李比希氧化产物吸收法
用CuO将仅含C、H、O元素的有机物氧化,氧化后产物H2O用无水CaCl2吸收,CO2用KOH浓溶液吸收,分别称出吸收前后吸收剂的质量,计算出碳、氢原子在分子中的含量,其余的为氧原子的含量。
②现代元素分析法
(2)数据处理
碳、氢、氧在某有机物中的原子个数比
n(C)∶n(H)∶n(O)= ∶ ×2∶ ,元素分
析只能确定组成分子的各原子最简单的整数比。
2.相对分子质量的测定——质谱法
(1)原理:用高能电子流
等轰击样品分子,使该分子
失去电子变成带正电荷的分
子离子和碎片离子。分子离
子和碎片离子具有不同的相
对质量,它们在磁场的作用
下,到达检测器的时间将因
质量的不同而有先后,其结
果被记录为质谱图。
(2)质荷比:分子离子与
碎片离子的相对质量与其电
荷的比值。
由上图可看出,质荷比
最大的数据是46,这就表示了未知物质A的相对分子质量。
元素质量
元素质量比
元素质量分数
产物的量
实验式
相对分子质量
通式
分子式
化学方程式
有机物的性质
可能结构
确定结构
直接法
最简式法
商余法
化学方程式法
通式法
二、分子结构的确定
仅仅确定了有机物的分子式,还不能弄清分子内部的结构。如前面提到未知物A的相对分子质量为46,实验式的相对分子质量也为46,因此实验式就是分子式,即C2H6O,但
它可能出现两种结构: 和 ,
因此只有鉴定分子结构才能确定。
鉴定结构的方法有物理方法和化学方法。
化学方法主要是鉴别官能团,物理方法主要有红外光谱、核磁共振氢谱等方法。
1.红外光谱
在有机物分子中,组成化学键或官能团的原子处于不断振动的状态,其振动频率与红外光的振动频率相当。所以,当用红外线照射有机物分子时,分子中的化学键或官能团可发生振动吸收,不同的化学键或官能团吸收频率不同,在红外光谱图上将处于不同的位置,从而可以获得分子中含有何种化学键或官能团的信息。
null
例如,上面提到的未知物A的红外光谱图(如下图)上发现有O—H键、C—H键和C—O键的振动吸收。
因此,可以初步推测该未知物A是含羟基的化合物,结构简式可写为C2H5—OH。
2.核磁共振氢谱
氢原子核具有磁性,如用电磁波照射氢原子核,它能通过共振吸收电磁波能量,发生跃迁。用核磁共振仪可以记录到有关信号,处在不同化学环境中的氢原子因产生共振时吸收的频率不同,在谱图上出现的位置也不同,且吸收峰的面积与氢原子数成正比。因此,从核磁共振氢谱图上可以推知该有机物分子有几种不同类型的氢原子及它们的数目。
未知物A(C2H5—OH)的核磁共振氢谱有三个峰(如图1),峰面积之比是1∶2∶3,它们分别为羟基的一个氢原子、亚甲基(—CH2—)上的两个氢原子和甲基上的三个氢原子的吸收峰。而二甲醚(CH3OCH3)中的六个氢原子均处于相同的化学环境,只有一种氢原子,应只有一个吸收峰(如图2)。
从上述未知物A的红外光谱和核磁共振氢谱可知:
(1)红外光谱图表明有羟基(—OH)、C—O键和C—H键红外吸收峰。
(2)核磁共振氢谱有三种类型氢原子的吸收峰
因此,未知物A的结构简式应该是CH3CH2OH,而不是H3OCH3。
确定有机物分子式的方法
(1)实验式法:
首先根据题意求出烃的实验式,设为CaHb, =x,
x取值 种类 方法
x< 烷烃 根据烷烃的通式CnH2n+2, =x,可求出n值
x= 烯烃或环烷烃 先确定相对分子质量,再确定分子式
<x<1 CnH2n-2或CnH2n-6 直接用CnH2n-2或CnH2n-6代入验证,看是否符合
x=1 C2H2或
C6H6或
C8H8等 需结合其他条件确定分子式
(2)物质的量关系法:由密度或其他条件→求摩尔质量→求1 mol分子中所含各元素原子的物质的量→求分子式。
(3)化学方程式法(代数法):利用化学方程式及题干要求→列方程组→求解未知数值→求分子式。
(4)通式法:题干要求或物质性质→确定类别及组成通式
n值→分子式。
(直接法)
(5)商余法:M/12 M/14
知识点1:核磁共振氢谱的考查
例1为测定某有机化合物A的结构,进行如下实验:
Ⅰ.分子式的确定:
(1)将有机物A置于氧气流中充分燃烧,实验测得生成5.4 g H2O和8.8 g CO2,消耗氧气6.72 L(标准状况下),则该物质中各元素的原子个数比是________。
(2)用质谱仪测定该有机化合物的相对分子质量得到如图①所示质谱图,则其相对分子质量为________,该物质的分子式是________。
(3)根据价键理论,预测A的可能结构并写出结构简式:____________________________。
null
Ⅱ.结构式的确定:
(4)核磁共振氢谱能对有机物分子中不同位置的氢原子给出不同的峰值(信号),根据峰值(信号)可以确定分子中氢原子的种类和数目。例如:甲基氯甲基醚(Cl—CH2—O—CH3)有两种氢原子,如图②。经测定,有机物A的核磁共振氢谱示意图如图③,则A的结构简式为________________。
解析 (1)据题意有:n(H2O)=0.3 mol,则有n(H)=0.6 mol;n(CO2)=0.2 mol,则有n(C)=0.2 mol。据氧原子守恒有n(O)=n(H2O)+2n(CO2)-2n(O2)=0.3 mol+2×0.2 mol-
2× =0.1 mol,则N(C)∶N(H)∶N(O)=
n(C)∶n(H)∶n(O)=2∶6∶1。(2)据(1)可知该有机物的实验式为C2H6O,假设该有机物的分子式为(C2H6O)m,由质谱图知其相对分子质量为46,则46m=46,即m=1,故其分子式为C2H6O。(3)由A的分子式为C2H6O可知A为饱和化合物,可推测其结构为CH3CH2OH或CH3OCH3。(4)分析A的核磁共振氢谱图可知:A有三种不同类型的H原子,CH3OCH3只有一种类型的H原子,故A的结构简式为CH3CH2OH。
答案 (1)2∶6∶1 (2)46;C2H6O
(3)CH3CH2OH,CH3—O—CH3 (4)CH3CH2OH
null
知识点2:红外光谱的考查
例1下图是一种分子式为C4H8O2的有机物的红外光谱谱图,则该有机物的结构简式为______________________。
解析 由图可知,分子中有C=O和C—O—C结构,即分子里有酯基,所以该有机物可能的结构简式为
CH3CH2COOCH3、CH3COOCH2CH3、
HCOOCH2CH2CH3、HCOOCH(CH3)2。
答案 CH3CH2COOCH3、CH3COOCH2CH3、
HCOOCH2CH2CH3、HCOOCH(CH3)2
本 章 小 结
白云一高:陈永财
第一章:认识有机化合物
第四节研究有机化合物的一般步
骤和方法
null
一、分离、提纯
研究有机化合物一般要经过以下几个基本步骤:
分离、提纯→元素定量分析→测定相对分子质量→波谱分析
元素定量分析确定实验式,测定相对分子质量确定分子式,波谱分析确定结构式。
1.蒸馏
蒸馏是分离、提纯液态有机物的常用方法。
适用条件:
①有机物的热稳定性较强;
②有机物与杂质的沸点相差较大(一般相差大于30 ℃)。
第四节研究有机化合物的一般步骤和方法
第1课时 有机物的分离与提纯
null
2.重结晶
重结晶是提纯固态有机物的常用方法。
适用条件:
①杂质在所选溶剂中溶解度很小或溶解度很大,易于除去
②被提纯的有机物在所选溶剂中的溶解度受温度的影响较大。该有机物在热溶液中的溶解度较大,在冷溶液中的溶解度较小,冷却后易于结晶析出。
实验装置与操作步骤
加热溶解→趁热过滤→冷却结晶
null
3.萃取与分液
(1)萃取包括液-液萃取和固-液萃取。
液-液萃取的原理是:利用有机物在两种互不相溶的溶剂中的溶解性不同,将有机物从一种溶剂中转移到另一种溶剂中的过程。
固-液萃取的原理是:用有机溶
剂从固体物质中溶解出有机物的过程。
(2)分液:利用互不相溶的液体的
密度不同,用分液漏斗将它们一一分
离出来。如下图所示:
(3)操作方法:①混合振荡;②静
置分层;③分液。
null
4.色谱法
原理:利用吸附剂对不同有机物吸附作用的不同,分离、提纯有机物,这种方法就是色谱法。
常用吸附剂:碳酸钙、硅胶、氯化铝、活性炭等。
null
一、蒸馏
1.实验装置图(如下图)
null
2.实验(含有杂质的工业乙醇的蒸馏)注意事项
(1)安装顺序:安装蒸馏仪器时要注意先从蒸馏烧瓶装起,根据加热器的高低确定蒸馏烧瓶的位置,然后再接水冷凝管、尾接管、接受器(锥形瓶),即“自下而上”、“先左后右”。拆卸蒸馏装置时顺序相反,即“先右后左”。
(2)加入几片碎瓷片,防止液体暴沸。
(3)加入乙醇的量占蒸馏烧瓶容积1/3~2/3,一般1/2为宜。
(4)温度计的水银球应置于蒸馏烧瓶的支管口处。
(5)冷凝管中的冷却水应从下口进,上口出。
(6)收集到的馏出物叫馏分,它只是某一温度范围内的蒸馏产物,仍然含有少量杂质。
null
二、重结晶
1.重结晶可以使不纯净的物质纯化,或使混合在一起的物质彼此分离。
2.重结晶的效果与溶剂选择大有关系,最好选择对主要化合物是可溶性的,对杂质是微溶或不溶的溶剂。滤去杂质后,将溶液浓缩、冷却,即得纯制的物质。
3.对杂质的溶解度非常大或非常小,前一种情况杂质留于母液内,后一种情况趁热过滤时杂质被滤除。
4.溶剂的用量不能太大,如果太大,析出时留在溶剂中的物质会增加。应将不纯固体物质溶解于适当的热的溶剂中制成接近饱和的溶液。
5.多次重结晶得到物质的纯度更高。
null
【实验】苯甲酸的重结晶
步骤:高温溶解、趁热过滤、冷却结晶。
将1 g粗苯甲酸加到100 mL的烧杯中,再加入50 mL蒸馏水,在石棉网上边搅拌边加热,使粗苯甲酸溶解,全溶解后再加入少量蒸馏水。然后使用短颈玻璃漏斗趁热将溶液过滤到另一个100 mL的烧杯中,将滤液静置,使其缓慢冷却结晶,滤出晶体。
【探究】在苯甲酸重结晶的实验中温度越低,苯甲酸溶解度越小,为了得到更多的苯甲酸晶体,结晶时温度是不是越低越好?
提示:冷却结晶时,并不是温度越低越好。因为温度过低,杂质的溶解度也会降低,部分杂质也会析出,达不到提纯苯甲酸的目的;温度极低时,溶剂(水)也会结晶,给实验操作带来麻烦。
null
三、萃取
1.液-液萃取是分离、提纯有机物常用的方法,一般是用有机溶剂从水中萃取有机物。
①常用的仪器:分液漏斗、烧杯、铁架台。
②操作:加萃取剂后充分振荡,放到铁架台的铁圈上静止分层后,先打开分液漏斗上端活塞,再打开下端的旋塞,从下口将下层液体放出,并及时关闭旋塞(以防上层液体进入下层液体),上层液体从上口倒出。
2.选用萃取剂的原则:①和原溶液中溶剂互不相溶;②溶质在萃取剂中的溶解度要大于原溶剂中的溶解度;
③萃取剂与被萃取的物质要易于分离。
null
知识点1:混合物的分离、提纯的方法
例1、将除去下列括号内的杂质通常采用的方法填在横线上:
(1)CH3COONa(NaCl):__________________。
(2) (Br2):____________________。
(3)C2H5OH(CH3COOH):________________。
解析 蒸馏是根据液体沸点的不同,重结晶是根据固体溶解度的不同,而萃取是根据液态物质在不同溶剂中溶解度的不同进行的分离操作。
答案(1)重结晶(2)萃取分液(常选用的是NaOH溶液)
(3)加NaOH后蒸馏
null
练习1、将除去下列括号内的杂质通常采用的方法填在横线上。
(1)H2O(NaCl、MgCl2):__________________。
(2)CH3OH(H2O):______________________。
(注:CH3OH为甲醇,沸点为64.7 ℃)
(3)KNO3(NaCl):________________。
答案(1)蒸馏 (2)蒸馏(可加入生石灰) (3)重结晶
null
知识点2:混合物的分离、提纯试剂的选择
例2下图是分离乙酸乙酯、乙酸、乙醇的混合物操作步骤流程图。请在图中圆括号内填入适当的试剂,在方括号内填入适当的分离方法,在方框内填入所分离的有关物质的化学式。
解析三者为互溶的液体,CH3COOCH2CH3不溶于水,CH3COOH、CH3CH2OH均易溶于水,故可先用水溶液分离出CH3COOCH2CH3;乙醇、乙酸的沸点相差不大(78 ℃,117 ℃)且极易互溶,故设法将CH3COOH转化为盐类,而后利用蒸馏法得到CH3CH2OH,最后将乙酸盐再转化为CH3COOH,蒸馏得到即可。
答案a:饱和Na2CO3 ①分液②蒸馏b:H2SO4 ③蒸馏A:CH3COOCH2CH3
B:CH3CH2OH、CH3COONa C:CH3COONa D:CH3COOH E:CH3CH2OH
null
一、元素分析与相对分子质量的测定
1.元素分析
定性分析:用化学方法鉴定有机物分子的元素组成,如燃烧后C→CO2,H→H2O,Cl→HCl。
定量分析:将一定量有机物燃烧后分解为简单有机物,并测定各产物的量,从而推算出各组成元素的质量分数。
实验式:表示有机物分子所含元素原子最简单的整数比。
null
(1)实验方法
①李比希氧化产物吸收法
用CuO将仅含C、H、O元素的有机物氧化,氧化后产物H2O用无水CaCl2吸收,CO2用KOH浓溶液吸收,分别称出吸收前后吸收剂的质量,计算出碳、氢原子在分子中的含量,其余的为氧原子的含量。
②现代元素分析法
(2)数据处理
碳、氢、氧在某有机物中的原子个数比
n(C)∶n(H)∶n(O)= ∶ ×2∶ ,元素分
析只能确定组成分子的各原子最简单的整数比。
2.相对分子质量的测定——质谱法
(1)原理:用高能电子流
等轰击样品分子,使该分子
失去电子变成带正电荷的分
子离子和碎片离子。分子离
子和碎片离子具有不同的相
对质量,它们在磁场的作用
下,到达检测器的时间将因
质量的不同而有先后,其结
果被记录为质谱图。
(2)质荷比:分子离子与
碎片离子的相对质量与其电
荷的比值。
由上图可看出,质荷比
最大的数据是46,这就表示了未知物质A的相对分子质量。
元素质量
元素质量比
元素质量分数
产物的量
实验式
相对分子质量
通式
分子式
化学方程式
有机物的性质
可能结构
确定结构
直接法
最简式法
商余法
化学方程式法
通式法
二、分子结构的确定
仅仅确定了有机物的分子式,还不能弄清分子内部的结构。如前面提到未知物A的相对分子质量为46,实验式的相对分子质量也为46,因此实验式就是分子式,即C2H6O,但
它可能出现两种结构: 和 ,
因此只有鉴定分子结构才能确定。
鉴定结构的方法有物理方法和化学方法。
化学方法主要是鉴别官能团,物理方法主要有红外光谱、核磁共振氢谱等方法。
1.红外光谱
在有机物分子中,组成化学键或官能团的原子处于不断振动的状态,其振动频率与红外光的振动频率相当。所以,当用红外线照射有机物分子时,分子中的化学键或官能团可发生振动吸收,不同的化学键或官能团吸收频率不同,在红外光谱图上将处于不同的位置,从而可以获得分子中含有何种化学键或官能团的信息。
null
例如,上面提到的未知物A的红外光谱图(如下图)上发现有O—H键、C—H键和C—O键的振动吸收。
因此,可以初步推测该未知物A是含羟基的化合物,结构简式可写为C2H5—OH。
2.核磁共振氢谱
氢原子核具有磁性,如用电磁波照射氢原子核,它能通过共振吸收电磁波能量,发生跃迁。用核磁共振仪可以记录到有关信号,处在不同化学环境中的氢原子因产生共振时吸收的频率不同,在谱图上出现的位置也不同,且吸收峰的面积与氢原子数成正比。因此,从核磁共振氢谱图上可以推知该有机物分子有几种不同类型的氢原子及它们的数目。
未知物A(C2H5—OH)的核磁共振氢谱有三个峰(如图1),峰面积之比是1∶2∶3,它们分别为羟基的一个氢原子、亚甲基(—CH2—)上的两个氢原子和甲基上的三个氢原子的吸收峰。而二甲醚(CH3OCH3)中的六个氢原子均处于相同的化学环境,只有一种氢原子,应只有一个吸收峰(如图2)。
从上述未知物A的红外光谱和核磁共振氢谱可知:
(1)红外光谱图表明有羟基(—OH)、C—O键和C—H键红外吸收峰。
(2)核磁共振氢谱有三种类型氢原子的吸收峰
因此,未知物A的结构简式应该是CH3CH2OH,而不是H3OCH3。
确定有机物分子式的方法
(1)实验式法:
首先根据题意求出烃的实验式,设为CaHb, =x,
x取值 种类 方法
x< 烷烃 根据烷烃的通式CnH2n+2, =x,可求出n值
x= 烯烃或环烷烃 先确定相对分子质量,再确定分子式
<x<1 CnH2n-2或CnH2n-6 直接用CnH2n-2或CnH2n-6代入验证,看是否符合
x=1 C2H2或
C6H6或
C8H8等 需结合其他条件确定分子式
(2)物质的量关系法:由密度或其他条件→求摩尔质量→求1 mol分子中所含各元素原子的物质的量→求分子式。
(3)化学方程式法(代数法):利用化学方程式及题干要求→列方程组→求解未知数值→求分子式。
(4)通式法:题干要求或物质性质→确定类别及组成通式
n值→分子式。
(直接法)
(5)商余法:M/12 M/14
知识点1:核磁共振氢谱的考查
例1为测定某有机化合物A的结构,进行如下实验:
Ⅰ.分子式的确定:
(1)将有机物A置于氧气流中充分燃烧,实验测得生成5.4 g H2O和8.8 g CO2,消耗氧气6.72 L(标准状况下),则该物质中各元素的原子个数比是________。
(2)用质谱仪测定该有机化合物的相对分子质量得到如图①所示质谱图,则其相对分子质量为________,该物质的分子式是________。
(3)根据价键理论,预测A的可能结构并写出结构简式:____________________________。
null
Ⅱ.结构式的确定:
(4)核磁共振氢谱能对有机物分子中不同位置的氢原子给出不同的峰值(信号),根据峰值(信号)可以确定分子中氢原子的种类和数目。例如:甲基氯甲基醚(Cl—CH2—O—CH3)有两种氢原子,如图②。经测定,有机物A的核磁共振氢谱示意图如图③,则A的结构简式为________________。
解析 (1)据题意有:n(H2O)=0.3 mol,则有n(H)=0.6 mol;n(CO2)=0.2 mol,则有n(C)=0.2 mol。据氧原子守恒有n(O)=n(H2O)+2n(CO2)-2n(O2)=0.3 mol+2×0.2 mol-
2× =0.1 mol,则N(C)∶N(H)∶N(O)=
n(C)∶n(H)∶n(O)=2∶6∶1。(2)据(1)可知该有机物的实验式为C2H6O,假设该有机物的分子式为(C2H6O)m,由质谱图知其相对分子质量为46,则46m=46,即m=1,故其分子式为C2H6O。(3)由A的分子式为C2H6O可知A为饱和化合物,可推测其结构为CH3CH2OH或CH3OCH3。(4)分析A的核磁共振氢谱图可知:A有三种不同类型的H原子,CH3OCH3只有一种类型的H原子,故A的结构简式为CH3CH2OH。
答案 (1)2∶6∶1 (2)46;C2H6O
(3)CH3CH2OH,CH3—O—CH3 (4)CH3CH2OH
null
知识点2:红外光谱的考查
例1下图是一种分子式为C4H8O2的有机物的红外光谱谱图,则该有机物的结构简式为______________________。
解析 由图可知,分子中有C=O和C—O—C结构,即分子里有酯基,所以该有机物可能的结构简式为
CH3CH2COOCH3、CH3COOCH2CH3、
HCOOCH2CH2CH3、HCOOCH(CH3)2。
答案 CH3CH2COOCH3、CH3COOCH2CH3、
HCOOCH2CH2CH3、HCOOCH(CH3)2
本 章 小 结
