沪科版高二下学期-化学13.2检验一些无机化合物-混合物的检验A(优化)(共28张PPT)
文档属性
| 名称 | 沪科版高二下学期-化学13.2检验一些无机化合物-混合物的检验A(优化)(共28张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 332.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-05-21 20:38:44 | ||
图片预览







文档简介
(共28张PPT)
混合物的检验
【基础】
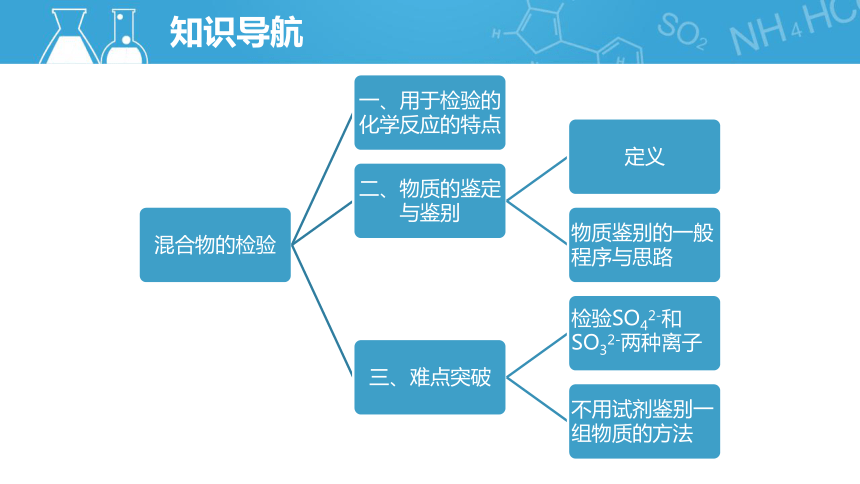
知识导航
一、用于检验的化学反应的特点
用于检验的化学反应,一般反应条件温和(如常温或稍加热),操作简便,并具有明显的反应现象(如颜色变化、沉淀的生成或溶解、生成气体等)。
二、物质的鉴定与鉴别
1.定义
(1)确定一种物质的成分或确定混合物中的各种成分叫做物质的鉴定。
(2)将两种或两种以上的物质一一区分开来是物质的鉴别。
二、物质的鉴定与鉴别
2.物质鉴别的一般程序与思路
首先分析被鉴别物质的性质差异,选定某种物理方法或化学方法,然后进行实验操作,最后依据实验现象的不同,确定它们各是什么物质。
鉴别时,通常将未知试样加以编号,如①号试样、②号试样……以免混淆。鉴别物质时,如有多种方法可选用,一般应选用操作简单、现象明显、实验次数较少的方法。如果试样是溶液,则可先鉴别溶液的酸、碱性。对于多种未知试样,第1次实验尽可能将它们分为两组,再分别对各组试样进行第2、3次实验。
无机物如酸、碱、盐等物质的鉴别通常采用离子检验的化学方法。
三、难点突破
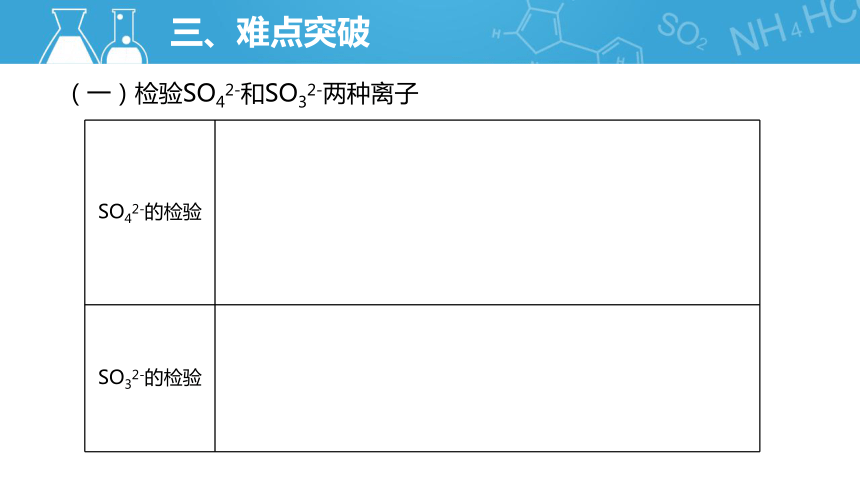
(一)检验SO42-和SO32-两种离子
SO42-的检验
SO32-的检验
三、难点突破
(一)检验SO42-和SO32-两种离子
SO42的检验 ①先用盐酸溶液将溶液酸化,以排除杂质离子(SO32-、Ag+、CO32-等)干扰;
②加入BaCl2溶液有白色沉淀生成说明溶液中含SO42-。
SO32-的检验 ①加入盐酸溶液,将产生的气体通人品红溶液中红色褪去;
②或加入BaCl2溶液生成白色沉淀,加入稀盐酸,沉淀溶解并产生具有刺激性气味的气体,通入澄清石灰水出现浑浊。
三、难点突破
(二)不用试剂鉴别一组物质的方法
1.特征现象法:先借用待鉴别物质中的特殊颜色、特殊气味、挥发出雾状气体等特征现象鉴别出个别物质再借用这种物质去鉴别其他各物质。
典型例题
【例1】不另用其他试剂鉴别NaOH、Na2SO4、FeCl3、MgCl2四种溶液。
典型例题
【例1】不另用其他试剂鉴别NaOH、Na2SO4、FeCl3、MgCl2四种溶液。
【解析】该题首先利用FeCl3溶液呈棕黄色的特征鉴别出它,再利用FeCl3与NaOH能生成红褐色沉淀的特征鉴别出NaOH溶液,再借用NaOH溶液去鉴别出MgCl2溶液,这样剩下的就是Na2SO4溶液。相应的例题有,不另用其他试剂鉴别N2、H2S、Cl2、SO3四瓶气体,可借用气体颜色、气味等方面的差异来完成鉴别。
三、难点突破
2.加热鉴别法:如果待检物质通过加热发生有特征现象的反应,如有气体放出、颜色改变、升华等,则首先可鉴别出它;再借用这一物质去鉴别其他物质,依次类推,可达刭鉴别的目的。
典型例题
【例2】不用其他试剂鉴别NH4Cl、NH4I、NaHCO3、Na2CO3四种白色固体。
典型例题
【例2】不用其他试剂鉴别NH4Cl、NH4I、NaHCO3、Na2CO3四种白色固体。
【解析】NH4Cl、NH4I受热完全分解成气体,NH4Cl的分解产物遇冷又凝结成白色晶体,NH4I分解有紫色气体放出;NaHCO3受热分解放出无色气体,还有剩余固体;Na2CO3受热无现象(或熔化)。利用各自的分解现象,只通过加热即可鉴别开来。
三、难点突破
3.列表优选法(又称相互作用判断法):不能用前两种方法鉴别的一组物质,只能利用两两反应所产生的现象判断、鉴别各物质;由于内容多、现象重复出现多,为了好比较、优选,可列出表格对比、判断。
典型例题
【例3】不另加其他试剂鉴别Na2CO3、Ba(NO3)2、Na2SO4、HCl四瓶无色溶液。
典型例题
【例3】不另加其他试剂鉴别Na2CO3、Ba(NO3)2、Na2SO4、HCl四瓶无色溶液。
【解析】把被鉴别的4种溶液编成A、B、C、D,取A、B、C、D四种溶液各少许,分别注入4支洁净的试管里.再分别滴人A,若B中产生无色气体,C中出现白色沉淀,D中无现象,则B为HCl溶液,C为Ba(NO3)2溶液。
被鉴别物质 Na2CO3 Ba(NO3)2 Na2SO4 HCl
Na2CO3 — 白色↓ — 无色↑
Ba(NO3)2 白色↓ — 白色↓ —
Na2SO4 — 白色↓ — —
HCl 无色↑ — — —
三、难点突破
4.逐一检出法:首先利用两种物质(或溶液)之间的特征反应鉴别出两种物质(或溶液),再用其中的一种或两种作试剂依次鉴别出其他的物质(或溶液)。
典型例题
【例4】不用其他试剂鉴别Na2CO3溶液、H2SO4,溶液、MgCl2溶液、KNO3溶液
典型例题
【例4】不用其他试剂鉴别Na2CO3溶液、H2SO4,溶液、MgCl2溶液、KNO3溶液
【解析】可利用逐滴加入的操作法所产生的特有现象鉴别出Na2CO3溶液和H2SO4溶液, H2SO4溶液滴入Na2CO3然后再用Na2CO3溶液区别开MgCl2溶液和KNO3溶液。在逐滴加入的操作过程中,可产生特有现象的常见物质有AlCl3(Al3+)溶液与NaOH(OH-)溶液;Na2CO3 (CO32-)溶液与H2SO4(H+)溶液;Na2S(S2-)溶液与HCl(H+)溶液;Na2SO3(SO32-)溶液与HCl(H+)溶液;AgNO3溶液与NH3·H2O溶液;H3PO4溶液与Ca(OH)2溶液;NaAlO2( AlO2-)溶液与HCl(H+)溶液。
典型例题
【例5】怎样检验一种白色固体是明矾[KAl(SO4)2·12H2O],设计实验步骤,分析可能的现象及相应结构。
典型例题
【例5】怎样检验一种白色固体是明矾[KAl(SO4)2·12H2O],设计实验步骤,分析可能的现象及相应结构。
【答案】检验步骤如下:
(1)在小烧杯中放入少量白色固体,加蒸馏水,搅拌配成稀溶液,分装于两支试管里。
(2)在第一支试管里滴加NaOH溶液直至过量,观察现象。
(3)在第二支试管里滴加BaCl2溶液和少量稀盐酸,观察现象。
(4)用一根铂丝蘸少量白色固体,做焰色反应实验,透过钻玻璃观察火焰颜色。
(5)另取少量固体在一支干燥的试管里加热,观察试管内壁的现象。
现象和结论:步骤(2)先看到白色沉淀,继续加NaOH至过量时白色沉淀溶解,证明含有Al3+。步骤(3)有白色沉淀,证明含有SO42-。步骤(4)火焰颜色是紫色.证明含有K+。步骤(5)试管内壁有冷凝水滴,证明含有结晶水。
综上,确定这一白色固体是明矾。
典型例题
【例6】CuS和Cu2S都能溶于硝酸,它们高温灼烧的产物相同,以下鉴别CuS和Cu2S两种黑色粉末的方法合理的是 ( )
(A)将两种样品分别溶于硝酸,区别所产生的气体
(B)将两种样品分别溶于硝酸,区别溶液的颜色
(C)取两种同质量的样品分别在高温下灼烧,区别残留固体的质量
(D)取两种同质量的样品分别在高温下灼烧,区别残留固体的颜色
典型例题
【例6】CuS和Cu2S都能溶于硝酸,它们高温灼烧的产物相同,以下鉴别CuS和Cu2S两种黑色粉末的方法合理的是 ( )
(A)将两种样品分别溶于硝酸,区别所产生的气体
(B)将两种样品分别溶于硝酸,区别溶液的颜色
(C)取两种同质量的样品分别在高温下灼烧,区别残留固体的质量
(D)取两种同质量的样品分别在高温下灼烧,区别残留固体的颜色
【解析】由于CuS和Cu2S高温灼烧产物相同,均为CuO和SO2,但生成的CuO的质量不同,故可采用C项确定。CuS和Cu2S均被HNO3氧化为S,有Cu(NO3)2产生,不能采用HNO3鉴别
【答案】C
下节课再见
课后练习
【练习1】(1)有两种白色固体粉末:碳酸钠与碳酸氢钠,如何用化学方法鉴别?
(2)有两种无色溶液:碳酸钠与碳酸氢钠,如何用化学方法鉴别?
(3)有一种无色溶液,可能南碳酸钠及碳酸氢钠组成,如何用化学方法检验出其中含有CO32-及HCO3-?
课后练习
【练习1】(1)有两种白色固体粉末:碳酸钠与碳酸氢钠,如何用化学方法鉴别?
(2)有两种无色溶液:碳酸钠与碳酸氢钠,如何用化学方法鉴别?
(3)有一种无色溶液,可能南碳酸钠及碳酸氢钠组成,如何用化学方法检验出其中含有CO32-及HCO3-?
【答案】(1)取两种固体粉末分别加热,若生成水滴及气体,该气体能使澄清石灰变浑浊,该样品是NaHCO3;无明显现象的样品是Na2CO3。
(2)往两种溶液中分别滴加CaCl2溶液,产生沉淀的样品是Na2CO3溶液,无沉淀的样品是NaHCO3溶液。
(3)①往样品中滴加CaCl2溶液到过量,产生白色沉淀,过滤,往沉淀中加盐酸,沉淀溶解产生无色无气味的气体,证明原样品中含CO32-。
②往滤液中加入Ca(OH)2溶液产生白色沉淀,证明原样品中含HCO3-。
课后练习
【练习2】怎样鉴别五种化肥:(NH4)2SO4、KCl、NH4Cl、NH4NO2、Ca(H2PO4)2 ?写出操作、现象及结论。
?
课后练习
【练习2】怎样鉴别五种化肥:(NH4)2SO4、KCl、NH4Cl、NH4NO2、Ca(H2PO4)2 ?写出操作、现象及结论。
【答案】取样品分别溶于适量水。按如下方法即可鉴别:
?
混合物的检验
【基础】
知识导航
一、用于检验的化学反应的特点
用于检验的化学反应,一般反应条件温和(如常温或稍加热),操作简便,并具有明显的反应现象(如颜色变化、沉淀的生成或溶解、生成气体等)。
二、物质的鉴定与鉴别
1.定义
(1)确定一种物质的成分或确定混合物中的各种成分叫做物质的鉴定。
(2)将两种或两种以上的物质一一区分开来是物质的鉴别。
二、物质的鉴定与鉴别
2.物质鉴别的一般程序与思路
首先分析被鉴别物质的性质差异,选定某种物理方法或化学方法,然后进行实验操作,最后依据实验现象的不同,确定它们各是什么物质。
鉴别时,通常将未知试样加以编号,如①号试样、②号试样……以免混淆。鉴别物质时,如有多种方法可选用,一般应选用操作简单、现象明显、实验次数较少的方法。如果试样是溶液,则可先鉴别溶液的酸、碱性。对于多种未知试样,第1次实验尽可能将它们分为两组,再分别对各组试样进行第2、3次实验。
无机物如酸、碱、盐等物质的鉴别通常采用离子检验的化学方法。
三、难点突破
(一)检验SO42-和SO32-两种离子
SO42-的检验
SO32-的检验
三、难点突破
(一)检验SO42-和SO32-两种离子
SO42的检验 ①先用盐酸溶液将溶液酸化,以排除杂质离子(SO32-、Ag+、CO32-等)干扰;
②加入BaCl2溶液有白色沉淀生成说明溶液中含SO42-。
SO32-的检验 ①加入盐酸溶液,将产生的气体通人品红溶液中红色褪去;
②或加入BaCl2溶液生成白色沉淀,加入稀盐酸,沉淀溶解并产生具有刺激性气味的气体,通入澄清石灰水出现浑浊。
三、难点突破
(二)不用试剂鉴别一组物质的方法
1.特征现象法:先借用待鉴别物质中的特殊颜色、特殊气味、挥发出雾状气体等特征现象鉴别出个别物质再借用这种物质去鉴别其他各物质。
典型例题
【例1】不另用其他试剂鉴别NaOH、Na2SO4、FeCl3、MgCl2四种溶液。
典型例题
【例1】不另用其他试剂鉴别NaOH、Na2SO4、FeCl3、MgCl2四种溶液。
【解析】该题首先利用FeCl3溶液呈棕黄色的特征鉴别出它,再利用FeCl3与NaOH能生成红褐色沉淀的特征鉴别出NaOH溶液,再借用NaOH溶液去鉴别出MgCl2溶液,这样剩下的就是Na2SO4溶液。相应的例题有,不另用其他试剂鉴别N2、H2S、Cl2、SO3四瓶气体,可借用气体颜色、气味等方面的差异来完成鉴别。
三、难点突破
2.加热鉴别法:如果待检物质通过加热发生有特征现象的反应,如有气体放出、颜色改变、升华等,则首先可鉴别出它;再借用这一物质去鉴别其他物质,依次类推,可达刭鉴别的目的。
典型例题
【例2】不用其他试剂鉴别NH4Cl、NH4I、NaHCO3、Na2CO3四种白色固体。
典型例题
【例2】不用其他试剂鉴别NH4Cl、NH4I、NaHCO3、Na2CO3四种白色固体。
【解析】NH4Cl、NH4I受热完全分解成气体,NH4Cl的分解产物遇冷又凝结成白色晶体,NH4I分解有紫色气体放出;NaHCO3受热分解放出无色气体,还有剩余固体;Na2CO3受热无现象(或熔化)。利用各自的分解现象,只通过加热即可鉴别开来。
三、难点突破
3.列表优选法(又称相互作用判断法):不能用前两种方法鉴别的一组物质,只能利用两两反应所产生的现象判断、鉴别各物质;由于内容多、现象重复出现多,为了好比较、优选,可列出表格对比、判断。
典型例题
【例3】不另加其他试剂鉴别Na2CO3、Ba(NO3)2、Na2SO4、HCl四瓶无色溶液。
典型例题
【例3】不另加其他试剂鉴别Na2CO3、Ba(NO3)2、Na2SO4、HCl四瓶无色溶液。
【解析】把被鉴别的4种溶液编成A、B、C、D,取A、B、C、D四种溶液各少许,分别注入4支洁净的试管里.再分别滴人A,若B中产生无色气体,C中出现白色沉淀,D中无现象,则B为HCl溶液,C为Ba(NO3)2溶液。
被鉴别物质 Na2CO3 Ba(NO3)2 Na2SO4 HCl
Na2CO3 — 白色↓ — 无色↑
Ba(NO3)2 白色↓ — 白色↓ —
Na2SO4 — 白色↓ — —
HCl 无色↑ — — —
三、难点突破
4.逐一检出法:首先利用两种物质(或溶液)之间的特征反应鉴别出两种物质(或溶液),再用其中的一种或两种作试剂依次鉴别出其他的物质(或溶液)。
典型例题
【例4】不用其他试剂鉴别Na2CO3溶液、H2SO4,溶液、MgCl2溶液、KNO3溶液
典型例题
【例4】不用其他试剂鉴别Na2CO3溶液、H2SO4,溶液、MgCl2溶液、KNO3溶液
【解析】可利用逐滴加入的操作法所产生的特有现象鉴别出Na2CO3溶液和H2SO4溶液, H2SO4溶液滴入Na2CO3然后再用Na2CO3溶液区别开MgCl2溶液和KNO3溶液。在逐滴加入的操作过程中,可产生特有现象的常见物质有AlCl3(Al3+)溶液与NaOH(OH-)溶液;Na2CO3 (CO32-)溶液与H2SO4(H+)溶液;Na2S(S2-)溶液与HCl(H+)溶液;Na2SO3(SO32-)溶液与HCl(H+)溶液;AgNO3溶液与NH3·H2O溶液;H3PO4溶液与Ca(OH)2溶液;NaAlO2( AlO2-)溶液与HCl(H+)溶液。
典型例题
【例5】怎样检验一种白色固体是明矾[KAl(SO4)2·12H2O],设计实验步骤,分析可能的现象及相应结构。
典型例题
【例5】怎样检验一种白色固体是明矾[KAl(SO4)2·12H2O],设计实验步骤,分析可能的现象及相应结构。
【答案】检验步骤如下:
(1)在小烧杯中放入少量白色固体,加蒸馏水,搅拌配成稀溶液,分装于两支试管里。
(2)在第一支试管里滴加NaOH溶液直至过量,观察现象。
(3)在第二支试管里滴加BaCl2溶液和少量稀盐酸,观察现象。
(4)用一根铂丝蘸少量白色固体,做焰色反应实验,透过钻玻璃观察火焰颜色。
(5)另取少量固体在一支干燥的试管里加热,观察试管内壁的现象。
现象和结论:步骤(2)先看到白色沉淀,继续加NaOH至过量时白色沉淀溶解,证明含有Al3+。步骤(3)有白色沉淀,证明含有SO42-。步骤(4)火焰颜色是紫色.证明含有K+。步骤(5)试管内壁有冷凝水滴,证明含有结晶水。
综上,确定这一白色固体是明矾。
典型例题
【例6】CuS和Cu2S都能溶于硝酸,它们高温灼烧的产物相同,以下鉴别CuS和Cu2S两种黑色粉末的方法合理的是 ( )
(A)将两种样品分别溶于硝酸,区别所产生的气体
(B)将两种样品分别溶于硝酸,区别溶液的颜色
(C)取两种同质量的样品分别在高温下灼烧,区别残留固体的质量
(D)取两种同质量的样品分别在高温下灼烧,区别残留固体的颜色
典型例题
【例6】CuS和Cu2S都能溶于硝酸,它们高温灼烧的产物相同,以下鉴别CuS和Cu2S两种黑色粉末的方法合理的是 ( )
(A)将两种样品分别溶于硝酸,区别所产生的气体
(B)将两种样品分别溶于硝酸,区别溶液的颜色
(C)取两种同质量的样品分别在高温下灼烧,区别残留固体的质量
(D)取两种同质量的样品分别在高温下灼烧,区别残留固体的颜色
【解析】由于CuS和Cu2S高温灼烧产物相同,均为CuO和SO2,但生成的CuO的质量不同,故可采用C项确定。CuS和Cu2S均被HNO3氧化为S,有Cu(NO3)2产生,不能采用HNO3鉴别
【答案】C
下节课再见
课后练习
【练习1】(1)有两种白色固体粉末:碳酸钠与碳酸氢钠,如何用化学方法鉴别?
(2)有两种无色溶液:碳酸钠与碳酸氢钠,如何用化学方法鉴别?
(3)有一种无色溶液,可能南碳酸钠及碳酸氢钠组成,如何用化学方法检验出其中含有CO32-及HCO3-?
课后练习
【练习1】(1)有两种白色固体粉末:碳酸钠与碳酸氢钠,如何用化学方法鉴别?
(2)有两种无色溶液:碳酸钠与碳酸氢钠,如何用化学方法鉴别?
(3)有一种无色溶液,可能南碳酸钠及碳酸氢钠组成,如何用化学方法检验出其中含有CO32-及HCO3-?
【答案】(1)取两种固体粉末分别加热,若生成水滴及气体,该气体能使澄清石灰变浑浊,该样品是NaHCO3;无明显现象的样品是Na2CO3。
(2)往两种溶液中分别滴加CaCl2溶液,产生沉淀的样品是Na2CO3溶液,无沉淀的样品是NaHCO3溶液。
(3)①往样品中滴加CaCl2溶液到过量,产生白色沉淀,过滤,往沉淀中加盐酸,沉淀溶解产生无色无气味的气体,证明原样品中含CO32-。
②往滤液中加入Ca(OH)2溶液产生白色沉淀,证明原样品中含HCO3-。
课后练习
【练习2】怎样鉴别五种化肥:(NH4)2SO4、KCl、NH4Cl、NH4NO2、Ca(H2PO4)2 ?写出操作、现象及结论。
?
课后练习
【练习2】怎样鉴别五种化肥:(NH4)2SO4、KCl、NH4Cl、NH4NO2、Ca(H2PO4)2 ?写出操作、现象及结论。
【答案】取样品分别溶于适量水。按如下方法即可鉴别:
?
