广东省廉江市实验学校人教版高中化学必修一2.3 氧化还原反应-课件 (共62张PPT)
文档属性
| 名称 | 广东省廉江市实验学校人教版高中化学必修一2.3 氧化还原反应-课件 (共62张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 41.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-05-21 00:00:00 | ||
图片预览









文档简介
(共62张PPT)
氧化还原反应
目标
氧化还原反应的概念
01
氧化反应和还原反应
02
氧化还原反应的本质
03
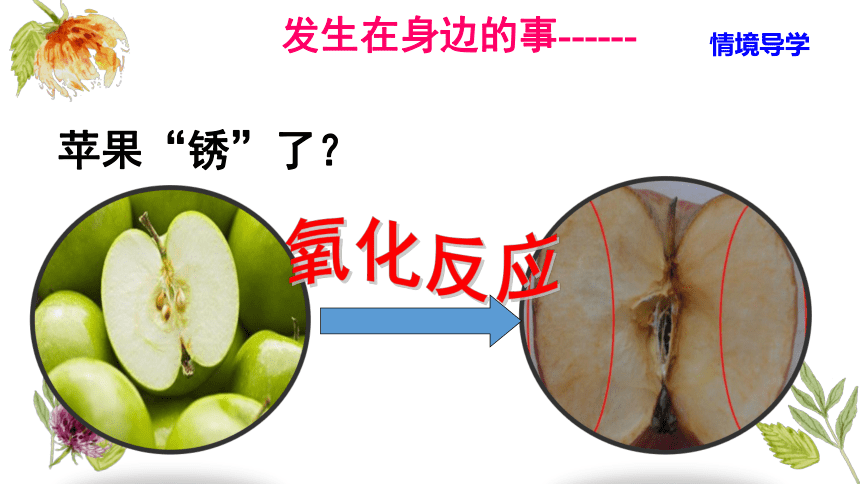
苹果“锈”了?
氧化反应
发生在身边的事------
情境导学
铁锁锈了?
氧化反应
Fe Fe2O3
情境导学
铁矿石
美国高中教材《化学概念与应用》对还原反应(reduction reaction)是这样描述的:早期科学家因金属矿石中与金属结合的氧被移除了,金属矿石因此被还原成金属单质,称还原反应(有减轻、减少之意)。
还原反应
发生在身边的事------
情境导学
铸铁
Fe2O3 Fe
氧化反应:物质得到
氧的反应
A
还原反应:物质失去
氧的反应
B
早期结论:有得失氧的反应就是氧化还原反应。
分类的依据:得氧或失氧角度
Fe2O3 + 3CO = 2Fe + 3CO2
从Fe2O3来看是 反应
从CO来看是 反应
氧化反应和还原反应是同时进行的,这样的反应称为氧化还原反应。
高温
氧化
还原
从得氧失氧角度分析氧化还原反应
活学活用
完成下列反应的方程式,并思考元素的化合价有什么变化?
(1)一氧化碳还原氧化铜
(2)氢气还原氧化铜
(3)碳与水高温下的反应
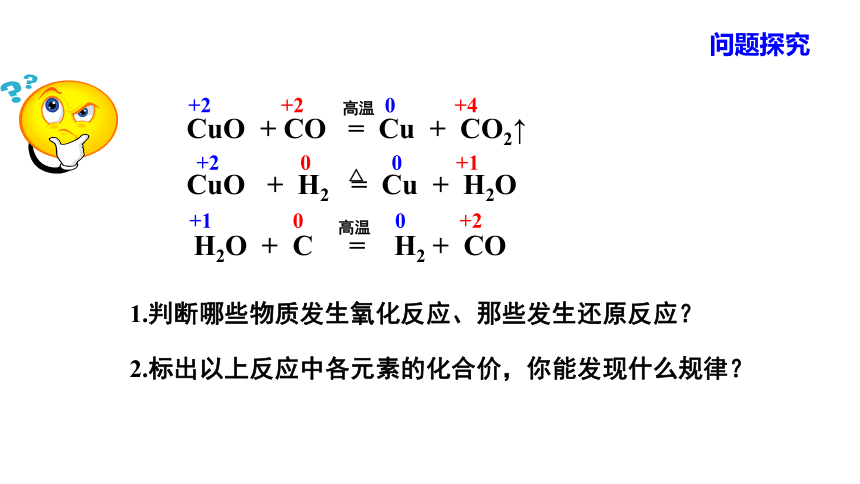
问题探究
+1 0 0 +2
+2 0 0 +1
+2 +2 0 +4
CuO + CO = Cu + CO2↑
CuO + H2 = Cu + H2O
H2O + C = H2 + CO
高温
高温
△
2.标出以上反应中各元素的化合价,你能发现什么规律?
1.判断哪些物质发生氧化反应、那些发生还原反应?
问题探究
氧化反应:物质所含元素化合价升高的反应
还原反应:物质所含元素化合价降低的反应
氧化还原反应:凡是有元素化合价升降的化学反应
从化合价角度分析氧化还原反应
总结感悟
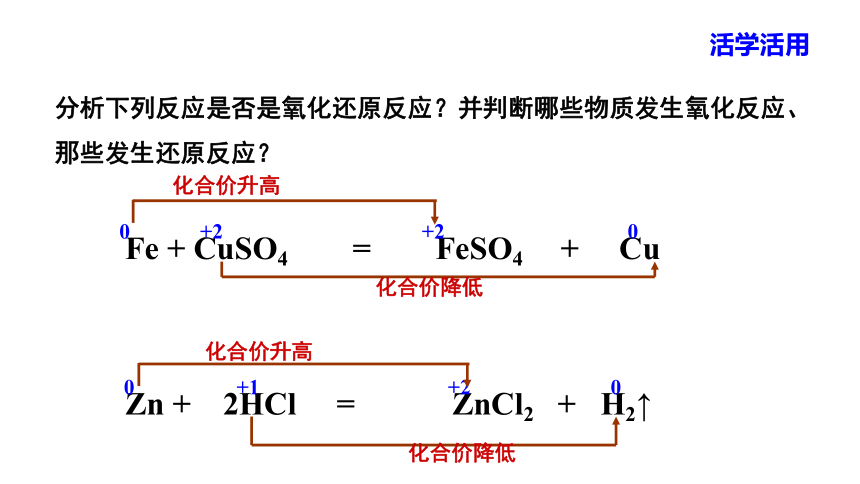
Fe + CuSO4 = FeSO4 + Cu
Zn + 2HCl = ZnCl2 + H2↑
分析下列反应是否是氧化还原反应?并判断哪些物质发生氧化反应、那些发生还原反应?
0 +2 +2 0
化合价升高
化合价降低
0 +1 +2 0
化合价升高
化合价降低
活学活用
1.只有得氧、失氧的反应才是氧化还原反应
2.元素化合价发生变化的反应一定是氧化还原反应
×
√
氧化还原反应的特征:元素化合价变化
问题探究
判断下列反应是否是氧化还原反应?
2H2 + O2 = 2H2O
2. CaO + H2O = Ca(OH)2
3. 2KMnO4 = K2MnO4 + MnO2 + O2↑
4. CaCO3 = CO2↑ + CaO
5. Fe + H2SO4 = FeSO4 + H2↑
6. Cu + 2AgNO3 = Cu(NO3)2 + 2Ag
7. Ba(OH)2 + H2SO4= BaSO4↓+ 2H2O
8. CaCl2 + Na2CO3 = CaCO3↓ + 2NaCl
点燃
△
△
√
√
√
√
×
×
×
×
活学活用
氧化还原反应中元素化合价变化的原因?
问题导学
金属钠在氯气中燃烧
实验探究
1.该反应中发生反应的微粒是什么?
2.NaCl中存在的微粒是什么?
3.它们是如何转化的?
(请阅读书36页)
现象解读
稀有气体原子结构示意图
【电子转移动机:达到稳定结构】
He
+2
2
Ne
+10
2
8
Ar
+18
2
8
8
稀有气体比较稳定的原因:原子最外层电子数为2(最外层为第1层)或8(最外层为其它层)。
因此,当原子的最外层电子数为2或8时就达到了稳定结构。
科学现象
Na+ Cl-
化合价升降原因之一
电子的得失
Na
Cl
+11
2
8
1
2
8
7
+17
e-
Cl-
Na+
+11
2
8
2
8
8
+17
动画模拟
H Cl
H Cl
+1 -1
化合价升降原因之二
共用电子对的偏移
延伸:
2
8
7
+17
+1
1
H
Cl
动画模拟
电子的转移(得失或偏移) 是元素化合价发生变化的原因,
这也是氧化还原反应的本质。
结论
总结感悟
失去2×e-电子,化合价升高,被氧化
2Na + Cl2 = 2NaCl
点燃
0 0 +1 -1
得到2×e-电子,化合价降低,被还原
失去电子
得到电子
失电子
Na元素化合价升高
发生氧化反应
得电子
Cl元素化合价降低
发生还原反应
被氧化
被还原
分析
总结感悟
Zn
Cu
CuSO4
有电流通过
电子的定向移动
*电流是怎么产生的?
*写出反应方程式,分析电子转移情况。
*电流表指针为什么会偏转?
Zn + CuSO4 = ZnSO4 + Cu
0 +2 +2 0
失去2×e-电子,化合价升高,被氧化
得到1×2e-电子,化合价降低,被还原
实验探究
电子
电子
氧化反应
失去电子(电子对偏离)
化合价升高
还原反应
得到电子(电子对偏向)
化合价降低
氧化还原的本质是电子的转移
动画模拟
从元素化合价升降的角度认识氧化还原反应
知识回顾:
化合价的变化与氧化反应、还原反应之间有怎样的关系?
规律小结:
化合价升高,被 (氧化/还原),发生 反应;
化合价降低,被 (氧化/还原),发生 反应;
氧化
还原
还原
氧化
升氧降还
__________
氧化还原反应与四种基本反应类型的关系提示:用数学“维恩图”或“交叉分类法” 表示
问题探究
氧化还原反应
分解反应
化合反应
置换反应
复分解反应
判断下列反应是否是氧化还原反应?
2H2 + O2 = 2H2O
2. CaO + H2O = Ca(OH)2
3. 2KMnO4 = K2MnO4 + MnO2 + O2↑
4. CaCO3 = CO2↑ + CaO
5. Fe + H2SO4 = FeSO4 + H2↑
6. Cu + 2AgNO3 = Cu(NO3)2 + 2Ag
7. Ba(OH)2 + H2SO4= BaSO4↓+ 2H2O
8. CaCl2 + Na2CO3 = CaCO3↓ + 2NaCl
点燃
△
△
√
√
√
√
×
×
×
×
活学活用
置换反应
复分解反应
化合反应
分解反应
化学反应
氧化还原反应
非氧化还原反应
问题探究
复分解反应
置换反应
化合反应
分解反应
氧化还原反应
非氧化还原反应
交叉分类法
问题探究
生活化学
生活化学
生活化学
生活化学
火箭的升空,需要燃料的燃烧。燃料燃烧过程中伴随着很多化学变化和物理变化,伴随着许多能量的转化。
—氧化还原反应
生活化学
2.下列反应中,不属于四种基本反应类型,也不属于氧化还原反应的是( )
A.2Na + 2H2O = 2NaOH + H2↑
B.CO2 + Ca(OH)2 = CaCO3↓ + H2O
C.2H2O2 = 2H2O + O2↑
D.CaCO3+2HCl = CaCl2+H2O+CO2↑
B
当堂巩固
终极检测
1.成语是中华民族灿烂文化中的瑰宝,许多成语中蕴含着丰富的化学原理,下列成语中涉及氧化还原反应的是( )
A.铁杵成针
B. 抱薪救火
C. 闭门造车
D. 刻舟求剑
B
CuO+H2==Cu+H2O
高温
0
+2
+1
0
化合价降低,得电子,还原反应,被还原
化合价升高,失电子,氧化反应,被氧化
氧化剂
还原剂
氧化剂:得到电子(电子对偏向)的物质。(具有氧化性)
在化学反应中元素化合价降低的反应物
还原剂:失去电子(电子对偏离)的物质。(具有还原性)
在化学反应中元素化合价升高的反应物
氧化剂和还原剂
小结:
氧化剂
还原剂
氧化
反应
化合价升高
失e-
化合价降低
得e-
还原反应
还原产物
反应物
被氧化
被还原
氧化产物
生成物
实质
特征
氧化剂 + 还原剂 = 还原产物 + 氧化产物
2、氧化产物和还原产物
氧化产物:氧化后的生成物
还原产物:还原后的生成物
CuO + H2 == Cu + H2O
0
+2
+1
0
(氧化剂)(还原剂) (还原产物)(氧化产物)
化合价降低,得到电子,还原反应,被还原
化合价升高,失去电子,氧化反应,被氧化
练习:指出下列氧化剂与还原剂,氧化产物与还原产物
1. Fe+H2SO4(稀)=FeSO4+H2↑
2、2KMnO4 = K2MnO4 + O2↑+ MnO2
3、2H2S + SO2 = 3S↓ + 2H2O
△
还原剂
氧化剂
氧化剂和还原剂
还原剂
氧化剂
氧化产物
还原产物
氧化产物
氧化产物
还原产物
氧化产物和还原产物
苹果汁是人们喜欢的饮料,由于此饮料中含有Fe2+,现榨的苹果汁在空气中会由淡绿色变为棕黄色。若榨汁时加入维生素C,可有效防止这种现象发生,说明维生素C具有
(A)氧化性 (B)还原性
(C)碱性 (D)酸性
√
3. 常见的氧化剂和还原剂:
①活泼的非金属单质如:卤素单质 (Cl2、Br2、I2)、 O2、S等。
②高价金属阳离子如:Fe3+、Cu2+等。
③高价或较高价含氧化合物如:MnO2、浓H2SO4、HNO3、KMnO4。
常见氧化剂
①活泼或较活泼的金属:如K、Na、Al、Fe等。
②一些非金属单质:如H2、C、Si等。
③较低态的化合物:CO、SO2、H2S、KI等。
常见还原剂
三、电子转移的表示方法
双线桥法和单线桥法
CuO+H2==Cu+H2O
+2
0
0
+1
得到2e-
失去1e-×2
(1)用双线桥分析氧化还原反应
注 意
1、双箭号跨过等号,从反应物指向生成物,起止为同一元素
2、 线上标明失去或得到电子的数,得或失两字不能省略
反应过程中共转移多少电子?
氧化剂___________ 还原剂___________
氧化产物__________ 还原产物_________
转移的电子数____________
CuSO4
Fe
FeSO4
Cu
2e-
0
+2
+2
0
失2e-
得2e-
练习
用双线桥表示下列氧化还原反应电子转移情况。
MnO2 + 4 HCl = MnCl2 + Cl2 + 2H2O
SO2 + 2H2S == 2H2O + 3S
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO↑ + 4H2O
2H2S + SO2 = 3S↓ + 2H2O
温故
知新:
双线桥法可以清晰的看到得失电子数相等,那么我们可以用来配平方程式吗?
C + HNO3—— NO2↑+ CO2 ↑ + H2O
双线桥法可以看出反应前后同一种元素原子间的电子转移情况,而在化学研究中,很多时候只需要知道反应前后元素原子的电子之间转移情况即可,可以使用单线桥法清晰明了地表示。
单线桥法:
2、箭号不跨过等号,起点为失电子元素,终点为得电子元素。
1、 只标电子转移总数,不标“得”与“失”。
注 意
2e-
MnO2 + 4 HCl = MnCl2 + Cl2 + 2H2O
+4
+2
-1
0
2H2S + SO2 = 3S↓ + 2H2O
用单线桥法表示电子转移情况
2KClO3 △ 2KCl + 3O2↑
小试菜刀
Cl2+NaOH=NaCl+NaClO+H2O
小试牛刀
4FeS2 + 11O2 = 8SO2 + 2Fe2O3
挑战自我
氧化性和还原性的强弱比较
1.根据根据氧化还原方程式来判断:
氧化性:氧化剂>氧化产物>还原产物>还原剂
还原性:还原剂>还原产物>氧化产物>氧化剂
2KI+Cl2 = 2KCl+I2
还原剂
例1:
氧化剂
还原产物
氧化产物
氧化性:氧化剂>氧化产物>还原产物>还原剂
氧化性:Cl2>I2>KCl>KI
已知常温下在溶液中可发生如下两个离子反应:
Ce4++Fe2+ Fe3++Ce3+
Sn2++2Fe3+ 2Fe2++Sn4+
由此可以确定Fe2+、Ce3+、Sn2+三种离子的还原性由强到弱的顺序是( )
A.Sn2+、Fe2+、Ce3+ B.Sn2+、Ce3+、Fe2+
C.Ce3+、Fe2+、Sn2+ D.Fe2+、Sn2+、Ce3+
变式训练1
2、根据金属活动性顺序表判断
单质还原性逐渐减弱
阳离子氧化性逐渐增强
3.根据反应的难易判断
不同的氧化剂与同一种还原剂反应,反应越容易,说明氧化剂的氧化性越强;不同的还原剂与同一种氧化剂反应,反应越容易,说明还原剂的还原性越强。
16HCl(浓)+2KMnO4=2KCl+2MnCl2+8H2O+5Cl2
4HCl(浓)+MnO2==MnCl2+2H2O+Cl2
4HCl(浓)+O2===2H2O+2Cl2
△
催化剂,500℃
C(石墨)+O2===CO2
C(金刚石)+O2===CO2
4827℃,催化剂
(几乎不燃烧)
小结:
1、氧化性:氧化剂>氧化产物>还原产物>还原剂
2、根据金属活动性顺序表判断
3.根据反应的难易判断
在上述反应中,当有1molCl2生成时,有 molHCl被氧化,MnO2得到 mol电子,反应中共转
移了 mol电子。被氧化的元素与被还原的元素的物质的量之比 氧化产物与还原产物的物质的
量之比
练习
MnO2 + 4HCl(浓)△ MnCl2 + Cl2↑+ 2H2O
2H2S + SO2 = 3S↓ + 2H2O
当有1.5molS生成时,有 molH2S 被氧化,SO2得到 mol电子,反应中共转移了 mol电子。
当有1molO2生成时,有 molKClO3被氧化,有
molKClO3被还原,反应中共转移了 mol电子。
2KClO3 △ 2KCl + 3O2↑
课堂小结
一、氧化剂与还原剂
氧化剂:得到电子(电子对偏向)的物质。(具有氧化性)
在化学反应中元素化合价降低的反应物
还原剂:失去电子(电子对偏离)的物质。(具有还原性)
在化学反应中元素化合价升高的反应物
二、氧化产物与还原产物
三、双线桥与单线桥法表示电子转移
四、常见的氧化剂与还原剂
谢谢
观看
氧化还原反应
目标
氧化还原反应的概念
01
氧化反应和还原反应
02
氧化还原反应的本质
03
苹果“锈”了?
氧化反应
发生在身边的事------
情境导学
铁锁锈了?
氧化反应
Fe Fe2O3
情境导学
铁矿石
美国高中教材《化学概念与应用》对还原反应(reduction reaction)是这样描述的:早期科学家因金属矿石中与金属结合的氧被移除了,金属矿石因此被还原成金属单质,称还原反应(有减轻、减少之意)。
还原反应
发生在身边的事------
情境导学
铸铁
Fe2O3 Fe
氧化反应:物质得到
氧的反应
A
还原反应:物质失去
氧的反应
B
早期结论:有得失氧的反应就是氧化还原反应。
分类的依据:得氧或失氧角度
Fe2O3 + 3CO = 2Fe + 3CO2
从Fe2O3来看是 反应
从CO来看是 反应
氧化反应和还原反应是同时进行的,这样的反应称为氧化还原反应。
高温
氧化
还原
从得氧失氧角度分析氧化还原反应
活学活用
完成下列反应的方程式,并思考元素的化合价有什么变化?
(1)一氧化碳还原氧化铜
(2)氢气还原氧化铜
(3)碳与水高温下的反应
问题探究
+1 0 0 +2
+2 0 0 +1
+2 +2 0 +4
CuO + CO = Cu + CO2↑
CuO + H2 = Cu + H2O
H2O + C = H2 + CO
高温
高温
△
2.标出以上反应中各元素的化合价,你能发现什么规律?
1.判断哪些物质发生氧化反应、那些发生还原反应?
问题探究
氧化反应:物质所含元素化合价升高的反应
还原反应:物质所含元素化合价降低的反应
氧化还原反应:凡是有元素化合价升降的化学反应
从化合价角度分析氧化还原反应
总结感悟
Fe + CuSO4 = FeSO4 + Cu
Zn + 2HCl = ZnCl2 + H2↑
分析下列反应是否是氧化还原反应?并判断哪些物质发生氧化反应、那些发生还原反应?
0 +2 +2 0
化合价升高
化合价降低
0 +1 +2 0
化合价升高
化合价降低
活学活用
1.只有得氧、失氧的反应才是氧化还原反应
2.元素化合价发生变化的反应一定是氧化还原反应
×
√
氧化还原反应的特征:元素化合价变化
问题探究
判断下列反应是否是氧化还原反应?
2H2 + O2 = 2H2O
2. CaO + H2O = Ca(OH)2
3. 2KMnO4 = K2MnO4 + MnO2 + O2↑
4. CaCO3 = CO2↑ + CaO
5. Fe + H2SO4 = FeSO4 + H2↑
6. Cu + 2AgNO3 = Cu(NO3)2 + 2Ag
7. Ba(OH)2 + H2SO4= BaSO4↓+ 2H2O
8. CaCl2 + Na2CO3 = CaCO3↓ + 2NaCl
点燃
△
△
√
√
√
√
×
×
×
×
活学活用
氧化还原反应中元素化合价变化的原因?
问题导学
金属钠在氯气中燃烧
实验探究
1.该反应中发生反应的微粒是什么?
2.NaCl中存在的微粒是什么?
3.它们是如何转化的?
(请阅读书36页)
现象解读
稀有气体原子结构示意图
【电子转移动机:达到稳定结构】
He
+2
2
Ne
+10
2
8
Ar
+18
2
8
8
稀有气体比较稳定的原因:原子最外层电子数为2(最外层为第1层)或8(最外层为其它层)。
因此,当原子的最外层电子数为2或8时就达到了稳定结构。
科学现象
Na+ Cl-
化合价升降原因之一
电子的得失
Na
Cl
+11
2
8
1
2
8
7
+17
e-
Cl-
Na+
+11
2
8
2
8
8
+17
动画模拟
H Cl
H Cl
+1 -1
化合价升降原因之二
共用电子对的偏移
延伸:
2
8
7
+17
+1
1
H
Cl
动画模拟
电子的转移(得失或偏移) 是元素化合价发生变化的原因,
这也是氧化还原反应的本质。
结论
总结感悟
失去2×e-电子,化合价升高,被氧化
2Na + Cl2 = 2NaCl
点燃
0 0 +1 -1
得到2×e-电子,化合价降低,被还原
失去电子
得到电子
失电子
Na元素化合价升高
发生氧化反应
得电子
Cl元素化合价降低
发生还原反应
被氧化
被还原
分析
总结感悟
Zn
Cu
CuSO4
有电流通过
电子的定向移动
*电流是怎么产生的?
*写出反应方程式,分析电子转移情况。
*电流表指针为什么会偏转?
Zn + CuSO4 = ZnSO4 + Cu
0 +2 +2 0
失去2×e-电子,化合价升高,被氧化
得到1×2e-电子,化合价降低,被还原
实验探究
电子
电子
氧化反应
失去电子(电子对偏离)
化合价升高
还原反应
得到电子(电子对偏向)
化合价降低
氧化还原的本质是电子的转移
动画模拟
从元素化合价升降的角度认识氧化还原反应
知识回顾:
化合价的变化与氧化反应、还原反应之间有怎样的关系?
规律小结:
化合价升高,被 (氧化/还原),发生 反应;
化合价降低,被 (氧化/还原),发生 反应;
氧化
还原
还原
氧化
升氧降还
__________
氧化还原反应与四种基本反应类型的关系提示:用数学“维恩图”或“交叉分类法” 表示
问题探究
氧化还原反应
分解反应
化合反应
置换反应
复分解反应
判断下列反应是否是氧化还原反应?
2H2 + O2 = 2H2O
2. CaO + H2O = Ca(OH)2
3. 2KMnO4 = K2MnO4 + MnO2 + O2↑
4. CaCO3 = CO2↑ + CaO
5. Fe + H2SO4 = FeSO4 + H2↑
6. Cu + 2AgNO3 = Cu(NO3)2 + 2Ag
7. Ba(OH)2 + H2SO4= BaSO4↓+ 2H2O
8. CaCl2 + Na2CO3 = CaCO3↓ + 2NaCl
点燃
△
△
√
√
√
√
×
×
×
×
活学活用
置换反应
复分解反应
化合反应
分解反应
化学反应
氧化还原反应
非氧化还原反应
问题探究
复分解反应
置换反应
化合反应
分解反应
氧化还原反应
非氧化还原反应
交叉分类法
问题探究
生活化学
生活化学
生活化学
生活化学
火箭的升空,需要燃料的燃烧。燃料燃烧过程中伴随着很多化学变化和物理变化,伴随着许多能量的转化。
—氧化还原反应
生活化学
2.下列反应中,不属于四种基本反应类型,也不属于氧化还原反应的是( )
A.2Na + 2H2O = 2NaOH + H2↑
B.CO2 + Ca(OH)2 = CaCO3↓ + H2O
C.2H2O2 = 2H2O + O2↑
D.CaCO3+2HCl = CaCl2+H2O+CO2↑
B
当堂巩固
终极检测
1.成语是中华民族灿烂文化中的瑰宝,许多成语中蕴含着丰富的化学原理,下列成语中涉及氧化还原反应的是( )
A.铁杵成针
B. 抱薪救火
C. 闭门造车
D. 刻舟求剑
B
CuO+H2==Cu+H2O
高温
0
+2
+1
0
化合价降低,得电子,还原反应,被还原
化合价升高,失电子,氧化反应,被氧化
氧化剂
还原剂
氧化剂:得到电子(电子对偏向)的物质。(具有氧化性)
在化学反应中元素化合价降低的反应物
还原剂:失去电子(电子对偏离)的物质。(具有还原性)
在化学反应中元素化合价升高的反应物
氧化剂和还原剂
小结:
氧化剂
还原剂
氧化
反应
化合价升高
失e-
化合价降低
得e-
还原反应
还原产物
反应物
被氧化
被还原
氧化产物
生成物
实质
特征
氧化剂 + 还原剂 = 还原产物 + 氧化产物
2、氧化产物和还原产物
氧化产物:氧化后的生成物
还原产物:还原后的生成物
CuO + H2 == Cu + H2O
0
+2
+1
0
(氧化剂)(还原剂) (还原产物)(氧化产物)
化合价降低,得到电子,还原反应,被还原
化合价升高,失去电子,氧化反应,被氧化
练习:指出下列氧化剂与还原剂,氧化产物与还原产物
1. Fe+H2SO4(稀)=FeSO4+H2↑
2、2KMnO4 = K2MnO4 + O2↑+ MnO2
3、2H2S + SO2 = 3S↓ + 2H2O
△
还原剂
氧化剂
氧化剂和还原剂
还原剂
氧化剂
氧化产物
还原产物
氧化产物
氧化产物
还原产物
氧化产物和还原产物
苹果汁是人们喜欢的饮料,由于此饮料中含有Fe2+,现榨的苹果汁在空气中会由淡绿色变为棕黄色。若榨汁时加入维生素C,可有效防止这种现象发生,说明维生素C具有
(A)氧化性 (B)还原性
(C)碱性 (D)酸性
√
3. 常见的氧化剂和还原剂:
①活泼的非金属单质如:卤素单质 (Cl2、Br2、I2)、 O2、S等。
②高价金属阳离子如:Fe3+、Cu2+等。
③高价或较高价含氧化合物如:MnO2、浓H2SO4、HNO3、KMnO4。
常见氧化剂
①活泼或较活泼的金属:如K、Na、Al、Fe等。
②一些非金属单质:如H2、C、Si等。
③较低态的化合物:CO、SO2、H2S、KI等。
常见还原剂
三、电子转移的表示方法
双线桥法和单线桥法
CuO+H2==Cu+H2O
+2
0
0
+1
得到2e-
失去1e-×2
(1)用双线桥分析氧化还原反应
注 意
1、双箭号跨过等号,从反应物指向生成物,起止为同一元素
2、 线上标明失去或得到电子的数,得或失两字不能省略
反应过程中共转移多少电子?
氧化剂___________ 还原剂___________
氧化产物__________ 还原产物_________
转移的电子数____________
CuSO4
Fe
FeSO4
Cu
2e-
0
+2
+2
0
失2e-
得2e-
练习
用双线桥表示下列氧化还原反应电子转移情况。
MnO2 + 4 HCl = MnCl2 + Cl2 + 2H2O
SO2 + 2H2S == 2H2O + 3S
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO↑ + 4H2O
2H2S + SO2 = 3S↓ + 2H2O
温故
知新:
双线桥法可以清晰的看到得失电子数相等,那么我们可以用来配平方程式吗?
C + HNO3—— NO2↑+ CO2 ↑ + H2O
双线桥法可以看出反应前后同一种元素原子间的电子转移情况,而在化学研究中,很多时候只需要知道反应前后元素原子的电子之间转移情况即可,可以使用单线桥法清晰明了地表示。
单线桥法:
2、箭号不跨过等号,起点为失电子元素,终点为得电子元素。
1、 只标电子转移总数,不标“得”与“失”。
注 意
2e-
MnO2 + 4 HCl = MnCl2 + Cl2 + 2H2O
+4
+2
-1
0
2H2S + SO2 = 3S↓ + 2H2O
用单线桥法表示电子转移情况
2KClO3 △ 2KCl + 3O2↑
小试菜刀
Cl2+NaOH=NaCl+NaClO+H2O
小试牛刀
4FeS2 + 11O2 = 8SO2 + 2Fe2O3
挑战自我
氧化性和还原性的强弱比较
1.根据根据氧化还原方程式来判断:
氧化性:氧化剂>氧化产物>还原产物>还原剂
还原性:还原剂>还原产物>氧化产物>氧化剂
2KI+Cl2 = 2KCl+I2
还原剂
例1:
氧化剂
还原产物
氧化产物
氧化性:氧化剂>氧化产物>还原产物>还原剂
氧化性:Cl2>I2>KCl>KI
已知常温下在溶液中可发生如下两个离子反应:
Ce4++Fe2+ Fe3++Ce3+
Sn2++2Fe3+ 2Fe2++Sn4+
由此可以确定Fe2+、Ce3+、Sn2+三种离子的还原性由强到弱的顺序是( )
A.Sn2+、Fe2+、Ce3+ B.Sn2+、Ce3+、Fe2+
C.Ce3+、Fe2+、Sn2+ D.Fe2+、Sn2+、Ce3+
变式训练1
2、根据金属活动性顺序表判断
单质还原性逐渐减弱
阳离子氧化性逐渐增强
3.根据反应的难易判断
不同的氧化剂与同一种还原剂反应,反应越容易,说明氧化剂的氧化性越强;不同的还原剂与同一种氧化剂反应,反应越容易,说明还原剂的还原性越强。
16HCl(浓)+2KMnO4=2KCl+2MnCl2+8H2O+5Cl2
4HCl(浓)+MnO2==MnCl2+2H2O+Cl2
4HCl(浓)+O2===2H2O+2Cl2
△
催化剂,500℃
C(石墨)+O2===CO2
C(金刚石)+O2===CO2
4827℃,催化剂
(几乎不燃烧)
小结:
1、氧化性:氧化剂>氧化产物>还原产物>还原剂
2、根据金属活动性顺序表判断
3.根据反应的难易判断
在上述反应中,当有1molCl2生成时,有 molHCl被氧化,MnO2得到 mol电子,反应中共转
移了 mol电子。被氧化的元素与被还原的元素的物质的量之比 氧化产物与还原产物的物质的
量之比
练习
MnO2 + 4HCl(浓)△ MnCl2 + Cl2↑+ 2H2O
2H2S + SO2 = 3S↓ + 2H2O
当有1.5molS生成时,有 molH2S 被氧化,SO2得到 mol电子,反应中共转移了 mol电子。
当有1molO2生成时,有 molKClO3被氧化,有
molKClO3被还原,反应中共转移了 mol电子。
2KClO3 △ 2KCl + 3O2↑
课堂小结
一、氧化剂与还原剂
氧化剂:得到电子(电子对偏向)的物质。(具有氧化性)
在化学反应中元素化合价降低的反应物
还原剂:失去电子(电子对偏离)的物质。(具有还原性)
在化学反应中元素化合价升高的反应物
二、氧化产物与还原产物
三、双线桥与单线桥法表示电子转移
四、常见的氧化剂与还原剂
谢谢
观看
