苏教版高二化学选修 有机化学基础专题4 第二单元 醇 酚(共34张PPT)
文档属性
| 名称 | 苏教版高二化学选修 有机化学基础专题4 第二单元 醇 酚(共34张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 4.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-05-21 21:44:08 | ||
图片预览










文档简介
(共34张PPT)
你身边的一种
神奇液体
擦
拭
涂
改
液
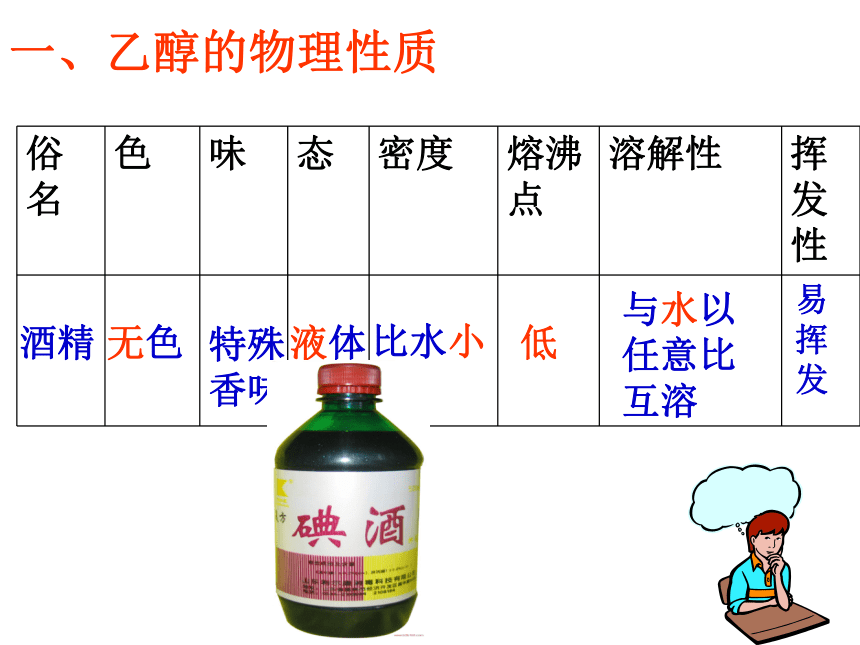
身边的乙醇
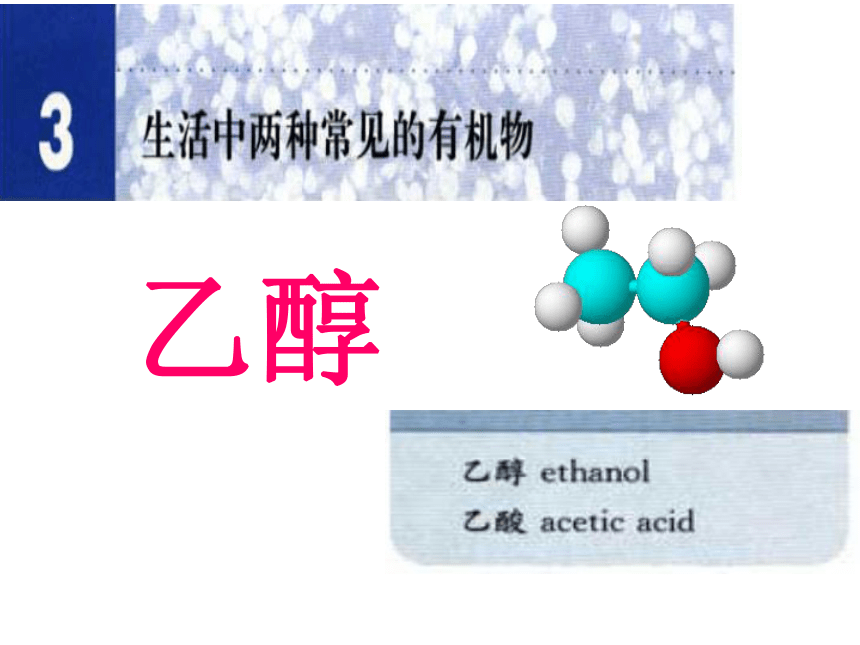
乙醇
特殊
香味
液体
低
比水小
无色
与水以
任意比
互溶
易
挥
发
酒精
一、乙醇的物理性质
俗名 色 味 态 密度 熔沸点 溶解性 挥发性
CH2=CH2 + H2O →
如何制备乙醇?
CH3CH2OH
或C2H5OH
C2H6O
-OH
羟基
二、乙醇的分子结构
烃的衍生物:烃中的氢原子被其它原子或原子团所取代的产物
官能团:决定化合物化学性质的原子或原子团
分子式 结构式 结构简式 特殊基团
实验探究一
?思考(1) 观察钠的保存,说明什么?
(2)仔细观察实验现象,思考为什么?
?思考 (1)钠为什么沉入底部?
(2)有哪种气体生成?
(3)乙醇分子的断键位置?
(4)钠与乙醇、水反应的
剧烈程度不同,原因是什么?
-OH中的H原子的活泼性:醇<水
密度不同:醇<钠
三、乙醇的化学性质
1、乙醇与钠的反应
CH3CH2OH + Na → CH3CH2ONa + H2↑
2 2 2
H—C —C—O—H
H H
H H
乙醇钠 C2H5ONa
用途:在医药工业中,乙醇钠是制备巴比安,苯巴比安等二十余种西药的原料。
苯巴比安:长效的镇静催眠药,在肝病时可用于退黄
各地汽车成“酒鬼”
汽车也能喝酒
2.氧化反应:
(1)可燃性:
乙醇燃烧时放出大量的热
*
焊接银器、铜器时,表面会生成发黑的氧化膜,
银匠说,可以先把铜、银在火上烧热,马上蘸一下酒精,铜银会光亮如初!这是何原理?
实验探究二
思考:1、观察铜丝的颜色变化,思考Cu的作用?
2、小心闻烧杯中液体产生的气味。
实验探究二
铜丝
有刺激性气味
?思考 (1)铜丝发生了什么反应?
(2)刺激性气味的物质是什么?
(3)铜丝的作用?
(4)乙醇分子的断键位置?
实验探究二
CH3CHO
乙醛
+H2O
总反应方程式:
通常Cu或Ag作催化剂
(2)乙醇的催化氧化
①③断键
CH3—C—O—H
H
H
+ O2
2
乙醇
乙醛
H—C —C—O—H
H H
H H
乙醇的催化氧化机理:
身边的化学
——你知道交警是怎样判断驾驶员是否酒后驾车?
世界卫生组织的事故调查显示,大约50%-60%的交通事故与酒后驾驶有关。
切莫贪杯
四.乙醇的用途
1.与金属钠反应时在何处断键( )发生催化氧化反应时在何处断键( )
A. ①
B. ③
C. ① ③
D. ② ③
A
C
2、把质量为m g的铜丝灼烧变黑,立即放入下列物质中,
能使铜丝变红,而且质量仍为m g的是( )
A.稀硫酸
B. 酒精
C.稀硝酸
D.水
B
学以致用:
3.乙醇(C2H6O)的结构可能有两种关于确定
是(I)而不是(II),下列说法不正确的是
(I) (II)
A.乙醇完全燃烧生成CO2和H2O
B.1mol乙醇与足量钠反应生成0.5molH2
C.乙醇能使酸性高锰酸钾溶液褪色
D.乙醇能发生催化氧化反应
A
4.丙烯醇(CH2=CHCH2OH)可跟哪些物质发生化学反应 ( )
①溴水 ②钠 ③氧气 ④酸性高锰酸钾溶液
A.只有②③④ B.只有②③
C.只有①③ D.全部
①与活泼金属反应
②氧化反应-燃烧
-催化氧化
分子结构:
物理性质:
化学性质:
乙醇
官能团-OH
你身边的一种
神奇液体
擦
拭
涂
改
液
身边的乙醇
乙醇
特殊
香味
液体
低
比水小
无色
与水以
任意比
互溶
易
挥
发
酒精
一、乙醇的物理性质
俗名 色 味 态 密度 熔沸点 溶解性 挥发性
CH2=CH2 + H2O →
如何制备乙醇?
CH3CH2OH
或C2H5OH
C2H6O
-OH
羟基
二、乙醇的分子结构
烃的衍生物:烃中的氢原子被其它原子或原子团所取代的产物
官能团:决定化合物化学性质的原子或原子团
分子式 结构式 结构简式 特殊基团
实验探究一
?思考(1) 观察钠的保存,说明什么?
(2)仔细观察实验现象,思考为什么?
?思考 (1)钠为什么沉入底部?
(2)有哪种气体生成?
(3)乙醇分子的断键位置?
(4)钠与乙醇、水反应的
剧烈程度不同,原因是什么?
-OH中的H原子的活泼性:醇<水
密度不同:醇<钠
三、乙醇的化学性质
1、乙醇与钠的反应
CH3CH2OH + Na → CH3CH2ONa + H2↑
2 2 2
H—C —C—O—H
H H
H H
乙醇钠 C2H5ONa
用途:在医药工业中,乙醇钠是制备巴比安,苯巴比安等二十余种西药的原料。
苯巴比安:长效的镇静催眠药,在肝病时可用于退黄
各地汽车成“酒鬼”
汽车也能喝酒
2.氧化反应:
(1)可燃性:
乙醇燃烧时放出大量的热
*
焊接银器、铜器时,表面会生成发黑的氧化膜,
银匠说,可以先把铜、银在火上烧热,马上蘸一下酒精,铜银会光亮如初!这是何原理?
实验探究二
思考:1、观察铜丝的颜色变化,思考Cu的作用?
2、小心闻烧杯中液体产生的气味。
实验探究二
铜丝
有刺激性气味
?思考 (1)铜丝发生了什么反应?
(2)刺激性气味的物质是什么?
(3)铜丝的作用?
(4)乙醇分子的断键位置?
实验探究二
CH3CHO
乙醛
+H2O
总反应方程式:
通常Cu或Ag作催化剂
(2)乙醇的催化氧化
①③断键
CH3—C—O—H
H
H
+ O2
2
乙醇
乙醛
H—C —C—O—H
H H
H H
乙醇的催化氧化机理:
身边的化学
——你知道交警是怎样判断驾驶员是否酒后驾车?
世界卫生组织的事故调查显示,大约50%-60%的交通事故与酒后驾驶有关。
切莫贪杯
四.乙醇的用途
1.与金属钠反应时在何处断键( )发生催化氧化反应时在何处断键( )
A. ①
B. ③
C. ① ③
D. ② ③
A
C
2、把质量为m g的铜丝灼烧变黑,立即放入下列物质中,
能使铜丝变红,而且质量仍为m g的是( )
A.稀硫酸
B. 酒精
C.稀硝酸
D.水
B
学以致用:
3.乙醇(C2H6O)的结构可能有两种关于确定
是(I)而不是(II),下列说法不正确的是
(I) (II)
A.乙醇完全燃烧生成CO2和H2O
B.1mol乙醇与足量钠反应生成0.5molH2
C.乙醇能使酸性高锰酸钾溶液褪色
D.乙醇能发生催化氧化反应
A
4.丙烯醇(CH2=CHCH2OH)可跟哪些物质发生化学反应 ( )
①溴水 ②钠 ③氧气 ④酸性高锰酸钾溶液
A.只有②③④ B.只有②③
C.只有①③ D.全部
①与活泼金属反应
②氧化反应-燃烧
-催化氧化
分子结构:
物理性质:
化学性质:
乙醇
官能团-OH
