苏教版高二化学选修 有机化学基础专题4第三单元 醛 羧酸(共20张PPT)
文档属性
| 名称 | 苏教版高二化学选修 有机化学基础专题4第三单元 醛 羧酸(共20张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-05-21 21:46:32 | ||
图片预览






文档简介
(共20张PPT)
羧酸的性质和应用
望梅止渴
自然界和日常生活中的有机酸
资料卡片
一、羧酸的概述
1、羧酸的定义:
由烃基(或氢原子)与羧基相连构成的有机化合物。
2、羧酸的分类:
烃基不同
羧基数目
芳香酸
脂肪酸
C6H5COOH
CH2=CHCOOH
一元羧酸
二元羧酸
多元羧酸
碳原子个数
低级脂肪酸
高级脂肪酸
饱和一元羧酸:CnH2nO2(n≥1)
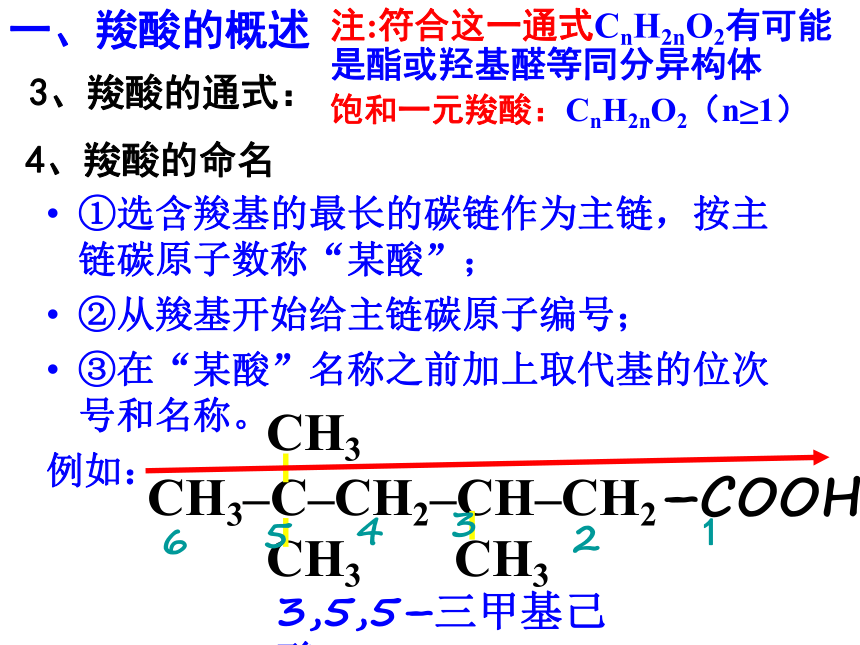
3、羧酸的通式:
一、羧酸的概述
注:符合这一通式CnH2nO2有可能是酯或羟基醛等同分异构体
4、羧酸的命名
①选含羧基的最长的碳链作为主链,按主链碳原子数称“某酸”;
②从羧基开始给主链碳原子编号;
③在“某酸”名称之前加上取代基的位次号和名称。
例如:
3,5,5–三甲基己酸
二、羧酸的性质
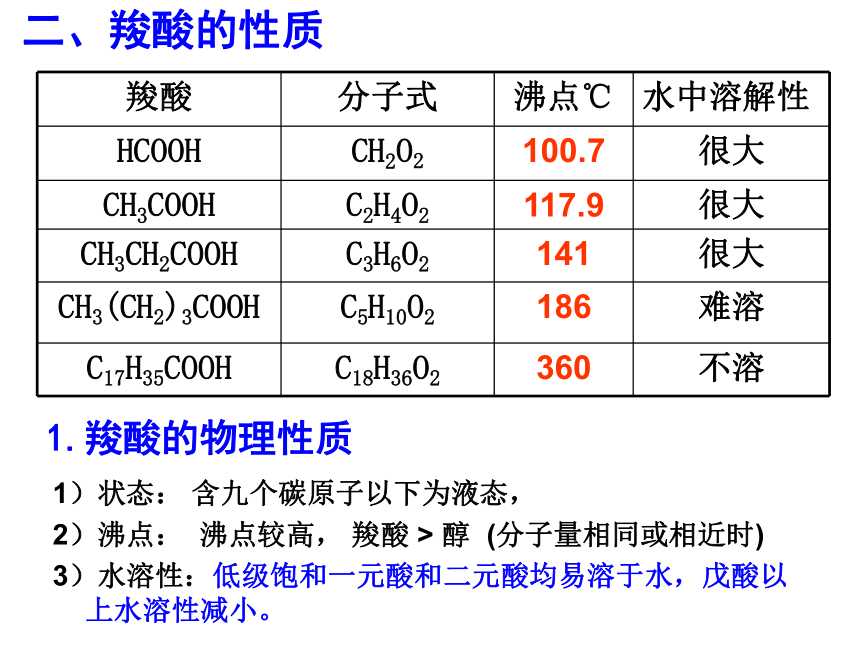
1.羧酸的物理性质
1)状态: 含九个碳原子以下为液态,
2)沸点: 沸点较高, 羧酸 > 醇 (分子量相同或相近时)
3)水溶性:低级饱和一元酸和二元酸均易溶于水,戊酸以上水溶性减小。
羧酸 分子式 沸点℃ 水中溶解性
HCOOH CH2O2 100.7 很大
CH3COOH C2H4O2 117.9 很大
CH3CH2COOH C3H6O2 141 很大
CH3(CH2)3COOH C5H10O2 186 难溶
C17H35COOH C18H36O2 360 不溶
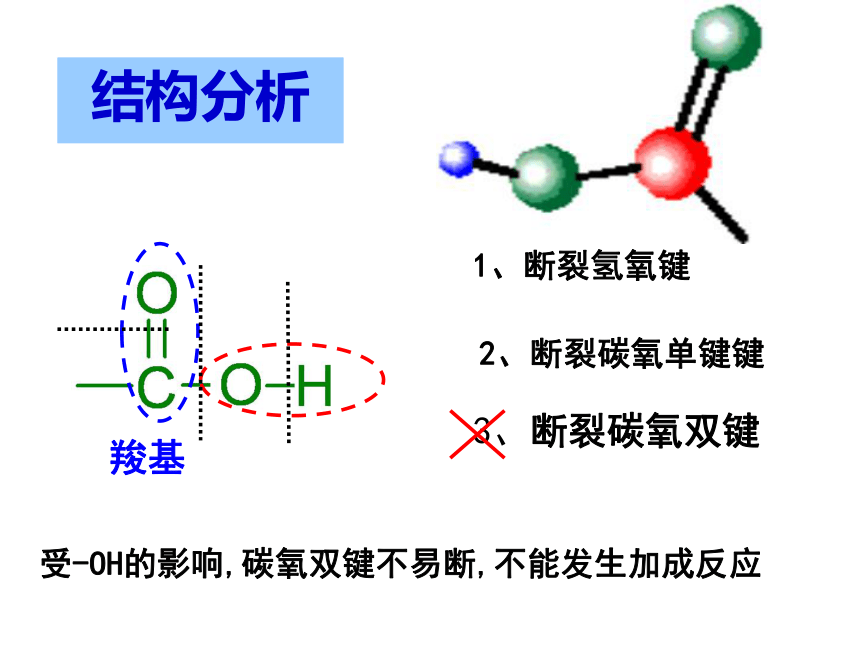
结构分析
羧基
1、断裂氢氧键
2、断裂碳氧单键键
3、断裂碳氧双键
受-OH的影响,碳氧双键不易断,不能发生加成反应
2、羧酸的化学性质
1)酸性
探究一
选择试剂: 醋酸溶液、甲酸溶液
Mg条、
Na2CO3、NaHCO3、
石蕊试液或PH试纸、
NaOH酚酞试液、
CuO等。
证明乙酸、甲酸显酸性
二、羧酸的性质
2CH3COOH + Na2CO3 = 2CH3COONa+H2O+CO2↑
2CH3COOH + Fe = Fe (CH3COO)2+H2↑
CH3COOH + NaOH = CH3COONa+ H2O
2CH3COOH+CuO=(CH3COO)2Cu+2H2O
2、羧酸的化学性质
1)酸性
二、羧酸的性质
讨
论
1
乙酸>碳酸>苯酚
可能一
可能二
2)酯化反应
同位素示踪法
18O
18O
R—
COOH
R—
COO
+
HOCH
2
CH
3
CH
2
CH
3
+
H
2
O
▲
浓硫酸
讨论2
2、羧酸的化学性质
二、羧酸的性质
探究二
试设计实验证明甲酸具有醛的性质
取2mL5%NaOH溶液
3-4滴2%CuSO4溶液
滴入3-4滴2%的甲酸溶液
加热煮沸
有砖红色沉淀
3、甲酸的特性
用新制的Cu(OH)2 或银氨溶液
1、对苯二甲酸( )与
乙二醇 ( )发生酯化反应,可能
方式有几种?
酯化反应原理应用
······
三、羧酸性质应用
③
CH3CH2OH
C6H5OH
CH3COOH
中性
比碳酸弱
比碳酸强
能
能
能
能
能
不能
不能
能
能,不产
生CO2
醇、酚、羧酸中羟基的比较
【知识归纳】
代表物 结构简式 酸性 与钠反应 与NaOH的反应 与Na2CO3的反应
乙醇
苯酚
乙酸
(1) Na
(2) NaOH
(3) NaHCO3
例2:1mol有机物
最多能消耗下列各物质多少 mol?
4
2
1
例3、下列物质中的溴原子在适当条件下都能被羟基所取代,所得产物能跟NaHCO3溶液反应的是( )
A. B. C. D.
C
OH
OH
OH
OH
1、指出该制取乙酸乙酯装置中的错误
酯化反应与酯水解反应的比较
酯化
水解
酯 化 水 解
反应关系
催 化 剂
催化剂的
其他作用
加热方式
反应类型
小结:几种衍生物之间的关系
1.对有机物
的叙述不正确的是
A.常温下能与Na2CO3反应放出CO2
B.在碱性条件下水解,0.5mol该有机物完全反应消耗4mol NaOH
C.与稀H2SO4共热生成两种有机物
D.该物质的化学式为C14H10O9
B
课堂练习
羧酸的性质和应用
望梅止渴
自然界和日常生活中的有机酸
资料卡片
一、羧酸的概述
1、羧酸的定义:
由烃基(或氢原子)与羧基相连构成的有机化合物。
2、羧酸的分类:
烃基不同
羧基数目
芳香酸
脂肪酸
C6H5COOH
CH2=CHCOOH
一元羧酸
二元羧酸
多元羧酸
碳原子个数
低级脂肪酸
高级脂肪酸
饱和一元羧酸:CnH2nO2(n≥1)
3、羧酸的通式:
一、羧酸的概述
注:符合这一通式CnH2nO2有可能是酯或羟基醛等同分异构体
4、羧酸的命名
①选含羧基的最长的碳链作为主链,按主链碳原子数称“某酸”;
②从羧基开始给主链碳原子编号;
③在“某酸”名称之前加上取代基的位次号和名称。
例如:
3,5,5–三甲基己酸
二、羧酸的性质
1.羧酸的物理性质
1)状态: 含九个碳原子以下为液态,
2)沸点: 沸点较高, 羧酸 > 醇 (分子量相同或相近时)
3)水溶性:低级饱和一元酸和二元酸均易溶于水,戊酸以上水溶性减小。
羧酸 分子式 沸点℃ 水中溶解性
HCOOH CH2O2 100.7 很大
CH3COOH C2H4O2 117.9 很大
CH3CH2COOH C3H6O2 141 很大
CH3(CH2)3COOH C5H10O2 186 难溶
C17H35COOH C18H36O2 360 不溶
结构分析
羧基
1、断裂氢氧键
2、断裂碳氧单键键
3、断裂碳氧双键
受-OH的影响,碳氧双键不易断,不能发生加成反应
2、羧酸的化学性质
1)酸性
探究一
选择试剂: 醋酸溶液、甲酸溶液
Mg条、
Na2CO3、NaHCO3、
石蕊试液或PH试纸、
NaOH酚酞试液、
CuO等。
证明乙酸、甲酸显酸性
二、羧酸的性质
2CH3COOH + Na2CO3 = 2CH3COONa+H2O+CO2↑
2CH3COOH + Fe = Fe (CH3COO)2+H2↑
CH3COOH + NaOH = CH3COONa+ H2O
2CH3COOH+CuO=(CH3COO)2Cu+2H2O
2、羧酸的化学性质
1)酸性
二、羧酸的性质
讨
论
1
乙酸>碳酸>苯酚
可能一
可能二
2)酯化反应
同位素示踪法
18O
18O
R—
COOH
R—
COO
+
HOCH
2
CH
3
CH
2
CH
3
+
H
2
O
▲
浓硫酸
讨论2
2、羧酸的化学性质
二、羧酸的性质
探究二
试设计实验证明甲酸具有醛的性质
取2mL5%NaOH溶液
3-4滴2%CuSO4溶液
滴入3-4滴2%的甲酸溶液
加热煮沸
有砖红色沉淀
3、甲酸的特性
用新制的Cu(OH)2 或银氨溶液
1、对苯二甲酸( )与
乙二醇 ( )发生酯化反应,可能
方式有几种?
酯化反应原理应用
······
三、羧酸性质应用
③
CH3CH2OH
C6H5OH
CH3COOH
中性
比碳酸弱
比碳酸强
能
能
能
能
能
不能
不能
能
能,不产
生CO2
醇、酚、羧酸中羟基的比较
【知识归纳】
代表物 结构简式 酸性 与钠反应 与NaOH的反应 与Na2CO3的反应
乙醇
苯酚
乙酸
(1) Na
(2) NaOH
(3) NaHCO3
例2:1mol有机物
最多能消耗下列各物质多少 mol?
4
2
1
例3、下列物质中的溴原子在适当条件下都能被羟基所取代,所得产物能跟NaHCO3溶液反应的是( )
A. B. C. D.
C
OH
OH
OH
OH
1、指出该制取乙酸乙酯装置中的错误
酯化反应与酯水解反应的比较
酯化
水解
酯 化 水 解
反应关系
催 化 剂
催化剂的
其他作用
加热方式
反应类型
小结:几种衍生物之间的关系
1.对有机物
的叙述不正确的是
A.常温下能与Na2CO3反应放出CO2
B.在碱性条件下水解,0.5mol该有机物完全反应消耗4mol NaOH
C.与稀H2SO4共热生成两种有机物
D.该物质的化学式为C14H10O9
B
课堂练习
