人教版高二化学选修3第三章第四节 离子晶体(共16张PPT)
文档属性
| 名称 | 人教版高二化学选修3第三章第四节 离子晶体(共16张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-05-23 00:00:00 | ||
图片预览



文档简介
(共16张PPT)
离子晶体
回顾:三种晶体类型与性质的比较
晶体类型 原子晶体 分子晶体 金属晶体
概念 相邻原子之间以共价键相结合而成具有空间网状结构的晶体 分子间以范德华力相结合而成的晶体 通过金属键形成的晶体
作用力 共价键 范德华力 金属键
构成微粒 原子 分子 金属阳离子和自由电子
物
理
性
质 熔沸点 很高 很低 差别较大
硬度 很大 很小 差别较大
导电性 无(硅为半导体) 无 导体
实例 金刚石、二氧化硅、晶体硅、碳化硅 Ar、S等 Au、Fe、Cu、钢铁等
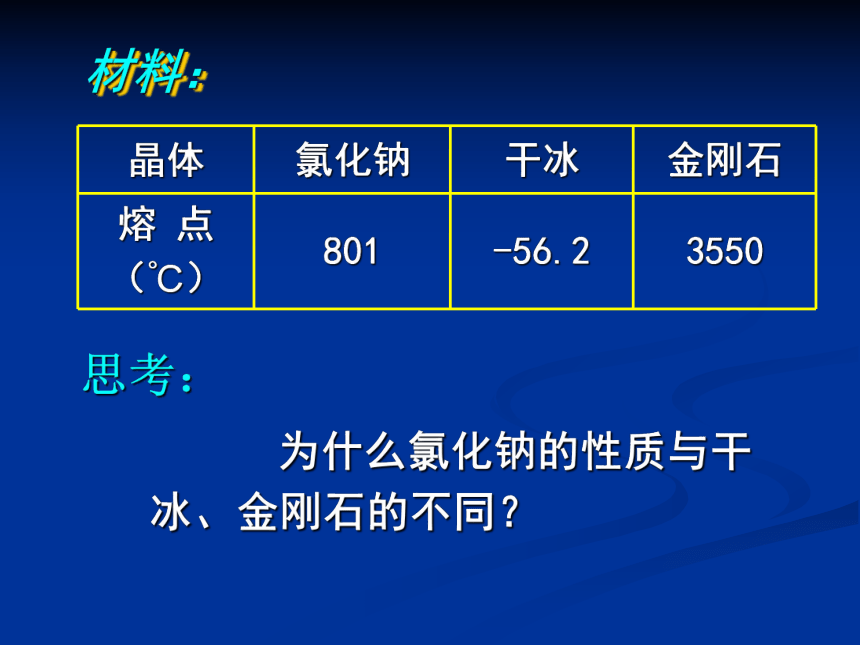
材料:
思考:
为什么氯化钠的性质与干冰、金刚石的不同?
晶体 氯化钠 干冰 金刚石
熔 点
(℃) 801 -56.2 3550
强碱、活泼金属氧化物、大部分的盐类。
1、定义:
由阳离子和阴离子通过离子键结合而成的晶体。
2、成键粒子:
阴、阳离子
3、相互作用力:
离子键
4、常见的离子晶体:
一、离子晶体
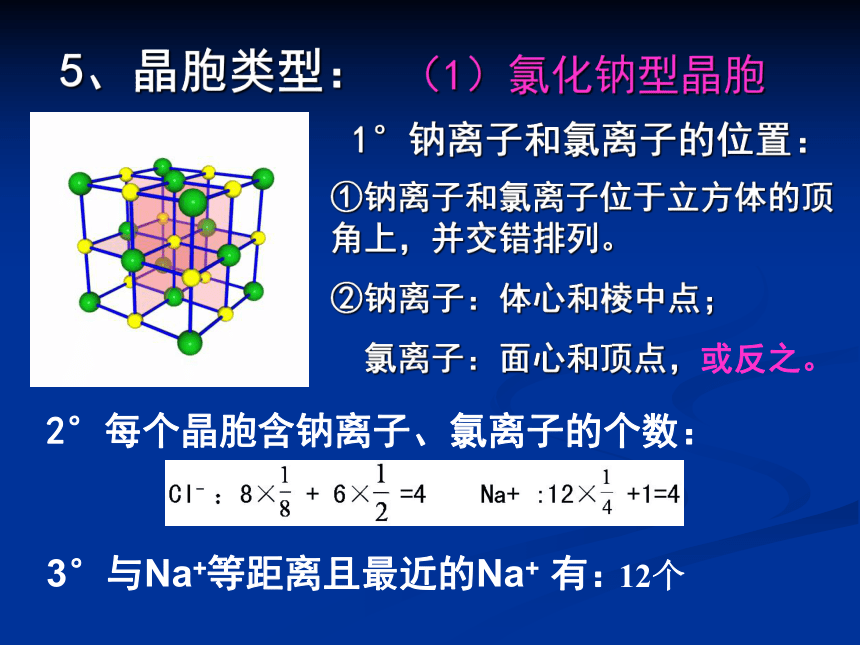
5、晶胞类型:
(1)氯化钠型晶胞
1°钠离子和氯离子的位置:
①钠离子和氯离子位于立方体的顶角上,并交错排列。
②钠离子:体心和棱中点;
氯离子:面心和顶点,或反之。
2°每个晶胞含钠离子、氯离子的个数:
3°与Na+等距离且最近的Na+ 有:
12个
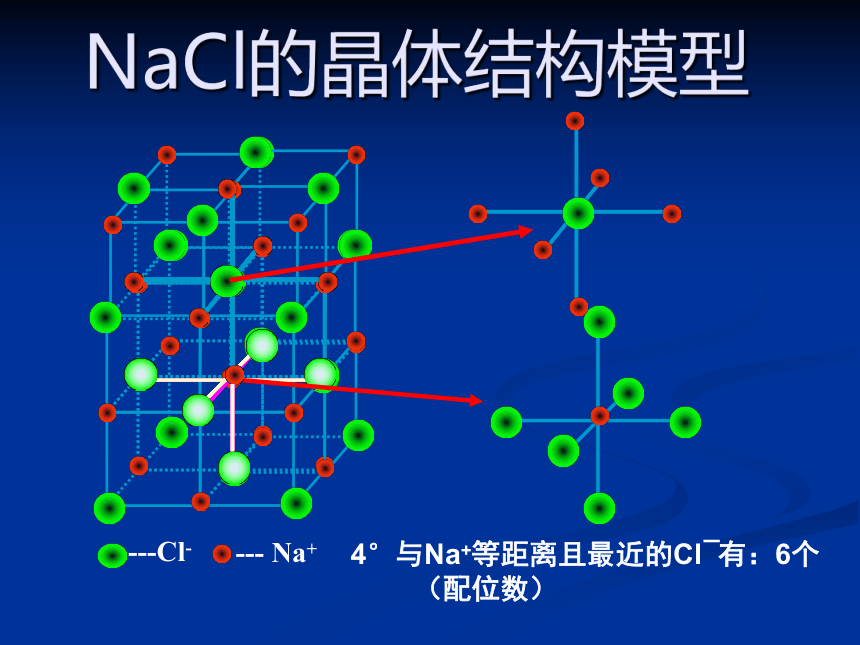
NaCl的晶体结构模型
4°与Na+等距离且最近的Cl?有:6个
(配位数)
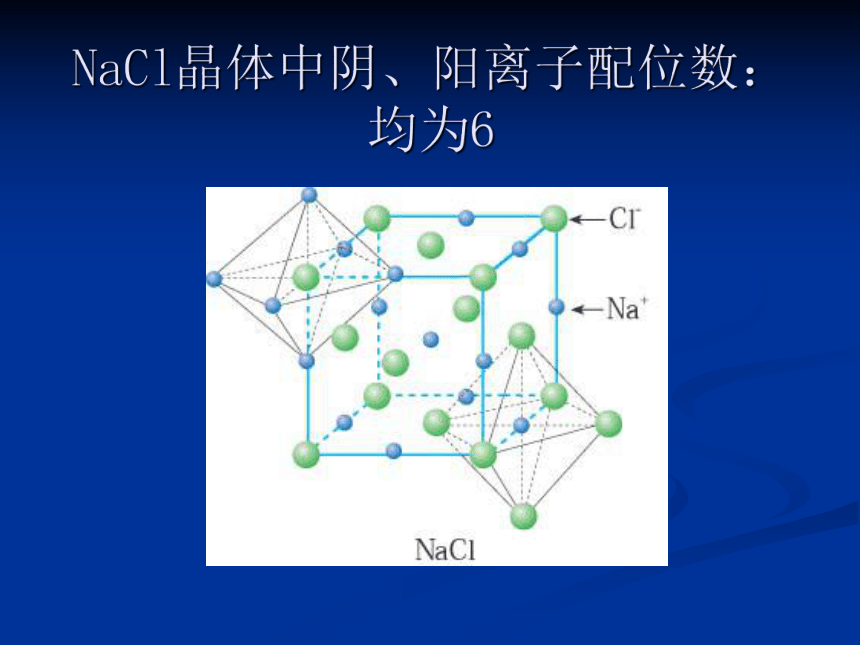
NaCl晶体中阴、阳离子配位数:均为6
(2)氯化铯型晶胞
1°铯离子和氯离子的位置:
铯离子:体心
氯离子:顶点;或者反之。
2°每个晶胞含铯离子、氯离子的个数:
3°与铯离子等距离且最近的铯离子、氯离子各有几个?
铯离子:6个;氯离子:8个
(配位数)
1个
CsCl晶体及晶胞结构示意图
(3)CaF2型晶胞
2°Ca2+的配位数:
F-的配位数:
1°一个CaF2晶胞中含:
4个Ca2+和8个F?
8
4
科学探究:
找出NaCl、CsCl两种离子晶体中阳离子和阴离子的配位数,它们是否相等?
6
6
8
8
离子晶体 阴离子的配位数 阳离子的配位数
NaCl
CsCl
科学探究:
你认为是什么因素决定了离子晶体中离子的配位数?根据表3—5、表3—6分析影响离子晶体中离子配位数的因素。
配位数 4 6 8
半径比 0.2~0.4 0.4~0.7 0.7~1.0
空间构型 ZnS NaCl CsCl
6、决定离子晶体结构的因素
(1)几何因素
晶体中正负离子的半径比
(2)电荷因素
晶体中正负离子的电荷比
(3)键性因素
离子键的纯粹因素
7、离子晶体的特点:
(1)无单个分子存在;NaCl不表示分子式。
(2)熔沸点较高,硬度较大,难挥发难压缩。且随着离子电荷的增加,核间距离的缩短,熔点升高。
(3)一般易溶于水,而难溶于非极性溶剂。
(4)固态不导电,水溶液或者熔融状态下能导电。
二、晶格能
1、定义:气态离子形成1摩离子晶体时释放的
能量。
2、晶格能的大小的影响因素
仔细阅读课本P80表3—8及下表,分析晶格能的大小与离子晶体的熔点有什么关系?离子晶体的晶格能与哪些因素有关?
氟化物 晶格能/kJ·mol-1
NaF 923
MgF2 2957
AlF3 5492
3、晶格能对离子晶体性质的影响:
晶格能越大
(1)形成的离子晶体越稳定;(离子键越强)
(2)熔点越高;
(3)硬度越大。
晶格能的大小:
离子电荷越大 ,阴、阳离子半径越小 ,即阴、阳离子间的距离越小 ,则晶格能越大 。简言之,晶格能的大小与离子带电量成正比,与离子半径成反比.
离子晶体
回顾:三种晶体类型与性质的比较
晶体类型 原子晶体 分子晶体 金属晶体
概念 相邻原子之间以共价键相结合而成具有空间网状结构的晶体 分子间以范德华力相结合而成的晶体 通过金属键形成的晶体
作用力 共价键 范德华力 金属键
构成微粒 原子 分子 金属阳离子和自由电子
物
理
性
质 熔沸点 很高 很低 差别较大
硬度 很大 很小 差别较大
导电性 无(硅为半导体) 无 导体
实例 金刚石、二氧化硅、晶体硅、碳化硅 Ar、S等 Au、Fe、Cu、钢铁等
材料:
思考:
为什么氯化钠的性质与干冰、金刚石的不同?
晶体 氯化钠 干冰 金刚石
熔 点
(℃) 801 -56.2 3550
强碱、活泼金属氧化物、大部分的盐类。
1、定义:
由阳离子和阴离子通过离子键结合而成的晶体。
2、成键粒子:
阴、阳离子
3、相互作用力:
离子键
4、常见的离子晶体:
一、离子晶体
5、晶胞类型:
(1)氯化钠型晶胞
1°钠离子和氯离子的位置:
①钠离子和氯离子位于立方体的顶角上,并交错排列。
②钠离子:体心和棱中点;
氯离子:面心和顶点,或反之。
2°每个晶胞含钠离子、氯离子的个数:
3°与Na+等距离且最近的Na+ 有:
12个
NaCl的晶体结构模型
4°与Na+等距离且最近的Cl?有:6个
(配位数)
NaCl晶体中阴、阳离子配位数:均为6
(2)氯化铯型晶胞
1°铯离子和氯离子的位置:
铯离子:体心
氯离子:顶点;或者反之。
2°每个晶胞含铯离子、氯离子的个数:
3°与铯离子等距离且最近的铯离子、氯离子各有几个?
铯离子:6个;氯离子:8个
(配位数)
1个
CsCl晶体及晶胞结构示意图
(3)CaF2型晶胞
2°Ca2+的配位数:
F-的配位数:
1°一个CaF2晶胞中含:
4个Ca2+和8个F?
8
4
科学探究:
找出NaCl、CsCl两种离子晶体中阳离子和阴离子的配位数,它们是否相等?
6
6
8
8
离子晶体 阴离子的配位数 阳离子的配位数
NaCl
CsCl
科学探究:
你认为是什么因素决定了离子晶体中离子的配位数?根据表3—5、表3—6分析影响离子晶体中离子配位数的因素。
配位数 4 6 8
半径比 0.2~0.4 0.4~0.7 0.7~1.0
空间构型 ZnS NaCl CsCl
6、决定离子晶体结构的因素
(1)几何因素
晶体中正负离子的半径比
(2)电荷因素
晶体中正负离子的电荷比
(3)键性因素
离子键的纯粹因素
7、离子晶体的特点:
(1)无单个分子存在;NaCl不表示分子式。
(2)熔沸点较高,硬度较大,难挥发难压缩。且随着离子电荷的增加,核间距离的缩短,熔点升高。
(3)一般易溶于水,而难溶于非极性溶剂。
(4)固态不导电,水溶液或者熔融状态下能导电。
二、晶格能
1、定义:气态离子形成1摩离子晶体时释放的
能量。
2、晶格能的大小的影响因素
仔细阅读课本P80表3—8及下表,分析晶格能的大小与离子晶体的熔点有什么关系?离子晶体的晶格能与哪些因素有关?
氟化物 晶格能/kJ·mol-1
NaF 923
MgF2 2957
AlF3 5492
3、晶格能对离子晶体性质的影响:
晶格能越大
(1)形成的离子晶体越稳定;(离子键越强)
(2)熔点越高;
(3)硬度越大。
晶格能的大小:
离子电荷越大 ,阴、阳离子半径越小 ,即阴、阳离子间的距离越小 ,则晶格能越大 。简言之,晶格能的大小与离子带电量成正比,与离子半径成反比.
