人教版高中化学必修二2.1 化学能与热能 29ppt
文档属性
| 名称 | 人教版高中化学必修二2.1 化学能与热能 29ppt |  | |
| 格式 | zip | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-05-23 22:44:00 | ||
图片预览








文档简介
(共29张PPT)
科学探测表明:全世界的石油大概在2060年左右耗尽,天然气2060年用光,煤炭虽是最“丰富”的能源,但最多还能维持200年……
新安晚报曾报道:截止2006年底,我国石油剩余经济可开采储量为20.43亿吨;天然气剩余经济可开采储量为24490亿立方米,目前,石油储量可采11年。
很早以前,人们就对化学反应孜孜不倦的探索, 究竟化学反应的魅力何在?
1. 化学反应产生出的许多新物质,可以满足人们的物质生活需要!
2. 化学反应提供的能量 推动人类社会不断的进步。
思考
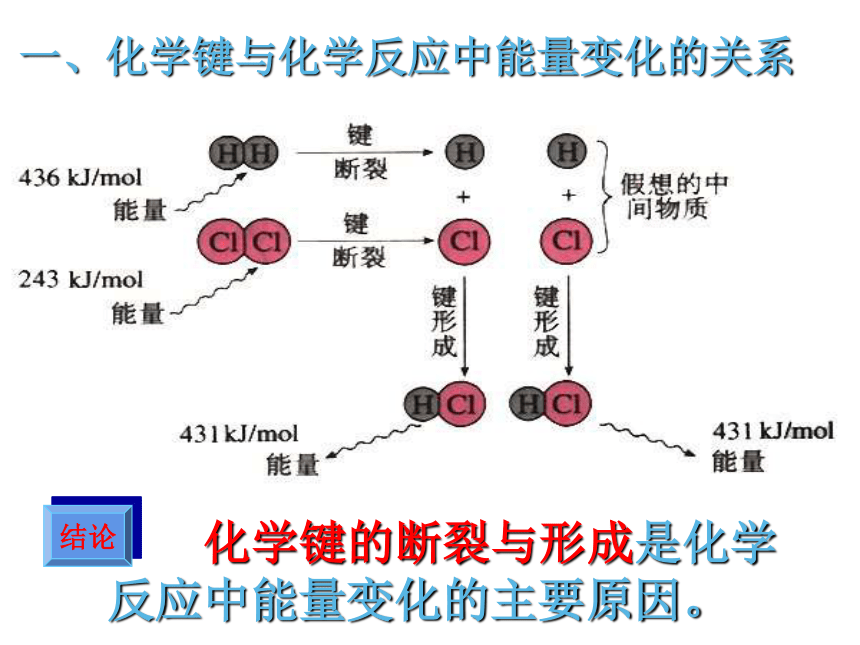
一、化学键与化学反应中能量变化的关系
化学键的断裂与形成是化学反应中能量变化的主要原因。
结论
断键吸收总能量 > 成键放出的总能量
吸收能量
断键吸收总能量 < 成键放出的总能量
放出能量
化学能
释放能量
吸收能量
不同
断裂
形成
小结
问题
如何判断一个反应是吸收能量还是放出能量呢?
水由低至高,
外界提供能量
(机械能——势能)
水由高至低,
放出能量
(势能——动能)
E(反应物)>E(生成物)
放出能量
E(反应物)<E(生成物)
吸收能量
一个化学反应是释放能量还是吸收能量
取决于反应物总能量与生成物总能量的相对
高低。
反应中的能量变化
CaCO3 CaO + CO2
高温
CuO + H2 Cu + H2O
加热
C + H2O CO + H2
高温
产生水煤气的反应
氢气还原氧化铜
生产生石灰的反应
高温
加热
以上反应需要吸收一定能量,才能发生。
注意反应条件
二、化学能与热能的相互转化
有气泡放出,试管变热
反应放出热量
现象 结论
实验 2 Ba(OH)2· 8H2O与NH4Cl的反应
有刺激性气味,烧杯底部很冷,烧杯下面的玻璃片与烧杯被冻在一起。
反应吸收热量
现象 结论
E(反应物)>E(生成物)
化学能转化为热能
E(反应物)<E(生成物)
热能转化为化学能
二、化学能与热能的相互转化
化学反应中的能量变化,通常主要表现为热量的变化,吸热或放热。
常见放热反应和吸热反应
常见放热反应:
? 燃料物质的燃烧 C + O2 = CO2
? 常见金属(Al、Fe、Zn等)与酸
(HCl、H2SO4等)的反应
? 酸碱中和反应: HCl + NaOH = NaCl + H2O
? 缓慢氧化:食物的腐败
? 大多数化合反应
? Ba(OH)2·8H2O晶体与NH4Cl晶体的反应:
Ba(OH)2·8H2O+2NH4Cl = BaCl2+2NH3↑+10H2O
1.目前,一种人称“摇摇冰”的即冰用饮料开始上市,所谓“摇摇冰”是指将饮料罐隔离层中的制冷物质和水混合起来,吸食前摇动使罐中的饮料冷却。若该制冷物质可从下列固体物质中选择,则它可以是( ) A.氯化钠 B.固体硝酸铵
C.生石灰 D.固体氢氧化钠
2. 一种“即食即热快餐”适合外出旅游时使用,其内层是用铝箔包裹的并已加工好的真空包装食品,外层则是分别包装的两包化学物质,使用时拉动预留在外的拉线,使这两包化学物质反应,此时便可对食物进行加热,这两包化学物质最适合选择的是( )
A.浓H2SO4与水 B.生石灰与水
C.熟石灰与水 D.氯化钠与水
学以致用
B
B
4、下列对化学反应的认识错误的是( )
A.必然会存在化学键的变化
B.会产生新的物质
C.必然引起物质状态的变化
D.必然伴随着能量的变化
C
C
小试牛刀
5、从如图所示的某气体反应的能量变化分析,以下判断错误的是( )
A.这是一个放热反应
B.该反应可能需要加热
C.生成物的总能量低于反应物的总能量
D.反应物比生成物更稳定
D
试试看
2Al+6H+ = 2Al3++3H2↑
铝片表面有大量气泡产生,Al片逐渐溶解
下 降
放热
上升
NH4NO3溶
于水是吸热过程,使锥形瓶内气体温度降低,气压减小,
在大气压的作用下,左侧液面上升,右侧液面下降。
反应放热,使锥形瓶内气体温度升高,气压增大,使得左侧液面下降,右侧液面上升。
放热反应
吸热反应
>
<
金属与酸或水的反应
大部分的化合反应
可燃物的燃烧或缓慢氧化
酸碱中和
大部分的分解反应
以C、CO、H2为还原剂的氧化还原反应
Ba(OH)2·8H2O与NH4Cl反应
总结
化学键的断裂与形成是化学反应中能量变化的主要原因
图示
放热反应或吸热反应
能量变化
反应物总能量 生物总能量
反应物总能量 生物总能量
化学反应中能量变化的原因
常见实例
在同温、同压下,比较下列反应放出
热量Q1、Q2的大小。
(1)2H2(g)+O2(g)=2H2O(g) + Q1
2H2(g)+O2(g)=2H2O(l) + Q2
分析:反应物的状态,数量和生成物的数量都相同,但由于液态水转化为气态水要吸收一定的热量。
∴Q2>Q1
(2)S(g)+O2(g)=SO2(g) + Q1
S(S)+O2(g)=SO2(g) + Q2
在同温、同压下,比较下列反应放出
热量Q1、Q2的大小
两式数量相同,S由固态吸收热量转化为气态,再氧化燃烧生成SO2。其放出热量的总和小于由气态S直接燃烧所放出的热量。
∴Q1>Q2
(3)C(S)+1/2O2(g) = CO(g) + Q1
C(S)+O2(g) = CO2(g) + Q2
在同温、同压下,比较下列反应放出热量Q1、Q2的大小
固态C氧化为CO,释放出热量Q1,CO是气体燃料,和O2反应生成CO2,又释放热量Q3,两次释放热量的总和Q1+Q3,而固态C直接氧化为气态CO2释放的热量为Q2。
∴Q2>Q1
作业
习题:1、4、5、6、7
科学探测表明:全世界的石油大概在2060年左右耗尽,天然气2060年用光,煤炭虽是最“丰富”的能源,但最多还能维持200年……
新安晚报曾报道:截止2006年底,我国石油剩余经济可开采储量为20.43亿吨;天然气剩余经济可开采储量为24490亿立方米,目前,石油储量可采11年。
很早以前,人们就对化学反应孜孜不倦的探索, 究竟化学反应的魅力何在?
1. 化学反应产生出的许多新物质,可以满足人们的物质生活需要!
2. 化学反应提供的能量 推动人类社会不断的进步。
思考
一、化学键与化学反应中能量变化的关系
化学键的断裂与形成是化学反应中能量变化的主要原因。
结论
断键吸收总能量 > 成键放出的总能量
吸收能量
断键吸收总能量 < 成键放出的总能量
放出能量
化学能
释放能量
吸收能量
不同
断裂
形成
小结
问题
如何判断一个反应是吸收能量还是放出能量呢?
水由低至高,
外界提供能量
(机械能——势能)
水由高至低,
放出能量
(势能——动能)
E(反应物)>E(生成物)
放出能量
E(反应物)<E(生成物)
吸收能量
一个化学反应是释放能量还是吸收能量
取决于反应物总能量与生成物总能量的相对
高低。
反应中的能量变化
CaCO3 CaO + CO2
高温
CuO + H2 Cu + H2O
加热
C + H2O CO + H2
高温
产生水煤气的反应
氢气还原氧化铜
生产生石灰的反应
高温
加热
以上反应需要吸收一定能量,才能发生。
注意反应条件
二、化学能与热能的相互转化
有气泡放出,试管变热
反应放出热量
现象 结论
实验 2 Ba(OH)2· 8H2O与NH4Cl的反应
有刺激性气味,烧杯底部很冷,烧杯下面的玻璃片与烧杯被冻在一起。
反应吸收热量
现象 结论
E(反应物)>E(生成物)
化学能转化为热能
E(反应物)<E(生成物)
热能转化为化学能
二、化学能与热能的相互转化
化学反应中的能量变化,通常主要表现为热量的变化,吸热或放热。
常见放热反应和吸热反应
常见放热反应:
? 燃料物质的燃烧 C + O2 = CO2
? 常见金属(Al、Fe、Zn等)与酸
(HCl、H2SO4等)的反应
? 酸碱中和反应: HCl + NaOH = NaCl + H2O
? 缓慢氧化:食物的腐败
? 大多数化合反应
? Ba(OH)2·8H2O晶体与NH4Cl晶体的反应:
Ba(OH)2·8H2O+2NH4Cl = BaCl2+2NH3↑+10H2O
1.目前,一种人称“摇摇冰”的即冰用饮料开始上市,所谓“摇摇冰”是指将饮料罐隔离层中的制冷物质和水混合起来,吸食前摇动使罐中的饮料冷却。若该制冷物质可从下列固体物质中选择,则它可以是( ) A.氯化钠 B.固体硝酸铵
C.生石灰 D.固体氢氧化钠
2. 一种“即食即热快餐”适合外出旅游时使用,其内层是用铝箔包裹的并已加工好的真空包装食品,外层则是分别包装的两包化学物质,使用时拉动预留在外的拉线,使这两包化学物质反应,此时便可对食物进行加热,这两包化学物质最适合选择的是( )
A.浓H2SO4与水 B.生石灰与水
C.熟石灰与水 D.氯化钠与水
学以致用
B
B
4、下列对化学反应的认识错误的是( )
A.必然会存在化学键的变化
B.会产生新的物质
C.必然引起物质状态的变化
D.必然伴随着能量的变化
C
C
小试牛刀
5、从如图所示的某气体反应的能量变化分析,以下判断错误的是( )
A.这是一个放热反应
B.该反应可能需要加热
C.生成物的总能量低于反应物的总能量
D.反应物比生成物更稳定
D
试试看
2Al+6H+ = 2Al3++3H2↑
铝片表面有大量气泡产生,Al片逐渐溶解
下 降
放热
上升
NH4NO3溶
于水是吸热过程,使锥形瓶内气体温度降低,气压减小,
在大气压的作用下,左侧液面上升,右侧液面下降。
反应放热,使锥形瓶内气体温度升高,气压增大,使得左侧液面下降,右侧液面上升。
放热反应
吸热反应
>
<
金属与酸或水的反应
大部分的化合反应
可燃物的燃烧或缓慢氧化
酸碱中和
大部分的分解反应
以C、CO、H2为还原剂的氧化还原反应
Ba(OH)2·8H2O与NH4Cl反应
总结
化学键的断裂与形成是化学反应中能量变化的主要原因
图示
放热反应或吸热反应
能量变化
反应物总能量 生物总能量
反应物总能量 生物总能量
化学反应中能量变化的原因
常见实例
在同温、同压下,比较下列反应放出
热量Q1、Q2的大小。
(1)2H2(g)+O2(g)=2H2O(g) + Q1
2H2(g)+O2(g)=2H2O(l) + Q2
分析:反应物的状态,数量和生成物的数量都相同,但由于液态水转化为气态水要吸收一定的热量。
∴Q2>Q1
(2)S(g)+O2(g)=SO2(g) + Q1
S(S)+O2(g)=SO2(g) + Q2
在同温、同压下,比较下列反应放出
热量Q1、Q2的大小
两式数量相同,S由固态吸收热量转化为气态,再氧化燃烧生成SO2。其放出热量的总和小于由气态S直接燃烧所放出的热量。
∴Q1>Q2
(3)C(S)+1/2O2(g) = CO(g) + Q1
C(S)+O2(g) = CO2(g) + Q2
在同温、同压下,比较下列反应放出热量Q1、Q2的大小
固态C氧化为CO,释放出热量Q1,CO是气体燃料,和O2反应生成CO2,又释放热量Q3,两次释放热量的总和Q1+Q3,而固态C直接氧化为气态CO2释放的热量为Q2。
∴Q2>Q1
作业
习题:1、4、5、6、7
