人教版高二化学选修4第一章第一节化学反应与能量的变化 课件 (共20张PPT)
文档属性
| 名称 | 人教版高二化学选修4第一章第一节化学反应与能量的变化 课件 (共20张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 752.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-05-23 22:51:27 | ||
图片预览





文档简介
(共20张PPT)
第一章 化学反应与能量
第一节 化学反应与能量变化
学习目标:
2.学会分析化学反应中能量变化的原 因和常见的能量转化形式。
1. 理解反应热和焓变的含义
“神七”飞天的动能是什么能转化而来的?
问题一:反应中为什么会有能量的变化?
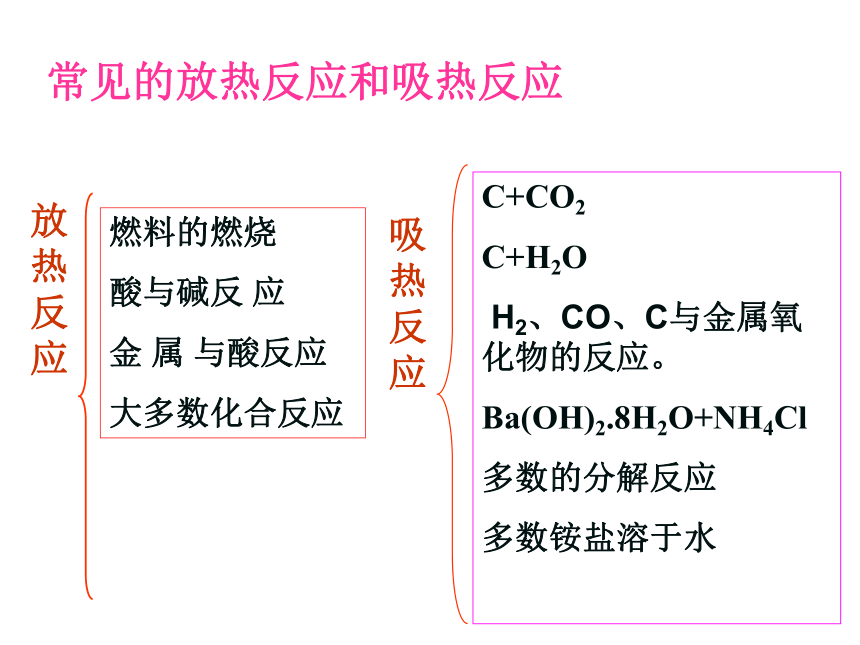
问题二:什么叫放热反应,什么叫吸热反应?你能举例那些反应为放热或吸热反应?并将其归类。
常见的放热反应和吸热反应
放热反应
吸热反应
一、焓变、反应热
1、焓和焓变
2、反应热
2、在化学反应过程中吸收或放出的热量,叫做反应热,又称为“焓变”
1、焓:是与内能有关的物理量
焓变:生成物与反应物的焓值差
热力学中表示物质系统能量的一个状态函数,常用符号H表示。数值上等于系统的内能U加上压强p和体积V的乘积,即H=U+pV。
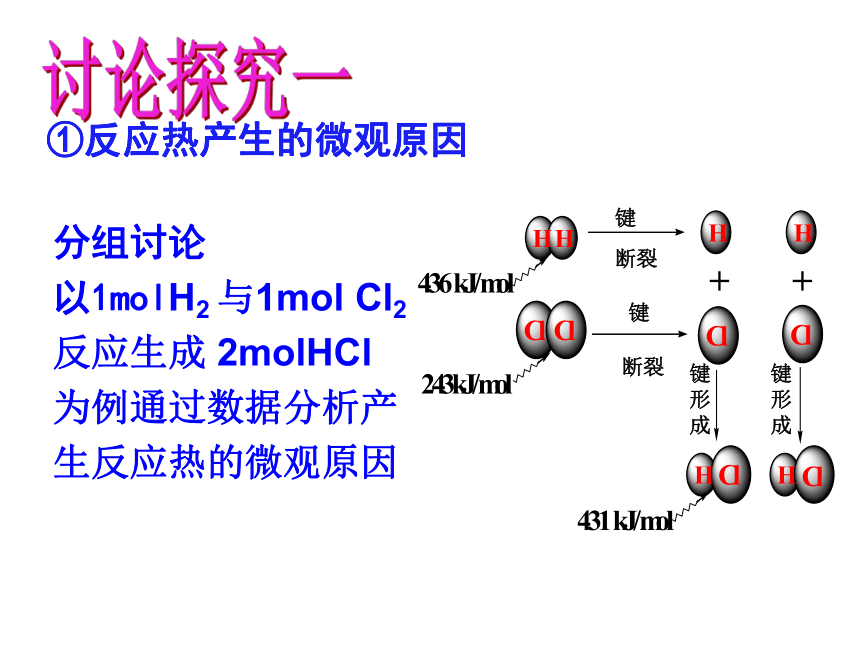
①反应热产生的微观原因
分组讨论
以1molH2 与1mol Cl2
反应生成 2molHCl
为例通过数据分析产
生反应热的微观原因
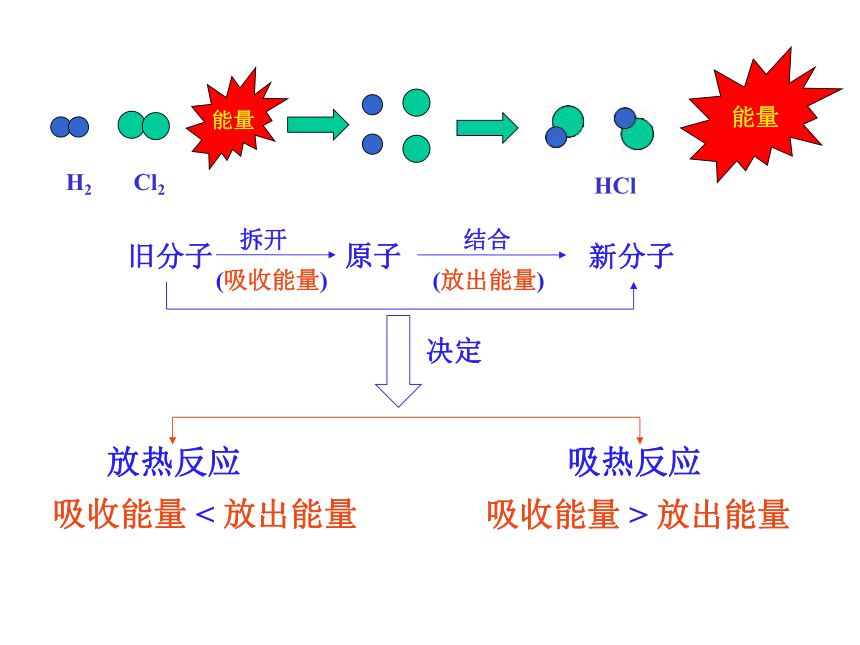
①反应热产生的微观原因
键
断裂
键
断裂
键形成
键形成
Cl2
HCl
能量
能量
(吸收能量)
旧分子
拆开
原子
(放出能量)
新分子
结合
吸收能量 < 放出能量
吸收能量 > 放出能量
放热反应
吸热反应
决定
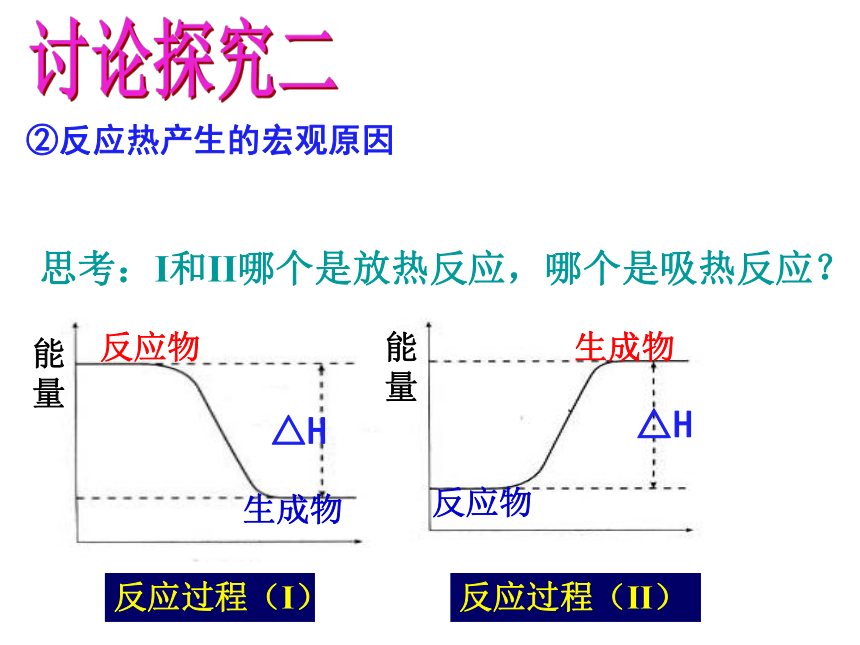
②反应热产生的宏观原因
能量
能量
反应物
反应物
生成物
生成物
反应过程(I)
反应过程(II)
思考:I和II哪个是放热反应,哪个是吸热反应?
△H
△H
③反应热表示方法:
阅读第2-3页体系与环境的关系,借助图1-2,
讨论△H的“+”与“-”的理解。
反应热用符号“△H”表示,单位常采用kJ/mol或kJ·mol-1
思考
ΔH的正负值是如何规定的?参照体系是什么?
体系的能量如何变化?升高还是降低?
环境的能量如何变化?升高还是降低?
规定放热反应的ΔH 为“-”,是站在谁的角度?体系还是环境?
放热反应中
环境
+
-
能量
能量
反应物
反应物
生成物
生成物
△H
△H
反应体系的能量降低
反应体系的能量升高
ΔH <0
ΔH >0
1.1molC与1molH2O(g)反应生成lmol CO(g)和1mol H2(g),需要吸收131.5kJ的热量,该反应的反应热为△H= kJ/mol
2.拆开 lmol H—H键、lmol N-H键、lmolN≡N键分别需要的能量是436kJ、391kJ、946kJ,则1mol N2生成NH3的反应热为 ,1mol H2生成NH3的反应热为 。
3.下列反应中生成物焓之和高于反应物焓之和的是
A.碳酸钙受热分解 B.乙醇燃烧
C.铝粉与氧化铁粉末反应 D.氧化钙溶于水
4.如图:表示的是12g石墨、金刚石分别过量O2反应生成CO2 的反应热图像
12g石墨与过量O2反应生成CO2的△H=- 393.51kJ/mol;
用____(填a或b)表示
12g金刚石与过量O2反应生成CO2 △H=- 395.41kJ/mol,
用____(填a或b)表示
试比较,石墨与金刚石哪个稳定?
5、2008年我国成功回收“神舟七号”载人飞船,这标志着“我国的载人航天事业又迈出了新的重要一步”:
⑴飞船返回时,由于与大气层的剧烈摩擦,产生高温。为了防止飞船温度过高,在飞船表面涂上一种特殊的涂料,该涂料的性质最可能的是 A.在高温下不融化 B.在高温下可分解气化
C.在常温下就分解气化 D.该涂料不可能发生分解
(2)火箭升空需要高能的燃料,肼(N2H4)是发射航天飞船常用的高能燃料。一般将液态N2O4作为火箭的推进剂。已知1mol液态肼与足量液态N2O4完全反应放出QkJ的热量,产物是对环境无害的氮气和水蒸气。该反应的反应热是多少?。该反应中被氧化的原子与被还原的原子物质的量之比是 。但实际发射过程中会看到有大量红色的烟雾,除了该反应可能产生少量NO外,产生此现象的原因可能是 。
变式训练 白磷与氧可发生如下反应:P4+5O2=P4O10。已知断裂下列化学键需要吸收的能量分别为:P—P a kJ·mol-1、P—O b kJ·mol-1、P=O c kJ·mol-1、O=O d kJ·mol-1。根据图示的分子结构和有关数据估算该反应的ΔH,其中正确的是( )
√
P—P a kJ·mol-1、P—O b kJ·mol-1、P=O c kJ·mol-1、O=O d kJ·mol-1
解析:选A。因为ΔH等于反应物化学键断裂吸收的能量总和减去生成物化学键形成释放的能量总和,即ΔH=E反应物-E生成物,根据反应方程式P4+5O2=P4O10和模型图分析可知,该反应的反应热ΔH=(6a+5d-4c-12b) kJ·mol-1,A正确。
一、反应热 焓变
1、定义:恒压条件下,反应的热效应等于焓变
2、符号:△H
3、单位:kJ/mol或kJmol-1
4、反应热表示方法:
△H为“+”或△H > 0 时为吸热反应;
△H为“一”或△H < 0 时为放热反应。
5、△H计算的三种表达式:
(1) △H = 生成的总能量 — 反应物的总能量
(2) △H = 反应物的键能之和 — 生成物的键能之和
小结
第一章 化学反应与能量
第一节 化学反应与能量变化
学习目标:
2.学会分析化学反应中能量变化的原 因和常见的能量转化形式。
1. 理解反应热和焓变的含义
“神七”飞天的动能是什么能转化而来的?
问题一:反应中为什么会有能量的变化?
问题二:什么叫放热反应,什么叫吸热反应?你能举例那些反应为放热或吸热反应?并将其归类。
常见的放热反应和吸热反应
放热反应
吸热反应
一、焓变、反应热
1、焓和焓变
2、反应热
2、在化学反应过程中吸收或放出的热量,叫做反应热,又称为“焓变”
1、焓:是与内能有关的物理量
焓变:生成物与反应物的焓值差
热力学中表示物质系统能量的一个状态函数,常用符号H表示。数值上等于系统的内能U加上压强p和体积V的乘积,即H=U+pV。
①反应热产生的微观原因
分组讨论
以1molH2 与1mol Cl2
反应生成 2molHCl
为例通过数据分析产
生反应热的微观原因
①反应热产生的微观原因
键
断裂
键
断裂
键形成
键形成
Cl2
HCl
能量
能量
(吸收能量)
旧分子
拆开
原子
(放出能量)
新分子
结合
吸收能量 < 放出能量
吸收能量 > 放出能量
放热反应
吸热反应
决定
②反应热产生的宏观原因
能量
能量
反应物
反应物
生成物
生成物
反应过程(I)
反应过程(II)
思考:I和II哪个是放热反应,哪个是吸热反应?
△H
△H
③反应热表示方法:
阅读第2-3页体系与环境的关系,借助图1-2,
讨论△H的“+”与“-”的理解。
反应热用符号“△H”表示,单位常采用kJ/mol或kJ·mol-1
思考
ΔH的正负值是如何规定的?参照体系是什么?
体系的能量如何变化?升高还是降低?
环境的能量如何变化?升高还是降低?
规定放热反应的ΔH 为“-”,是站在谁的角度?体系还是环境?
放热反应中
环境
+
-
能量
能量
反应物
反应物
生成物
生成物
△H
△H
反应体系的能量降低
反应体系的能量升高
ΔH <0
ΔH >0
1.1molC与1molH2O(g)反应生成lmol CO(g)和1mol H2(g),需要吸收131.5kJ的热量,该反应的反应热为△H= kJ/mol
2.拆开 lmol H—H键、lmol N-H键、lmolN≡N键分别需要的能量是436kJ、391kJ、946kJ,则1mol N2生成NH3的反应热为 ,1mol H2生成NH3的反应热为 。
3.下列反应中生成物焓之和高于反应物焓之和的是
A.碳酸钙受热分解 B.乙醇燃烧
C.铝粉与氧化铁粉末反应 D.氧化钙溶于水
4.如图:表示的是12g石墨、金刚石分别过量O2反应生成CO2 的反应热图像
12g石墨与过量O2反应生成CO2的△H=- 393.51kJ/mol;
用____(填a或b)表示
12g金刚石与过量O2反应生成CO2 △H=- 395.41kJ/mol,
用____(填a或b)表示
试比较,石墨与金刚石哪个稳定?
5、2008年我国成功回收“神舟七号”载人飞船,这标志着“我国的载人航天事业又迈出了新的重要一步”:
⑴飞船返回时,由于与大气层的剧烈摩擦,产生高温。为了防止飞船温度过高,在飞船表面涂上一种特殊的涂料,该涂料的性质最可能的是 A.在高温下不融化 B.在高温下可分解气化
C.在常温下就分解气化 D.该涂料不可能发生分解
(2)火箭升空需要高能的燃料,肼(N2H4)是发射航天飞船常用的高能燃料。一般将液态N2O4作为火箭的推进剂。已知1mol液态肼与足量液态N2O4完全反应放出QkJ的热量,产物是对环境无害的氮气和水蒸气。该反应的反应热是多少?。该反应中被氧化的原子与被还原的原子物质的量之比是 。但实际发射过程中会看到有大量红色的烟雾,除了该反应可能产生少量NO外,产生此现象的原因可能是 。
变式训练 白磷与氧可发生如下反应:P4+5O2=P4O10。已知断裂下列化学键需要吸收的能量分别为:P—P a kJ·mol-1、P—O b kJ·mol-1、P=O c kJ·mol-1、O=O d kJ·mol-1。根据图示的分子结构和有关数据估算该反应的ΔH,其中正确的是( )
√
P—P a kJ·mol-1、P—O b kJ·mol-1、P=O c kJ·mol-1、O=O d kJ·mol-1
解析:选A。因为ΔH等于反应物化学键断裂吸收的能量总和减去生成物化学键形成释放的能量总和,即ΔH=E反应物-E生成物,根据反应方程式P4+5O2=P4O10和模型图分析可知,该反应的反应热ΔH=(6a+5d-4c-12b) kJ·mol-1,A正确。
一、反应热 焓变
1、定义:恒压条件下,反应的热效应等于焓变
2、符号:△H
3、单位:kJ/mol或kJmol-1
4、反应热表示方法:
△H为“+”或△H > 0 时为吸热反应;
△H为“一”或△H < 0 时为放热反应。
5、△H计算的三种表达式:
(1) △H = 生成的总能量 — 反应物的总能量
(2) △H = 反应物的键能之和 — 生成物的键能之和
小结
