沪科版高二下学期-化学11认识碳氢化合物的多样性-烃类的计算B(共23张PPT)
文档属性
| 名称 | 沪科版高二下学期-化学11认识碳氢化合物的多样性-烃类的计算B(共23张PPT) |
|
|
| 格式 | zip | ||
| 文件大小 | 216.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-05-23 00:00:00 | ||
图片预览








文档简介
(共23张PPT)
烃类的计算
【提高】
知识导航
一、烃的分子式的确定
1.通式法
烷烃通式为CnH2n+2,烯烃通式为CnH2n,炔烃通式为CnH2n-2,苯及同系物的通式为CnH2n-6,可以根据已知条件,确定分子中的碳原子数(或分子量)再根据通式写出分子式。
一、烃的分子式的确定
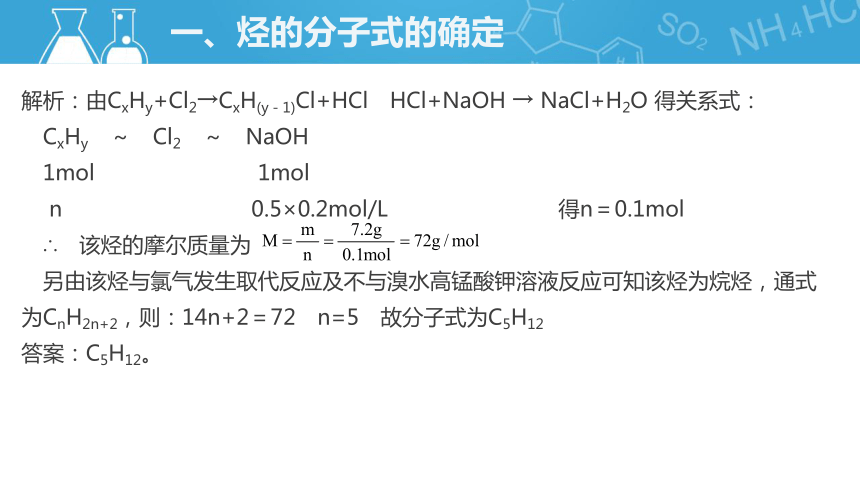
例1:某烃7.2g进行氯代反应完全转化为一氯化物时,放出的气体通入500mL0.2mol/L的烧碱溶液中,恰好完全反应,此烃不能使溴水或酸性高锰酸钾溶液褪色,试求该烃的分子式。
一、烃的分子式的确定
解析:由CxHy+Cl2→CxH(y-1)Cl+HCl HCl+NaOH → NaCl+H2O 得关系式:
CxHy ~ Cl2 ~ NaOH
1mol 1mol
n 0.5×0.2mol/L 得n=0.1mol
∴ 该烃的摩尔质量为
另由该烃与氯气发生取代反应及不与溴水高锰酸钾溶液反应可知该烃为烷烃,通式为CnH2n+2,则:14n+2=72 n=5 故分子式为C5H12
答案:C5H12。
一、烃的分子式的确定
2.平均分子式法
例2:某混合烃由两种气态烃组成,取2.24L混合烃燃烧后,得3.36LCO2和3.6gH2O,则关于混合烃的组成判断正确的是(气体体积均在标准状况下测定) ( )
A.一定含甲烷 B.一定有乙烷
C.一定是甲烷和乙烯的混合气体 D.可能是甲烷和丙炔的混合气体
一、烃的分子式的确定
解析:由题意可知:0.1mol混合烃生成0.15mol CO2和0.2mol H2O,则混合烃的平均分子式为:C1.5H4。由C原子平均个数分析知:其中必含碳原子小于1的烃,为甲烷,另一种烃的碳原子数大于4;由H分析:混合烃分子中平均H原子数为4,则另一种烃H原子数亦为4,可能为C2H4 、C3H4 、C4H4等。
答案:A、C。
一、烃的分子式的确定
混合烃计算规律小结:
(1)一般是设平均分子式,结合反应方程式和体积求出平均组成,利用平均值的含义确定混合烃可能的分子式。有时也利用平均分子量来确定可能的组成,此时,采用十字交叉法计算较为简捷。
(2)两混合烃,若平均分子量小于或等于26,则该烃中必含甲烷。
一、烃的分子式的确定
(3)两混合气态烃,充分燃烧后,生成CO2气体的体积小于2倍原混合烃的体积,则原混合烃中必有CH4;若生成水的物质的量小于2倍原混合烃的物质的量,则原混合烃中必有C2H2。
(4)温度在100℃以上,气体混合烃与足量的氧气充分燃烧后,若总体积保持不变,则原混合烃中的氢原子平均数为4;若体积扩大,则原混合烃中的氢原子平均数大于4;若体积缩小,则原混合烃中氢原子平均数小于4,必有C2H2。
一、烃的分子式的确定
3.讨论法
例3:25℃某气态烃与O2混合充入密闭容器中,点燃爆炸后恢复至25℃,此时容器内压强为原来的一半,再经NaOH溶液处理,容器内几乎成为真空。该烃的分子式可能为:
A. C2H4 B. C2H2 C. C3H6 D. C3H8
一、烃的分子式的确定
解析:由题意可知,该气态烃与O2恰好完全反应。设该烃的分子式为CxHy,则有:
压强变化可知,烃和O2的物质的量应为CO2的2倍(25℃时水为液态),
即: ,整理得:
讨论:当y=4,x=2;当y=6,x=2.5(不合,舍);当y=8,x=3,…
答案:A、D。
二、烃燃烧的规律及应用
烃燃烧通式:
二、烃燃烧的规律及应用
1.△V (气体反应物的体积减气体产物的体积) : 只与烃中的H原子数有关
(1) H2O ( l )
y任意, △V>0 体积减小 若燃烧生成液态水,气体体积一定减少
(2) H2O (g )
① 若y=4 , △V=0 体积不变 只有 CH4 、 C2H4 、C3H4
② 若y>4 , △V<0 体积增加
③ 若y<4 , △V>0 体积减小 只有 C2H2
二、烃燃烧的规律及应用
例4:amL三种气态烃的混合物与足量的氧气混合点燃爆炸后,恢复到原来的状态(常温、常压),体积共缩小2amL.则三种烃可能是( )
A.CH4、C2H4、C3H4 B.C2H6、C3H6、C4H6
C.CH4、C2H6、C3H6 D.C2H4、C2H2、CH4
二、烃燃烧的规律及应用
解析:设混合烃的平均组成为CxHy
△V
1
a 2a
解得y=4,即混合气体中平均含有4个H,故选A。
答案:A。
二、烃燃烧的规律及应用
2. 总质量一定,两种有机物以任意比混合:
(1)若含碳的质量分数相同,完全燃烧后产生CO2的量是一个定值;
(2)若含氢的质量分数相同,完全燃烧后产生H2O的量是一个定值;
(3)若最简式相同, 完全燃烧后产生CO2和H2O的量都是一个定值。
二、烃燃烧的规律及应用
例5:下列各组物质不论二者以何比例混合,只要总质量一定,则完全燃烧后,耗氧量和生成水的质量都不变的是 ( )
A.CH4 C2H6 B.C2H6 C3H6
C. C2H4 C3H6 D.C2H2 C6H6
二、烃燃烧的规律及应用
解析:无论以何种比例混合,只要混合物的总质量一定,完全燃烧时消耗O2的质量不变,说明混合物各烃的最简式相同;完全燃烧生成H2O的质量也一定,则说明混合物各烃分子中含氢量相等,故混合物中各烃满足最简式相同即可。
答案:CD
课堂练习
1.10.0 mL 某气态烃在 50.0 mL O2 中充分燃烧,得到液态水和 35.0 mL 的气体混合物(所有气体的体积都是在同温同压下测得的),则该气态烃可能是( )
A.CH4 B.C2H6 C.C3H8 D.C3H6
课堂练习
1.10.0 mL 某气态烃在 50.0 mL O2 中充分燃烧,得到液态水和 35.0 mL 的气体混合物(所有气体的体积都是在同温同压下测得的),则该气态烃可能是( )
A.CH4 B.C2H6 C.C3H8 D.C3H6
解析:用体积差进行计算:
V前-V后
1
10.0 ml 10.0+50.0-35.0=25.0 ml
y = 6
答案:BD
课堂练习
2.含碳、氢的物质充分燃烧后会生成二氧化碳和水.下列各组物质以任意比混合充分燃烧后,产生CO2分子数目一定比H2O分子数目多的是( )
A.CH4和C2H4 B.CO和H2
C.CH4和CO D.C2H4和C2H2
四、烃类完全燃烧的耗氧量规律
2.含碳、氢的物质充分燃烧后会生成二氧化碳和水.下列各组物质以任意比混合充分燃烧后,产生CO2分子数目一定比H2O分子数目多的是( )
A.CH4和C2H4 B.CO和H2
C.CH4和CO D.C2H4和C2H2
解析:由质量守恒定律可知,产生的CO2分子数目一定比H2O分子数目多,说明C原子要比H原子的一半要多。
A、CH4和C2H4,两者以一定比例混合,C原子的量可能少于H原子的一半;
B、如果是大量H2和少量CO,产生的CO2分子数目不一定比H2O分子数目多;
C、如果大量CH4和少量CO,产生的CO2分子数目不一定比H2O分子数目多;
D、C2H4和C2H2,无论两者以何种比例混合,C原子数量永远比H原子数量的一半多
答案:D。
下节课再见
烃类的计算
【提高】
知识导航
一、烃的分子式的确定
1.通式法
烷烃通式为CnH2n+2,烯烃通式为CnH2n,炔烃通式为CnH2n-2,苯及同系物的通式为CnH2n-6,可以根据已知条件,确定分子中的碳原子数(或分子量)再根据通式写出分子式。
一、烃的分子式的确定
例1:某烃7.2g进行氯代反应完全转化为一氯化物时,放出的气体通入500mL0.2mol/L的烧碱溶液中,恰好完全反应,此烃不能使溴水或酸性高锰酸钾溶液褪色,试求该烃的分子式。
一、烃的分子式的确定
解析:由CxHy+Cl2→CxH(y-1)Cl+HCl HCl+NaOH → NaCl+H2O 得关系式:
CxHy ~ Cl2 ~ NaOH
1mol 1mol
n 0.5×0.2mol/L 得n=0.1mol
∴ 该烃的摩尔质量为
另由该烃与氯气发生取代反应及不与溴水高锰酸钾溶液反应可知该烃为烷烃,通式为CnH2n+2,则:14n+2=72 n=5 故分子式为C5H12
答案:C5H12。
一、烃的分子式的确定
2.平均分子式法
例2:某混合烃由两种气态烃组成,取2.24L混合烃燃烧后,得3.36LCO2和3.6gH2O,则关于混合烃的组成判断正确的是(气体体积均在标准状况下测定) ( )
A.一定含甲烷 B.一定有乙烷
C.一定是甲烷和乙烯的混合气体 D.可能是甲烷和丙炔的混合气体
一、烃的分子式的确定
解析:由题意可知:0.1mol混合烃生成0.15mol CO2和0.2mol H2O,则混合烃的平均分子式为:C1.5H4。由C原子平均个数分析知:其中必含碳原子小于1的烃,为甲烷,另一种烃的碳原子数大于4;由H分析:混合烃分子中平均H原子数为4,则另一种烃H原子数亦为4,可能为C2H4 、C3H4 、C4H4等。
答案:A、C。
一、烃的分子式的确定
混合烃计算规律小结:
(1)一般是设平均分子式,结合反应方程式和体积求出平均组成,利用平均值的含义确定混合烃可能的分子式。有时也利用平均分子量来确定可能的组成,此时,采用十字交叉法计算较为简捷。
(2)两混合烃,若平均分子量小于或等于26,则该烃中必含甲烷。
一、烃的分子式的确定
(3)两混合气态烃,充分燃烧后,生成CO2气体的体积小于2倍原混合烃的体积,则原混合烃中必有CH4;若生成水的物质的量小于2倍原混合烃的物质的量,则原混合烃中必有C2H2。
(4)温度在100℃以上,气体混合烃与足量的氧气充分燃烧后,若总体积保持不变,则原混合烃中的氢原子平均数为4;若体积扩大,则原混合烃中的氢原子平均数大于4;若体积缩小,则原混合烃中氢原子平均数小于4,必有C2H2。
一、烃的分子式的确定
3.讨论法
例3:25℃某气态烃与O2混合充入密闭容器中,点燃爆炸后恢复至25℃,此时容器内压强为原来的一半,再经NaOH溶液处理,容器内几乎成为真空。该烃的分子式可能为:
A. C2H4 B. C2H2 C. C3H6 D. C3H8
一、烃的分子式的确定
解析:由题意可知,该气态烃与O2恰好完全反应。设该烃的分子式为CxHy,则有:
压强变化可知,烃和O2的物质的量应为CO2的2倍(25℃时水为液态),
即: ,整理得:
讨论:当y=4,x=2;当y=6,x=2.5(不合,舍);当y=8,x=3,…
答案:A、D。
二、烃燃烧的规律及应用
烃燃烧通式:
二、烃燃烧的规律及应用
1.△V (气体反应物的体积减气体产物的体积) : 只与烃中的H原子数有关
(1) H2O ( l )
y任意, △V>0 体积减小 若燃烧生成液态水,气体体积一定减少
(2) H2O (g )
① 若y=4 , △V=0 体积不变 只有 CH4 、 C2H4 、C3H4
② 若y>4 , △V<0 体积增加
③ 若y<4 , △V>0 体积减小 只有 C2H2
二、烃燃烧的规律及应用
例4:amL三种气态烃的混合物与足量的氧气混合点燃爆炸后,恢复到原来的状态(常温、常压),体积共缩小2amL.则三种烃可能是( )
A.CH4、C2H4、C3H4 B.C2H6、C3H6、C4H6
C.CH4、C2H6、C3H6 D.C2H4、C2H2、CH4
二、烃燃烧的规律及应用
解析:设混合烃的平均组成为CxHy
△V
1
a 2a
解得y=4,即混合气体中平均含有4个H,故选A。
答案:A。
二、烃燃烧的规律及应用
2. 总质量一定,两种有机物以任意比混合:
(1)若含碳的质量分数相同,完全燃烧后产生CO2的量是一个定值;
(2)若含氢的质量分数相同,完全燃烧后产生H2O的量是一个定值;
(3)若最简式相同, 完全燃烧后产生CO2和H2O的量都是一个定值。
二、烃燃烧的规律及应用
例5:下列各组物质不论二者以何比例混合,只要总质量一定,则完全燃烧后,耗氧量和生成水的质量都不变的是 ( )
A.CH4 C2H6 B.C2H6 C3H6
C. C2H4 C3H6 D.C2H2 C6H6
二、烃燃烧的规律及应用
解析:无论以何种比例混合,只要混合物的总质量一定,完全燃烧时消耗O2的质量不变,说明混合物各烃的最简式相同;完全燃烧生成H2O的质量也一定,则说明混合物各烃分子中含氢量相等,故混合物中各烃满足最简式相同即可。
答案:CD
课堂练习
1.10.0 mL 某气态烃在 50.0 mL O2 中充分燃烧,得到液态水和 35.0 mL 的气体混合物(所有气体的体积都是在同温同压下测得的),则该气态烃可能是( )
A.CH4 B.C2H6 C.C3H8 D.C3H6
课堂练习
1.10.0 mL 某气态烃在 50.0 mL O2 中充分燃烧,得到液态水和 35.0 mL 的气体混合物(所有气体的体积都是在同温同压下测得的),则该气态烃可能是( )
A.CH4 B.C2H6 C.C3H8 D.C3H6
解析:用体积差进行计算:
V前-V后
1
10.0 ml 10.0+50.0-35.0=25.0 ml
y = 6
答案:BD
课堂练习
2.含碳、氢的物质充分燃烧后会生成二氧化碳和水.下列各组物质以任意比混合充分燃烧后,产生CO2分子数目一定比H2O分子数目多的是( )
A.CH4和C2H4 B.CO和H2
C.CH4和CO D.C2H4和C2H2
四、烃类完全燃烧的耗氧量规律
2.含碳、氢的物质充分燃烧后会生成二氧化碳和水.下列各组物质以任意比混合充分燃烧后,产生CO2分子数目一定比H2O分子数目多的是( )
A.CH4和C2H4 B.CO和H2
C.CH4和CO D.C2H4和C2H2
解析:由质量守恒定律可知,产生的CO2分子数目一定比H2O分子数目多,说明C原子要比H原子的一半要多。
A、CH4和C2H4,两者以一定比例混合,C原子的量可能少于H原子的一半;
B、如果是大量H2和少量CO,产生的CO2分子数目不一定比H2O分子数目多;
C、如果大量CH4和少量CO,产生的CO2分子数目不一定比H2O分子数目多;
D、C2H4和C2H2,无论两者以何种比例混合,C原子数量永远比H原子数量的一半多
答案:D。
下节课再见
