人教化学选修4第二章第二节 影响化学反应速率的因素 课件 (共23张PPT)
文档属性
| 名称 | 人教化学选修4第二章第二节 影响化学反应速率的因素 课件 (共23张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 775.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-05-25 22:55:51 | ||
图片预览








文档简介
(共23张PPT)
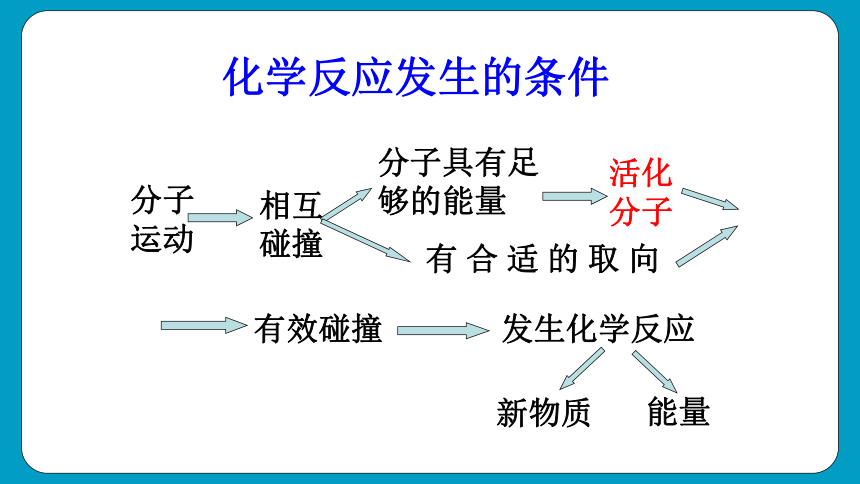
分子运动
相互碰撞
分子具有足够的能量
活化分子
有 合 适 的 取 向
有效碰撞
发生化学反应
化学反应发生的条件
新物质
能量
活化分子与化学反应速率:
单位体积内活化分子越多,有效碰撞产生的概率越大,反应速率也就越快。
化学反应速率与单位时间内分子间的有效碰撞次数(有效碰撞频率)有关。
影响化学反应速率的因素
内因:反应物本身的性质 (主要)
外因:浓度、压强、温度、催化剂等
0.01mol/L的KMnO4 酸性溶液
0.1mol/LH2C2O4溶液
0.2mol/LH2C2O4溶液
【P20实验2-2】 不同浓度草酸与酸性高锰酸钾溶液的反应
2KMnO4 + 5H2C2O4 +3H2SO4=K2SO4 +2MnSO4 +10CO2↑+8H2O
【想一想】
一、浓度对反应速率的影响
如果用KMnO4与H2C2O4反应设计实验,探究浓度对反应速率的影响,可以从哪些角度进行?
【做一做】
请设计实验,探究浓度对反应速率的影响。
可选试剂:0.01mol/L KMnO4 (H+)、0.1mol/L H2C2O4 、0.2mol/L H2C2O4
【思考】
1、本实验能够根据溶液褪色所需时间的长短的依 据是什么?
2、能否将KMnO4和H2C2O4溶液浓度对调?
3、若无计时工具,应如何操作?
[实验步骤]
1、取两支试管向其中各加入4滴管 0.005mol/L的 KMnO4溶液;
2、再向其中各加入1滴管10mol/L的浓硫酸;
3、另两支小试管向其中分别加入2滴管 0.1mol/L H2C2O4溶液和 0.2mol/L H2C2O4溶液;
4、同时将小试管里的H2C2O4溶液倒入酸化后的KMnO4溶液中;
5、振荡试管,观察两支试管中的实验现象。
0.01mol/L的KMnO4 酸性溶液
0.1mol/LH2C2O4溶液
0.2mol/LH2C2O4溶液
快
慢
【P20实验2-2】 不同浓度草酸与酸性高锰酸钾溶液的反应
2KMnO4 + 5H2C2O4 +3H2SO4=K2SO4 +2MnSO4 +10CO2↑+8H2O
(1)结论:
减小反应物的浓度,化学反应速率减慢。
当其他条件不变时,增大反应物的浓度,化学反应速率加快。
可以用碰撞理论阐释原因吗?
反应物浓度增大:即单位体积内反应物分子总数增大
单位体积内活化分子数增加(活%不变)
有效碰撞几率增多
反应速率加快
1、浓度对反应速率的影响
【注意】
a.此规律只适用于气体和溶液,反应物是纯液体或固体,其浓度视为常数,因此改变它们的量反应速率不变。
b. 一般来说,固体反应物表面积越大,反应速率越大。
【思考】
若实验室只有0.2mol/L的H2C2O4溶液,请设计实验:
实验 0.005mol/LKMnO4(H+) 0.2mol/LH2C2O4
1 4mL 1mL
2 4mL 2mL
水
1mL
0mL
这样设计是否可行?
2、压强对反应速率的影响
压强增大:相当于增大反应物浓度
单位体积内活化分子数增加(活%不变)
有效碰撞几率增多
反应速率加快
2、压强对反应速率的影响
对于有气体的反应
增大压强相当于增大气体的浓度,反应速率加快;
减小压强相当于减小气体的浓度,反应速率减慢。
若其它条件不变时,
【注意】
a. 压强对固体和液体(溶液)间的反应的影响可忽略
b. 注意“真”变和“假”变。
若体系的压强变化,引起反应物的浓度发生变化即“真”变,否则是“假”变。
【讨论】
在N2+3H2 2NH3中,当其他外界条件不变时:
① 增大体系压强,反应的速率怎么变?
② 在反应中保持体系容积不变,充入N2 ,反应
的速率怎么变?
③ 在反应中保持体系容积不变,充入He,反应
的速率怎么变?
④ 在反应中保持体系压强不变,充入He,反应
的速率怎么变?
小结:惰性气体对反应速率的影响
(1)如果保持恒温恒容,加入惰性气体后,反应物的浓度 ,因此对反应速率 。
(2)如果恒温恒压,加入惰性气体后,反应体系体积 ,反应物的浓度 ,因此反应速率会 。
不变
增大
减小
减小
外界条件改变 单位体积内分子总数 反应的活化能 活化分子百分数
单位体积内活化分子总数
有效碰撞次数 化学反应速率
增大反应物
浓度
增大气体反应 压強
升高温度
使用催化剂
增大
不变
增多
加快
增大
不变
增多
加快
增多
增多
不变
不变
实验 KMnO4 H2C2O4 水
C(mol/L) V(mL) C(mol/L) V(mL) V(mL)
(1) 0.01 10 0.2 5 5
(2) 0.02 5 0.1 5 10
1、请比较两组实验的快慢:
若实验(1)溶液颜色褪去,用时tmin,请用KMnO4的浓度变化表示该实验的反应速率
2、一定条件下,在CaCO3(块状)+2HCl=CaCl2+H2O+CO2?反应中,为了加快反应的速率,下列那些方法可行:
A、增加HCl的浓度 B、加水
C、增加同浓度盐酸的量 D、改加CaCO3粉末
3、如反应:3KSCN+FeCl3 = Fe(SCN)3+3KCl
若在上述体系中加入KCl晶体,会不会影响化学反应速率?
因为反应实质为:Fe3++3SCN- = Fe(SCN)3
AD
如果加KCl溶液晶体呢?FeCl3呢?
4、把下列四种X溶液,分别加进四个盛有10mL、2mol/L的盐酸的烧杯中,并且均加水稀释至50mL,此时,X和盐酸缓缓地进行反应,其中反应速率最快的是( )
A 10mL 2mol/L B 20mL 2mol/L
C 10mL 4mol/L D 20mL 3mol/L
D
5、某探究小组利用丙酮的溴代反应
来研究反应物浓度与反应速率的关系。反应速率v(Br2)通过测定溴的颜色消失所需的时间来确定。在一定温度下,获得如下实验数据:
分析实验数据所得出的结论不正确的是( )
A.增大c(CH3COCH3),v(Br2)增大 B.实验②和③的v(Br2)相等
C.增大c(HCl),v(Br2)增大 D.增大c(Br2),v(Br2)增大
(CH3COCH3+Br2 CH3COCH2Br+HBr)
D
谢谢大家!
分子运动
相互碰撞
分子具有足够的能量
活化分子
有 合 适 的 取 向
有效碰撞
发生化学反应
化学反应发生的条件
新物质
能量
活化分子与化学反应速率:
单位体积内活化分子越多,有效碰撞产生的概率越大,反应速率也就越快。
化学反应速率与单位时间内分子间的有效碰撞次数(有效碰撞频率)有关。
影响化学反应速率的因素
内因:反应物本身的性质 (主要)
外因:浓度、压强、温度、催化剂等
0.01mol/L的KMnO4 酸性溶液
0.1mol/LH2C2O4溶液
0.2mol/LH2C2O4溶液
【P20实验2-2】 不同浓度草酸与酸性高锰酸钾溶液的反应
2KMnO4 + 5H2C2O4 +3H2SO4=K2SO4 +2MnSO4 +10CO2↑+8H2O
【想一想】
一、浓度对反应速率的影响
如果用KMnO4与H2C2O4反应设计实验,探究浓度对反应速率的影响,可以从哪些角度进行?
【做一做】
请设计实验,探究浓度对反应速率的影响。
可选试剂:0.01mol/L KMnO4 (H+)、0.1mol/L H2C2O4 、0.2mol/L H2C2O4
【思考】
1、本实验能够根据溶液褪色所需时间的长短的依 据是什么?
2、能否将KMnO4和H2C2O4溶液浓度对调?
3、若无计时工具,应如何操作?
[实验步骤]
1、取两支试管向其中各加入4滴管 0.005mol/L的 KMnO4溶液;
2、再向其中各加入1滴管10mol/L的浓硫酸;
3、另两支小试管向其中分别加入2滴管 0.1mol/L H2C2O4溶液和 0.2mol/L H2C2O4溶液;
4、同时将小试管里的H2C2O4溶液倒入酸化后的KMnO4溶液中;
5、振荡试管,观察两支试管中的实验现象。
0.01mol/L的KMnO4 酸性溶液
0.1mol/LH2C2O4溶液
0.2mol/LH2C2O4溶液
快
慢
【P20实验2-2】 不同浓度草酸与酸性高锰酸钾溶液的反应
2KMnO4 + 5H2C2O4 +3H2SO4=K2SO4 +2MnSO4 +10CO2↑+8H2O
(1)结论:
减小反应物的浓度,化学反应速率减慢。
当其他条件不变时,增大反应物的浓度,化学反应速率加快。
可以用碰撞理论阐释原因吗?
反应物浓度增大:即单位体积内反应物分子总数增大
单位体积内活化分子数增加(活%不变)
有效碰撞几率增多
反应速率加快
1、浓度对反应速率的影响
【注意】
a.此规律只适用于气体和溶液,反应物是纯液体或固体,其浓度视为常数,因此改变它们的量反应速率不变。
b. 一般来说,固体反应物表面积越大,反应速率越大。
【思考】
若实验室只有0.2mol/L的H2C2O4溶液,请设计实验:
实验 0.005mol/LKMnO4(H+) 0.2mol/LH2C2O4
1 4mL 1mL
2 4mL 2mL
水
1mL
0mL
这样设计是否可行?
2、压强对反应速率的影响
压强增大:相当于增大反应物浓度
单位体积内活化分子数增加(活%不变)
有效碰撞几率增多
反应速率加快
2、压强对反应速率的影响
对于有气体的反应
增大压强相当于增大气体的浓度,反应速率加快;
减小压强相当于减小气体的浓度,反应速率减慢。
若其它条件不变时,
【注意】
a. 压强对固体和液体(溶液)间的反应的影响可忽略
b. 注意“真”变和“假”变。
若体系的压强变化,引起反应物的浓度发生变化即“真”变,否则是“假”变。
【讨论】
在N2+3H2 2NH3中,当其他外界条件不变时:
① 增大体系压强,反应的速率怎么变?
② 在反应中保持体系容积不变,充入N2 ,反应
的速率怎么变?
③ 在反应中保持体系容积不变,充入He,反应
的速率怎么变?
④ 在反应中保持体系压强不变,充入He,反应
的速率怎么变?
小结:惰性气体对反应速率的影响
(1)如果保持恒温恒容,加入惰性气体后,反应物的浓度 ,因此对反应速率 。
(2)如果恒温恒压,加入惰性气体后,反应体系体积 ,反应物的浓度 ,因此反应速率会 。
不变
增大
减小
减小
外界条件改变 单位体积内分子总数 反应的活化能 活化分子百分数
单位体积内活化分子总数
有效碰撞次数 化学反应速率
增大反应物
浓度
增大气体反应 压強
升高温度
使用催化剂
增大
不变
增多
加快
增大
不变
增多
加快
增多
增多
不变
不变
实验 KMnO4 H2C2O4 水
C(mol/L) V(mL) C(mol/L) V(mL) V(mL)
(1) 0.01 10 0.2 5 5
(2) 0.02 5 0.1 5 10
1、请比较两组实验的快慢:
若实验(1)溶液颜色褪去,用时tmin,请用KMnO4的浓度变化表示该实验的反应速率
2、一定条件下,在CaCO3(块状)+2HCl=CaCl2+H2O+CO2?反应中,为了加快反应的速率,下列那些方法可行:
A、增加HCl的浓度 B、加水
C、增加同浓度盐酸的量 D、改加CaCO3粉末
3、如反应:3KSCN+FeCl3 = Fe(SCN)3+3KCl
若在上述体系中加入KCl晶体,会不会影响化学反应速率?
因为反应实质为:Fe3++3SCN- = Fe(SCN)3
AD
如果加KCl溶液晶体呢?FeCl3呢?
4、把下列四种X溶液,分别加进四个盛有10mL、2mol/L的盐酸的烧杯中,并且均加水稀释至50mL,此时,X和盐酸缓缓地进行反应,其中反应速率最快的是( )
A 10mL 2mol/L B 20mL 2mol/L
C 10mL 4mol/L D 20mL 3mol/L
D
5、某探究小组利用丙酮的溴代反应
来研究反应物浓度与反应速率的关系。反应速率v(Br2)通过测定溴的颜色消失所需的时间来确定。在一定温度下,获得如下实验数据:
分析实验数据所得出的结论不正确的是( )
A.增大c(CH3COCH3),v(Br2)增大 B.实验②和③的v(Br2)相等
C.增大c(HCl),v(Br2)增大 D.增大c(Br2),v(Br2)增大
(CH3COCH3+Br2 CH3COCH2Br+HBr)
D
谢谢大家!
