人教版高二化学选修4第一章第2节燃烧热 能源(共15张PPT)
文档属性
| 名称 | 人教版高二化学选修4第一章第2节燃烧热 能源(共15张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 2.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-05-26 21:51:25 | ||
图片预览






文档简介
(共15张PPT)
化学
人教版
高一
选修四
第一章
化学反应与能量
燃烧热
1.
实验测得25℃、101kPa时,1mol
C完全燃烧放出393.5
kJ的热量。
2.
实验测得25℃、101kPa时,1mol
H2完全燃烧放出285.8
kJ的热量。
(练习与巩固)
依据事实,写出下列反应的热化学方程式∶
这就是C的燃烧热
C(s)+O2(g)=CO2(g)
ΔH=-393.5kJ/mol
这就是H2的燃烧热
H2(g)+1/2O2(g)=H2O(l)
ΔH=-285.8
kJ/mol
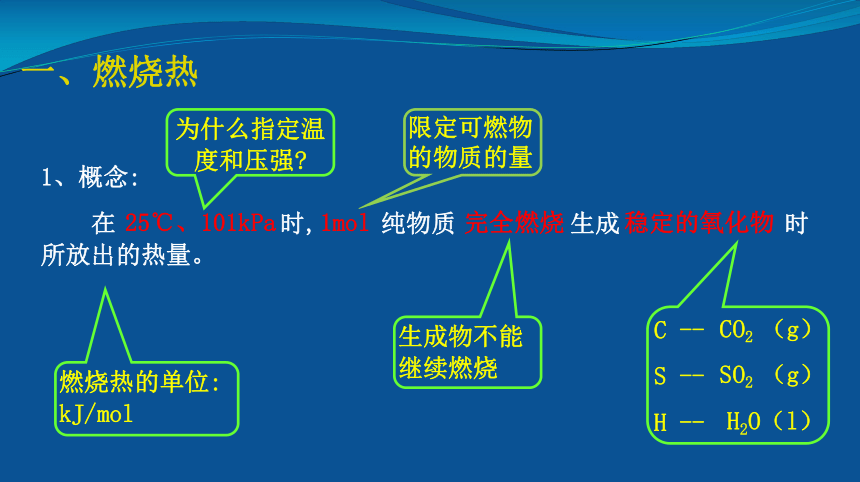
一、燃烧热
1、概念:
在
时,
纯物质
生成
时所放出的热量。
为什么指定温度和压强?
生成物不能继续燃烧
C
--
S
--
H
--
燃烧热的单位:
kJ/mol
限定可燃物的物质的量
25℃、101kPa
1mol
完全燃烧
稳定的氧化物
CO2
(g)
SO2
(g)
H2O(l)
一、燃烧热
1.概念:
在
时,1mol纯物质完全燃烧生成稳定的氧化物时所放出的热量。
2.说明:
Ⅰ、反应条件:
Ⅱ、可燃物用量:
Ⅲ、反应程度:
25℃、101kPa
25℃、101kPa
1mol
完全燃烧,生成稳定的氧化物
如:C→C02
(g)
,H→H20(l),S→S02
(g)等
思考:
甲烷的
燃烧热
为890.31
kJ/mol,
或
ΔH=-890.31
kJ/mol
所表示的含义
甲烷燃烧热的热化学方程式:
CH4(g)+2O2(g)=CO2(g)+2H2O(l)
△H=-890.31KJ/mol
例:文字表述——CH4的燃烧热为890.3
kJ/mol
符号表示——△H=
-890.3
kJ/mol
例:文字表述——H2的燃烧热为285.8
kJ/mol
符号表示——△H=
-285.8
kJ/mol
燃烧热是反应热的一种。
文字表述时使用“正值”,但用△H表示时必须注明符号
对比下列燃烧热的表示方法,从中你可获得哪些提示?
3.表示方法:
文字表述或用△H
4.燃烧热的热化学方程式的书写:
注意:应以1mol可燃物为标准来配平,其余物质的化学计量数常出现分数
5.计算:
放出的热量
与
的关系:
Q放=
n(可燃物)
×
︱△H
︳
注:以上
△H
均指燃烧热
△H
【例】?
葡萄糖是人体所需能量的重要来源之一。葡萄糖燃烧热的热化学方程式为:
C6H12O6(s)+6O2(g)=
6CO2(g)+6H2O(l)
ΔH=-2
800
kJ/mol
葡萄糖在人体组织中氧化的热化学方程式与它燃烧热的热化学方程式相同。
计算
360
g葡萄糖在人体中完全氧化时所产生的热量。
5600kJ
★燃烧热与中和热的区别与联系
相
同
点
燃烧热
中和热
能量变化
放热反应
ΔH
ΔH<0
,
单位
kJ/mol
不
同
点
反应物的量
1mol可燃物
不限量
生成物的量
不限量
1mol
H2O
反应热
的含义
1mol反应物完全燃烧时放出的热量;不同的物质燃烧热不同
在稀溶液中,酸碱中和生成1molH2O时放出的热量;强酸与强
碱的中和反应,中和热大致相同,
均约为57.3kJ/mol
小结
燃烧热:
1.概念
2.说明
3.表示方法
4.燃烧热的热化学方程式的书写
5.燃烧热的计算
补充练习
1.下列说法中正确的是( )
A.物质燃烧放出的热量是燃烧热
B.1
mol
C燃烧生成CO时放出的热量就是C的燃烧热
C.1
mol
H2燃烧生成水时放出的热量是H2的燃烧热
D.相同条件下,1
mol
H2O(l)完全分解吸收的热量与H2、O2化合生成1
mol
H2O(l)放出的热量值相等
D
2.
25
℃、101
kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5
kJ/mol、285.8
kJ/mol、890.31
kJ/mol、2
800
kJ/mol,则下列热化学方程式正确的是( )
A.C(s)+O2(g)===CO(g)
ΔH=-393.5
kJ/mol
B.2H2(g)+O2(g)===2H2O(g)
ΔH=-571.6
kJ/mol
C.CH4(g)+2O2(g)===CO2(g)+2H2O(g)
ΔH=-890.31
kJ/mol
D.C6H12O6(s)+3O2(g)===3CO2(g)+3H2O(l) ΔH=-1
400
kJ/mol
D
3.已知:
①25
℃、101
kPa时,2C(s)+O2(g)===2CO(g)
ΔH=-221
kJ·mol-1
②稀溶液中,H+(aq)+OH-(aq)===H2O(l)
ΔH=-57.3
kJ·mol-1
又已知稀醋酸电离吸热。
下列结论正确的是( )
A.C的燃烧热大于110.5
kJ·mol-1
B.①的反应热为221
kJ·mol-1
C.稀硫酸与稀NaOH溶液反应的中和热为-57.3
kJ/mol
D.稀醋酸与稀NaOH溶液反应生成1
mol水,放出57.3
kJ的热量
A
4.乙醇是未来内燃机的首选环保型液体燃料,它可以由绿色植物的秸秆制取,1.0
g乙醇完全燃烧生成液态水放出约30kJ热量,表示乙醇燃烧热的热化学方程式为
.
C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(l)
ΔH=-1380kJ/mol
化学
人教版
高一
选修四
第一章
化学反应与能量
燃烧热
1.
实验测得25℃、101kPa时,1mol
C完全燃烧放出393.5
kJ的热量。
2.
实验测得25℃、101kPa时,1mol
H2完全燃烧放出285.8
kJ的热量。
(练习与巩固)
依据事实,写出下列反应的热化学方程式∶
这就是C的燃烧热
C(s)+O2(g)=CO2(g)
ΔH=-393.5kJ/mol
这就是H2的燃烧热
H2(g)+1/2O2(g)=H2O(l)
ΔH=-285.8
kJ/mol
一、燃烧热
1、概念:
在
时,
纯物质
生成
时所放出的热量。
为什么指定温度和压强?
生成物不能继续燃烧
C
--
S
--
H
--
燃烧热的单位:
kJ/mol
限定可燃物的物质的量
25℃、101kPa
1mol
完全燃烧
稳定的氧化物
CO2
(g)
SO2
(g)
H2O(l)
一、燃烧热
1.概念:
在
时,1mol纯物质完全燃烧生成稳定的氧化物时所放出的热量。
2.说明:
Ⅰ、反应条件:
Ⅱ、可燃物用量:
Ⅲ、反应程度:
25℃、101kPa
25℃、101kPa
1mol
完全燃烧,生成稳定的氧化物
如:C→C02
(g)
,H→H20(l),S→S02
(g)等
思考:
甲烷的
燃烧热
为890.31
kJ/mol,
或
ΔH=-890.31
kJ/mol
所表示的含义
甲烷燃烧热的热化学方程式:
CH4(g)+2O2(g)=CO2(g)+2H2O(l)
△H=-890.31KJ/mol
例:文字表述——CH4的燃烧热为890.3
kJ/mol
符号表示——△H=
-890.3
kJ/mol
例:文字表述——H2的燃烧热为285.8
kJ/mol
符号表示——△H=
-285.8
kJ/mol
燃烧热是反应热的一种。
文字表述时使用“正值”,但用△H表示时必须注明符号
对比下列燃烧热的表示方法,从中你可获得哪些提示?
3.表示方法:
文字表述或用△H
4.燃烧热的热化学方程式的书写:
注意:应以1mol可燃物为标准来配平,其余物质的化学计量数常出现分数
5.计算:
放出的热量
与
的关系:
Q放=
n(可燃物)
×
︱△H
︳
注:以上
△H
均指燃烧热
△H
【例】?
葡萄糖是人体所需能量的重要来源之一。葡萄糖燃烧热的热化学方程式为:
C6H12O6(s)+6O2(g)=
6CO2(g)+6H2O(l)
ΔH=-2
800
kJ/mol
葡萄糖在人体组织中氧化的热化学方程式与它燃烧热的热化学方程式相同。
计算
360
g葡萄糖在人体中完全氧化时所产生的热量。
5600kJ
★燃烧热与中和热的区别与联系
相
同
点
燃烧热
中和热
能量变化
放热反应
ΔH
ΔH<0
,
单位
kJ/mol
不
同
点
反应物的量
1mol可燃物
不限量
生成物的量
不限量
1mol
H2O
反应热
的含义
1mol反应物完全燃烧时放出的热量;不同的物质燃烧热不同
在稀溶液中,酸碱中和生成1molH2O时放出的热量;强酸与强
碱的中和反应,中和热大致相同,
均约为57.3kJ/mol
小结
燃烧热:
1.概念
2.说明
3.表示方法
4.燃烧热的热化学方程式的书写
5.燃烧热的计算
补充练习
1.下列说法中正确的是( )
A.物质燃烧放出的热量是燃烧热
B.1
mol
C燃烧生成CO时放出的热量就是C的燃烧热
C.1
mol
H2燃烧生成水时放出的热量是H2的燃烧热
D.相同条件下,1
mol
H2O(l)完全分解吸收的热量与H2、O2化合生成1
mol
H2O(l)放出的热量值相等
D
2.
25
℃、101
kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5
kJ/mol、285.8
kJ/mol、890.31
kJ/mol、2
800
kJ/mol,则下列热化学方程式正确的是( )
A.C(s)+O2(g)===CO(g)
ΔH=-393.5
kJ/mol
B.2H2(g)+O2(g)===2H2O(g)
ΔH=-571.6
kJ/mol
C.CH4(g)+2O2(g)===CO2(g)+2H2O(g)
ΔH=-890.31
kJ/mol
D.C6H12O6(s)+3O2(g)===3CO2(g)+3H2O(l) ΔH=-1
400
kJ/mol
D
3.已知:
①25
℃、101
kPa时,2C(s)+O2(g)===2CO(g)
ΔH=-221
kJ·mol-1
②稀溶液中,H+(aq)+OH-(aq)===H2O(l)
ΔH=-57.3
kJ·mol-1
又已知稀醋酸电离吸热。
下列结论正确的是( )
A.C的燃烧热大于110.5
kJ·mol-1
B.①的反应热为221
kJ·mol-1
C.稀硫酸与稀NaOH溶液反应的中和热为-57.3
kJ/mol
D.稀醋酸与稀NaOH溶液反应生成1
mol水,放出57.3
kJ的热量
A
4.乙醇是未来内燃机的首选环保型液体燃料,它可以由绿色植物的秸秆制取,1.0
g乙醇完全燃烧生成液态水放出约30kJ热量,表示乙醇燃烧热的热化学方程式为
.
C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(l)
ΔH=-1380kJ/mol
