2019-2020学年第二学期高中化学同步新突破人教必修2:2.2 化学能与电能【自主预习、课堂达标】
文档属性
| 名称 | 2019-2020学年第二学期高中化学同步新突破人教必修2:2.2 化学能与电能【自主预习、课堂达标】 |  | |
| 格式 | zip | ||
| 文件大小 | 661.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-05-26 21:59:39 | ||
图片预览




文档简介
人教版必修2:
——化学能与电能
一、一次能源和二次能源
能源类别
概念
举例
说明
一次能源
直接从自然界中取得的能源
流水、风力、原煤、石油、天然气、天然铀矿
煤、石油和天然气通称为化石燃料
二次能源
一次能源经加工转换得到的能源
电力、蒸汽等
电能是应用最广泛、使用最方便、污染最小的二次能源
二、化学能转化为电能
1.燃煤发电的能量转化过程
化学能热能机械能电能
转化过程的关键是燃烧,燃烧一定是氧化还原反应(本质是电子的转移)。
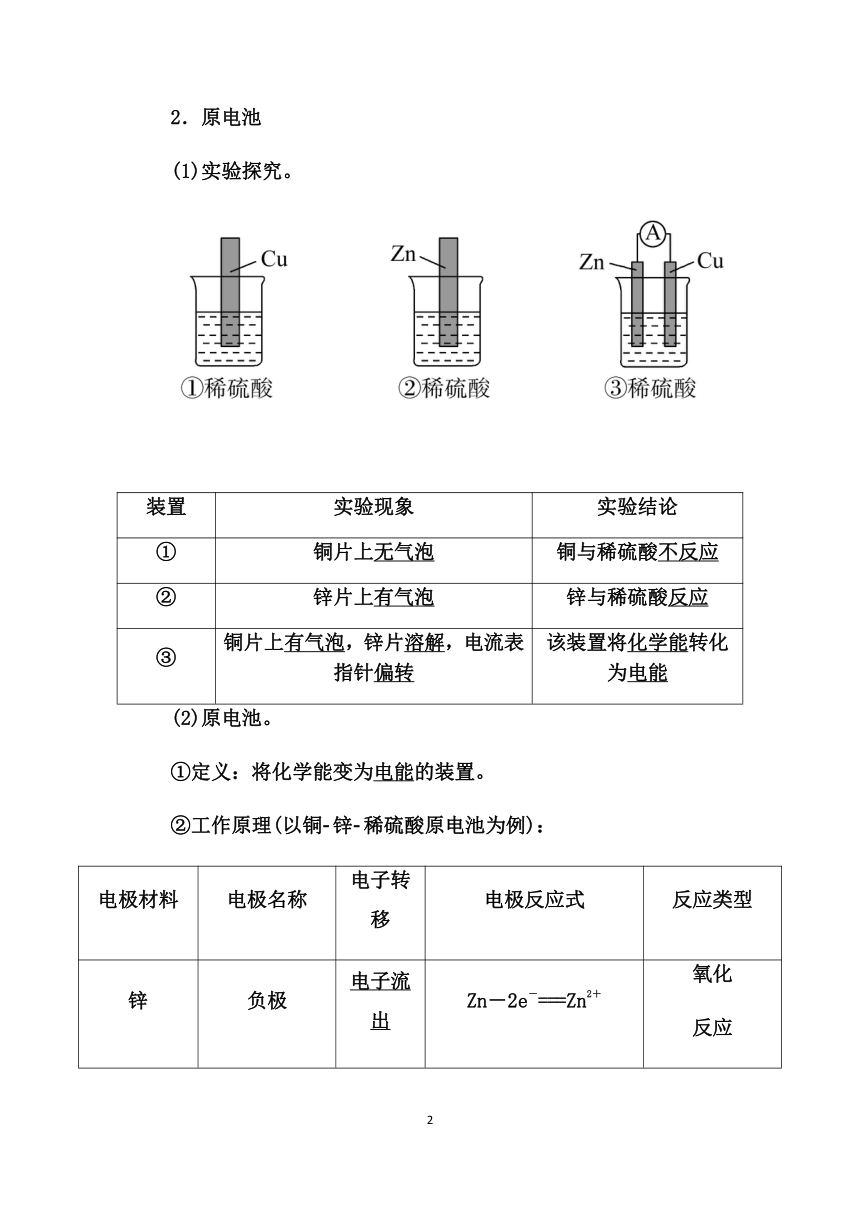
2.原电池
(1)实验探究。
装置
实验现象
实验结论
①
铜片上无气泡
铜与稀硫酸不反应
②
锌片上有气泡
锌与稀硫酸反应
③
铜片上有气泡,锌片溶解,电流表指针偏转
该装置将化学能转化为电能
(2)原电池。
①定义:将化学能变为电能的装置。
②工作原理(以铜?锌?稀硫酸原电池为例):
电极材料
电极名称
电子转移
电极反应式
反应类型
锌
负极
电子流出
Zn-2e-===Zn2+
氧化反应
铜
正极
电子流入
2H++2e-===H2↑
还原反应
总离子反应式
Zn+2H+===Zn2++H2↑
1.从上述实验装置推测,构成原电池应具备什么条件?
【提示】 条件
二、化学电源
1.干电池
最早使用的化学电池是锌锰电池,它是一种一次性电池,放完电后不能再使用。
(1)锌锰电池
(2)碱性锌锰电池:将锌锰干电池中的电解质NH4Cl换成湿的KOH,并在构造上作了改进。
2.充电电池
充电电池又称二次电池,它在放电时所进行的氧化还原反应,在充电时可以逆向进行,使电池恢复到放电前的状态。
(1)铅蓄电池:正极材料为PbO2,负极材料为Pb,电解质为稀硫酸。
(2)镍镉电池:正极材料为NiO(OH),负极材料为Cd,电解质为KOH。
(3)锂离子电池:新一代可充电的绿色电池,低功耗电器的主流电源。
3.燃料电池
(1)原理:利用原电池的工作原理将燃料和氧化剂反应所放出的化学能直接转化为电能。
(2)与其他电池的区别:由外设装备提供燃料和氧化剂等。
(3)充入燃料的电极为负极,充入氧化剂(如空气)的电极为正极。
2.写出酸性氢氧燃料电池的负极反应式和反应总方程式。
【提示】 H2-2e-===2H+
2H2+O2===2H2O
1.易误诊断
(1)原电池是一种电能转化为化学能的装置。( )
(2)负极失去电子发生氧化反应。( )
(3)正极是电子流出极。( )
(4)用导线连接的铜片和锌片插入到稀H2SO4中,铜片上有大量气泡产生。( )
(5)手机上用的锂离子电池属于二次电池。( )
(6)锌锰干电池中,锌电极是正极。( )
(7)甲烷燃料电池中通入甲烷的一极为负极,发生还原反应。( )
(8)废旧电池需回收集中处理的主要原因是为了利用电池外壳的金属材料。( )
【答案】 (1)× (2)√ (3)× (4)√ (5)√ (6)×
(7)× (8)×
2.对于锌、铜和稀硫酸组成的原电池(如右图),下列有关说法不正确的是( )
A.Zn是负极
B.Cu是正极
C.负极上发生氧化反应
D.正极上发生氧化反应
【答案】 D
3.下列有关电池的叙述不正确的是( )
A.水果电池是方便实用的家用电池
B.铅蓄电池是一种常用的二次电池
C.氢氧燃料电池是一种高效、无污染的发电装置
D.锌锰干电池工作一段时间后,锌外壳逐渐变薄
【答案】 A
预习完成后,请把你认为难以解决的问题记录在下面的表格中
问题1
问题2
问题3
问题4
学生分组探究一 原电池的工作原理及构成
第1步
探究——问题引入,自主探究
通过哪些方法判断原电池的负极?
【提示】 ①发生氧化反应的电极为负极
②电子流出或电流流入的电极为负极
③阴离子移向的电极为负极
④一般较活泼的电极为负极
⑤电极溶解的电极为负极
第2步
阐述——要点归纳,深化知识
1.原电池的工作原理
(1)反应类型:负极发生氧化反应,正极发生还原反应。
(2)电子的移动方向:负极流出,经导线流向正极。
(3)离子的移动方向:阳离子向正极移动,阴离子向负极移动。
2.原电池正、负极的判断方法
3.原电池的构成条件
①两个电极;②电解质溶液;③“两极”“一液”成回路;④能自发地发生氧化还原反应。
第3步
运用——精选习题,落实强化
1.下列装置中,能构成原电池的是( )
A.只有甲
B.只有乙
C.只有丙
D.除乙均可以
【解析】 甲装置不能构成闭合回路,乙装置两极材料相同,丁装置酒精不是电解质溶液,只有丙装置具备原电池的构成条件,故选C。
【答案】 C
2.如图是某同学做完Zn—Cu原电池实验后所做的读书卡片记录,其中描述合理的是________。(填序号)
NO.28 Date:2014.4.10
实验后的记录:
①Zn为正极,Cu为负极
②H+向负极移动
③电子流动方向ZnCu
④Cu极上有H2产生
⑤若有1
mol电子流过导线,则产生H2为0.5
mol
⑥正极的电极反应式为:Zn-2e===Zn2+
【解析】 在该原电池中,Zn比Cu活泼,故Zn作负极,铜作正极,电子由Zn流出经导线流向Cu片。负极反应为Zn-2e-===Zn2+,正极反应为2H++2e-===H↑,故每转移1
mol电子时,产生0.5
mol
H2。在溶液中,H+向正极移动,SO向负极移动,故③④⑤正确。
【答案】 ③④⑤
3.如图所示装置,电流表发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液,则A、B、C应是下列各组中的
( )
A.Zn Cu 稀硫酸
B.Cu Zn 稀硫酸
C.Fe Ag 稀AgNO3溶液
D.Ag Fe 稀AgNO3溶液
【解析】 由题目给出的现象判断:A极为正极,B极为负极。结合电解质溶液分析,若电解质为硫酸,则正极上有H2生成,并不能使正极变粗,故符合条件的为D项。
【答案】 D
原电池正负极的判断误区
在判断原电池正负极时,不要只根据金属活动性的相对强弱还要考虑电解质溶液的特点。
(1)Mg—Al和稀盐酸构成的原电池中,Mg作负极,Al作正极;而若把稀盐酸换为NaOH溶液,Al作负极,Mg作正极。
(2)Al—Cu和NaOH溶液构成的原电池中,Al作负极;而若把NaOH溶液换为浓硝酸,Cu作负极。
学生分组探究二 原电池原理的应用
第1步
探究——问题引入,自主探究
1.NaOH+HCl===NaCl+H2O,这个反应能设计成原电池吗,为什么?
【提示】 不能,因为它不是氧化还原反应。
2.锌与H2SO4反应制H2时向溶液中加少量CuSO4后,为什么反应速率加快?
【提示】 锌将Cu置换出来附着在Zn上,构成Zn—Cu原电池,加快反应。
第2步
阐述——要点归纳,深化知识
1.加快氧化还原反应的速率
(1)原理:原电池中,氧化反应和还原反应分别在两极进行,使溶液中离子运动时相互的干扰减小,使反应速率增大。
(2)实例:实验室用Zn和稀硫酸反应制取氢气时,可滴入几滴硫酸铜溶液,形成原电池,加快反应速率。
2.比较金属活泼性强弱
(1)原理:一般原电池中,活泼金属作负极,发生氧化反应,不活泼金属作正极,发生还原反应。
(2)实例:有两种金属A和B,用导线连接后插入到稀硫酸中,观察到A极溶解,B极上有气泡产生。由原电池原理可知,金属活动性A>B。
3.设计原电池
(1)首先将已知氧化还原反应拆分为两个半反应。
氧化反应:还原剂-ne-===氧化产物;
还原反应:氧化剂+ne-===还原产物;
正极反应式+负极反应式=电池的总反应式。
(2)根据原电池的电极反应特点,结合两个半反应找出正负极材料及电解质溶液。
①电解质溶液的选择:电解质溶液一般要能够与负极发生反应或者电解质溶液中溶解的其他物质能与负极发生反应(如空气中的氧气)。
②电极材料的选择:在原电池中,一般选择活泼性较强的金属作为负极,活泼性较弱的金属或能导电的惰性材料作正极。负极材料或还原性物质在负极上失去电子被氧化,氧化性物质在正极上得到电子被还原。
如反应Zn+Cu2+===Zn2++Cu可设计为下列装置
第3步
例证——典例印证,思维深化
某原电池总反应离子方程式为2Fe3++Fe===3Fe2+,不能实现该反应的原电池是( )
A.正极为Cu,负极为Fe,电解质溶液为FeCl3溶液
B.正极为C,负极为Fe,电解质溶液为Fe(NO3)3溶液
C.正极为Ag,负极为Fe,电解质溶液为Fe2(SO4)3溶液
D.正极为Ag,负极为Fe,电解质溶液为CuSO4溶液
【解析】 由2Fe3++Fe===3Fe2+得出负极反应式为Fe-2e-===Fe2+,正极反应式为2Fe3++2e-===2Fe2+,可知负极材料为铁,正极材料为不比铁活泼的导体,电解质溶液中必须有Fe3+。
【答案】 D
第4步
运用——精选习题,落实强化
1.A、B、C都是金属,把A浸入C的硝酸盐溶液中,A的表面有C析出,A、B和酸溶液组成原电池时,B为电池的负极。A、B、C三种金属的活动性顺序为( )
A.A>B>C
B.A>C>B
C.B>A>C
D.B>C>A
【解析】 A能从C的盐溶液中置换出C金属,金属活动性:A>C。A与B组成原电池时,B为负极,则金属活动性:B>A。
【答案】 C
2.将相同表面积的纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,下列叙述正确的是( )
A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极,乙中铜片是负极
C.甲中铜被氧化,乙中锌被氧化
D.产生气泡的速率甲比乙大
【解析】 根据图示可知甲构成原电池,乙未构成原电池,所以甲中Zn作负极,被氧化,Cu作正极,H+在铜片上被还原生成H2,而乙中Cu不与稀硫酸作用,Zn与稀硫酸发生氧化还原反应,因甲构成原电池而加大反应速率。故只有D正确。
【答案】 D
3.由A、B、C、D四种金属按下表中装置进行实验。
装置
(Ⅰ)
(Ⅱ)
(Ⅲ)
现象
二价金属A不断溶解
C的质量增加
A上有气体产生
根据实验现象回答下列问题:
(1)装置甲中负极的电极反应式是_________________。
(2)装置乙中正极的电极反应式是___________________。
(3)装置丙中溶液的pH________(填“变大”“变小”或“不变”)。
(4)四种金属活泼性由强到弱的顺序是________。
【解析】 根据图Ⅰ知金属活动性:A>B,A作负极,电极反应为A-2e-===A2+;根据图Ⅱ知金属活动性:B>C,正极反应为Cu2++2e-===Cu;根据图Ⅲ知金属活动性:D>A,正极反应为2H++2e-===H2↑,故c(H+)减小,pH增大。根据Ⅰ、Ⅱ、Ⅲ知活动性:D>A>B>C。
【答案】 (1)A-2e-===A2+ (2)Cu2++2e-===Cu (3)变大 (4)D>A>B>C
画原电池装置图的三点提醒:
(1)指明原电池的正负极材料及电解质溶液。
(2)烧杯中用虚线代表电解质溶液,液面用实线。
(3)用导线将两个电极连接以构成闭合回路。
学生分组探究三 化学电源的特点与构成
第1步
探究——问题引入,自主探究
1.二次电池能无限次的充放电吗?
【提示】 不能。
2.燃料电池有什么特点?
【提示】 ①高效、环境友好的发电装置。
②反应物不储存在电池内部,而是随时充入。
第2步
阐述——要点归纳,深化知识
名称
干电池(一次电池)
充电电池(二次电池)
燃料电池
特点
①活性物质(发生氧化还原反应的物质)消耗到一定程度后,不能再使用②电解质溶液为胶状,不流动
①放电后可再充电使活性物质获得再生②可以多次充电,重复使用
①电极本身不包含活性物质,只是一个催化转换元件②工作时,燃料和氧化剂连续地由外部供给,在电极上不断地进行反应,生成物不断地被排出
举例
普通的锌锰电池、碱性锌锰电池、银锌电池等
铅蓄电池、锂电池、镍镉电池等
氢氧燃料电池、CH4燃料电池、CH3OH燃料电池等
第3步
运用——精选习题,落实强化
1.右图是生活中常用的锌锰干电池的示意图,下列有关说法中不正确的是( )
A.电池内部含有电解质
B.锌是负极,碳棒是正极
C.电池用完后可埋入土壤
D.锌锰干电池是一次性电池
【解析】 锌锰干电池是一次性电池,负极材料是Zn,正极材料是碳棒,电解质是NH4Cl。因为废电池中含有多种重金属和酸、碱等有害物质,随意丢弃对生态环境和公众健康危害很大,所以应该对废电池进行集中处理,不能埋入土壤。
【答案】 C
2.iPhone手机使用的锂电池以质量轻、能量高而备受关注,目前已成功研制出多种锂电池。某种锂电池的总反应是Li+MnO2===LiMnO2。下列说法正确的是( )
A.MnO2是负极,电极反应为MnO2+e-===MnO
B.电池工作时,电子由正极通过外电路流向负极
C.电池内部产生的MnO向锂电极移动
D.钠比锂更活泼,相同质量的钠作电极比锂提供的电能更多
【解析】 原电池中,失电子的电极为负极,电池工作时电子由负极Li通过外电路移向正极MnO2,故A、B两项错误;在原电池内部,负极产生的阳离子移向正极区,而阴离子移向负极区,C项正确;由于M(Na)>M(Li),在相同质量时n(Li)>
n(Na),故Li作电极提供的电能更多。
【答案】 C
3.目前,科学家提出了一种经济而且理想的获得氢能源的循环体系(如图)。关于此循环体系,下列说法中错误的是( )
A.燃料电池能够使化学反应产生的能量转化为电能
B.燃料电池中通入H2的一极作负极,发生氧化反应
C.在此循环中发生了反应:2H2O??2H2↑+O2↑
D.目前化学家急需解决的问题是寻找合适的光照条件下分解水的催化剂
【解析】 氢氧燃料电池的负极通入H2,发生氧化反应;正极通入O2,发生还原反应,故B正确;原电池都是将化学能转化为电能的装置,故A正确;推广氢能的关键是寻找合适的催化剂,利用太阳能分解水;水的分解不是可逆反应。
【答案】 C
1.构成原电池的四个条件
(1)具有活泼性不同的两个电极;(2)两电极必须插入电解质溶液中;(3)形成闭合回路;(4)能自发地发生氧化还原反应。
2.原电池工作原理口诀
原电池分为两极;负极氧化正还原;电子由负流向正;离子阳正阴向负。
3.原电池正、负极的判断方法
首先准确判断元素化合价的变化,然后根据原电池工作原理判断。
化合价升高―→失去电子―→发生氧化反应―→负极;
化合价降低―→得到电子―→发生还原反应―→正极。
——化学能与电能
一、一次能源和二次能源
能源类别
概念
举例
说明
一次能源
直接从自然界中取得的能源
流水、风力、原煤、石油、天然气、天然铀矿
煤、石油和天然气通称为化石燃料
二次能源
一次能源经加工转换得到的能源
电力、蒸汽等
电能是应用最广泛、使用最方便、污染最小的二次能源
二、化学能转化为电能
1.燃煤发电的能量转化过程
化学能热能机械能电能
转化过程的关键是燃烧,燃烧一定是氧化还原反应(本质是电子的转移)。
2.原电池
(1)实验探究。
装置
实验现象
实验结论
①
铜片上无气泡
铜与稀硫酸不反应
②
锌片上有气泡
锌与稀硫酸反应
③
铜片上有气泡,锌片溶解,电流表指针偏转
该装置将化学能转化为电能
(2)原电池。
①定义:将化学能变为电能的装置。
②工作原理(以铜?锌?稀硫酸原电池为例):
电极材料
电极名称
电子转移
电极反应式
反应类型
锌
负极
电子流出
Zn-2e-===Zn2+
氧化反应
铜
正极
电子流入
2H++2e-===H2↑
还原反应
总离子反应式
Zn+2H+===Zn2++H2↑
1.从上述实验装置推测,构成原电池应具备什么条件?
【提示】 条件
二、化学电源
1.干电池
最早使用的化学电池是锌锰电池,它是一种一次性电池,放完电后不能再使用。
(1)锌锰电池
(2)碱性锌锰电池:将锌锰干电池中的电解质NH4Cl换成湿的KOH,并在构造上作了改进。
2.充电电池
充电电池又称二次电池,它在放电时所进行的氧化还原反应,在充电时可以逆向进行,使电池恢复到放电前的状态。
(1)铅蓄电池:正极材料为PbO2,负极材料为Pb,电解质为稀硫酸。
(2)镍镉电池:正极材料为NiO(OH),负极材料为Cd,电解质为KOH。
(3)锂离子电池:新一代可充电的绿色电池,低功耗电器的主流电源。
3.燃料电池
(1)原理:利用原电池的工作原理将燃料和氧化剂反应所放出的化学能直接转化为电能。
(2)与其他电池的区别:由外设装备提供燃料和氧化剂等。
(3)充入燃料的电极为负极,充入氧化剂(如空气)的电极为正极。
2.写出酸性氢氧燃料电池的负极反应式和反应总方程式。
【提示】 H2-2e-===2H+
2H2+O2===2H2O
1.易误诊断
(1)原电池是一种电能转化为化学能的装置。( )
(2)负极失去电子发生氧化反应。( )
(3)正极是电子流出极。( )
(4)用导线连接的铜片和锌片插入到稀H2SO4中,铜片上有大量气泡产生。( )
(5)手机上用的锂离子电池属于二次电池。( )
(6)锌锰干电池中,锌电极是正极。( )
(7)甲烷燃料电池中通入甲烷的一极为负极,发生还原反应。( )
(8)废旧电池需回收集中处理的主要原因是为了利用电池外壳的金属材料。( )
【答案】 (1)× (2)√ (3)× (4)√ (5)√ (6)×
(7)× (8)×
2.对于锌、铜和稀硫酸组成的原电池(如右图),下列有关说法不正确的是( )
A.Zn是负极
B.Cu是正极
C.负极上发生氧化反应
D.正极上发生氧化反应
【答案】 D
3.下列有关电池的叙述不正确的是( )
A.水果电池是方便实用的家用电池
B.铅蓄电池是一种常用的二次电池
C.氢氧燃料电池是一种高效、无污染的发电装置
D.锌锰干电池工作一段时间后,锌外壳逐渐变薄
【答案】 A
预习完成后,请把你认为难以解决的问题记录在下面的表格中
问题1
问题2
问题3
问题4
学生分组探究一 原电池的工作原理及构成
第1步
探究——问题引入,自主探究
通过哪些方法判断原电池的负极?
【提示】 ①发生氧化反应的电极为负极
②电子流出或电流流入的电极为负极
③阴离子移向的电极为负极
④一般较活泼的电极为负极
⑤电极溶解的电极为负极
第2步
阐述——要点归纳,深化知识
1.原电池的工作原理
(1)反应类型:负极发生氧化反应,正极发生还原反应。
(2)电子的移动方向:负极流出,经导线流向正极。
(3)离子的移动方向:阳离子向正极移动,阴离子向负极移动。
2.原电池正、负极的判断方法
3.原电池的构成条件
①两个电极;②电解质溶液;③“两极”“一液”成回路;④能自发地发生氧化还原反应。
第3步
运用——精选习题,落实强化
1.下列装置中,能构成原电池的是( )
A.只有甲
B.只有乙
C.只有丙
D.除乙均可以
【解析】 甲装置不能构成闭合回路,乙装置两极材料相同,丁装置酒精不是电解质溶液,只有丙装置具备原电池的构成条件,故选C。
【答案】 C
2.如图是某同学做完Zn—Cu原电池实验后所做的读书卡片记录,其中描述合理的是________。(填序号)
NO.28 Date:2014.4.10
实验后的记录:
①Zn为正极,Cu为负极
②H+向负极移动
③电子流动方向ZnCu
④Cu极上有H2产生
⑤若有1
mol电子流过导线,则产生H2为0.5
mol
⑥正极的电极反应式为:Zn-2e===Zn2+
【解析】 在该原电池中,Zn比Cu活泼,故Zn作负极,铜作正极,电子由Zn流出经导线流向Cu片。负极反应为Zn-2e-===Zn2+,正极反应为2H++2e-===H↑,故每转移1
mol电子时,产生0.5
mol
H2。在溶液中,H+向正极移动,SO向负极移动,故③④⑤正确。
【答案】 ③④⑤
3.如图所示装置,电流表发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液,则A、B、C应是下列各组中的
( )
A.Zn Cu 稀硫酸
B.Cu Zn 稀硫酸
C.Fe Ag 稀AgNO3溶液
D.Ag Fe 稀AgNO3溶液
【解析】 由题目给出的现象判断:A极为正极,B极为负极。结合电解质溶液分析,若电解质为硫酸,则正极上有H2生成,并不能使正极变粗,故符合条件的为D项。
【答案】 D
原电池正负极的判断误区
在判断原电池正负极时,不要只根据金属活动性的相对强弱还要考虑电解质溶液的特点。
(1)Mg—Al和稀盐酸构成的原电池中,Mg作负极,Al作正极;而若把稀盐酸换为NaOH溶液,Al作负极,Mg作正极。
(2)Al—Cu和NaOH溶液构成的原电池中,Al作负极;而若把NaOH溶液换为浓硝酸,Cu作负极。
学生分组探究二 原电池原理的应用
第1步
探究——问题引入,自主探究
1.NaOH+HCl===NaCl+H2O,这个反应能设计成原电池吗,为什么?
【提示】 不能,因为它不是氧化还原反应。
2.锌与H2SO4反应制H2时向溶液中加少量CuSO4后,为什么反应速率加快?
【提示】 锌将Cu置换出来附着在Zn上,构成Zn—Cu原电池,加快反应。
第2步
阐述——要点归纳,深化知识
1.加快氧化还原反应的速率
(1)原理:原电池中,氧化反应和还原反应分别在两极进行,使溶液中离子运动时相互的干扰减小,使反应速率增大。
(2)实例:实验室用Zn和稀硫酸反应制取氢气时,可滴入几滴硫酸铜溶液,形成原电池,加快反应速率。
2.比较金属活泼性强弱
(1)原理:一般原电池中,活泼金属作负极,发生氧化反应,不活泼金属作正极,发生还原反应。
(2)实例:有两种金属A和B,用导线连接后插入到稀硫酸中,观察到A极溶解,B极上有气泡产生。由原电池原理可知,金属活动性A>B。
3.设计原电池
(1)首先将已知氧化还原反应拆分为两个半反应。
氧化反应:还原剂-ne-===氧化产物;
还原反应:氧化剂+ne-===还原产物;
正极反应式+负极反应式=电池的总反应式。
(2)根据原电池的电极反应特点,结合两个半反应找出正负极材料及电解质溶液。
①电解质溶液的选择:电解质溶液一般要能够与负极发生反应或者电解质溶液中溶解的其他物质能与负极发生反应(如空气中的氧气)。
②电极材料的选择:在原电池中,一般选择活泼性较强的金属作为负极,活泼性较弱的金属或能导电的惰性材料作正极。负极材料或还原性物质在负极上失去电子被氧化,氧化性物质在正极上得到电子被还原。
如反应Zn+Cu2+===Zn2++Cu可设计为下列装置
第3步
例证——典例印证,思维深化
某原电池总反应离子方程式为2Fe3++Fe===3Fe2+,不能实现该反应的原电池是( )
A.正极为Cu,负极为Fe,电解质溶液为FeCl3溶液
B.正极为C,负极为Fe,电解质溶液为Fe(NO3)3溶液
C.正极为Ag,负极为Fe,电解质溶液为Fe2(SO4)3溶液
D.正极为Ag,负极为Fe,电解质溶液为CuSO4溶液
【解析】 由2Fe3++Fe===3Fe2+得出负极反应式为Fe-2e-===Fe2+,正极反应式为2Fe3++2e-===2Fe2+,可知负极材料为铁,正极材料为不比铁活泼的导体,电解质溶液中必须有Fe3+。
【答案】 D
第4步
运用——精选习题,落实强化
1.A、B、C都是金属,把A浸入C的硝酸盐溶液中,A的表面有C析出,A、B和酸溶液组成原电池时,B为电池的负极。A、B、C三种金属的活动性顺序为( )
A.A>B>C
B.A>C>B
C.B>A>C
D.B>C>A
【解析】 A能从C的盐溶液中置换出C金属,金属活动性:A>C。A与B组成原电池时,B为负极,则金属活动性:B>A。
【答案】 C
2.将相同表面积的纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,下列叙述正确的是( )
A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极,乙中铜片是负极
C.甲中铜被氧化,乙中锌被氧化
D.产生气泡的速率甲比乙大
【解析】 根据图示可知甲构成原电池,乙未构成原电池,所以甲中Zn作负极,被氧化,Cu作正极,H+在铜片上被还原生成H2,而乙中Cu不与稀硫酸作用,Zn与稀硫酸发生氧化还原反应,因甲构成原电池而加大反应速率。故只有D正确。
【答案】 D
3.由A、B、C、D四种金属按下表中装置进行实验。
装置
(Ⅰ)
(Ⅱ)
(Ⅲ)
现象
二价金属A不断溶解
C的质量增加
A上有气体产生
根据实验现象回答下列问题:
(1)装置甲中负极的电极反应式是_________________。
(2)装置乙中正极的电极反应式是___________________。
(3)装置丙中溶液的pH________(填“变大”“变小”或“不变”)。
(4)四种金属活泼性由强到弱的顺序是________。
【解析】 根据图Ⅰ知金属活动性:A>B,A作负极,电极反应为A-2e-===A2+;根据图Ⅱ知金属活动性:B>C,正极反应为Cu2++2e-===Cu;根据图Ⅲ知金属活动性:D>A,正极反应为2H++2e-===H2↑,故c(H+)减小,pH增大。根据Ⅰ、Ⅱ、Ⅲ知活动性:D>A>B>C。
【答案】 (1)A-2e-===A2+ (2)Cu2++2e-===Cu (3)变大 (4)D>A>B>C
画原电池装置图的三点提醒:
(1)指明原电池的正负极材料及电解质溶液。
(2)烧杯中用虚线代表电解质溶液,液面用实线。
(3)用导线将两个电极连接以构成闭合回路。
学生分组探究三 化学电源的特点与构成
第1步
探究——问题引入,自主探究
1.二次电池能无限次的充放电吗?
【提示】 不能。
2.燃料电池有什么特点?
【提示】 ①高效、环境友好的发电装置。
②反应物不储存在电池内部,而是随时充入。
第2步
阐述——要点归纳,深化知识
名称
干电池(一次电池)
充电电池(二次电池)
燃料电池
特点
①活性物质(发生氧化还原反应的物质)消耗到一定程度后,不能再使用②电解质溶液为胶状,不流动
①放电后可再充电使活性物质获得再生②可以多次充电,重复使用
①电极本身不包含活性物质,只是一个催化转换元件②工作时,燃料和氧化剂连续地由外部供给,在电极上不断地进行反应,生成物不断地被排出
举例
普通的锌锰电池、碱性锌锰电池、银锌电池等
铅蓄电池、锂电池、镍镉电池等
氢氧燃料电池、CH4燃料电池、CH3OH燃料电池等
第3步
运用——精选习题,落实强化
1.右图是生活中常用的锌锰干电池的示意图,下列有关说法中不正确的是( )
A.电池内部含有电解质
B.锌是负极,碳棒是正极
C.电池用完后可埋入土壤
D.锌锰干电池是一次性电池
【解析】 锌锰干电池是一次性电池,负极材料是Zn,正极材料是碳棒,电解质是NH4Cl。因为废电池中含有多种重金属和酸、碱等有害物质,随意丢弃对生态环境和公众健康危害很大,所以应该对废电池进行集中处理,不能埋入土壤。
【答案】 C
2.iPhone手机使用的锂电池以质量轻、能量高而备受关注,目前已成功研制出多种锂电池。某种锂电池的总反应是Li+MnO2===LiMnO2。下列说法正确的是( )
A.MnO2是负极,电极反应为MnO2+e-===MnO
B.电池工作时,电子由正极通过外电路流向负极
C.电池内部产生的MnO向锂电极移动
D.钠比锂更活泼,相同质量的钠作电极比锂提供的电能更多
【解析】 原电池中,失电子的电极为负极,电池工作时电子由负极Li通过外电路移向正极MnO2,故A、B两项错误;在原电池内部,负极产生的阳离子移向正极区,而阴离子移向负极区,C项正确;由于M(Na)>M(Li),在相同质量时n(Li)>
n(Na),故Li作电极提供的电能更多。
【答案】 C
3.目前,科学家提出了一种经济而且理想的获得氢能源的循环体系(如图)。关于此循环体系,下列说法中错误的是( )
A.燃料电池能够使化学反应产生的能量转化为电能
B.燃料电池中通入H2的一极作负极,发生氧化反应
C.在此循环中发生了反应:2H2O??2H2↑+O2↑
D.目前化学家急需解决的问题是寻找合适的光照条件下分解水的催化剂
【解析】 氢氧燃料电池的负极通入H2,发生氧化反应;正极通入O2,发生还原反应,故B正确;原电池都是将化学能转化为电能的装置,故A正确;推广氢能的关键是寻找合适的催化剂,利用太阳能分解水;水的分解不是可逆反应。
【答案】 C
1.构成原电池的四个条件
(1)具有活泼性不同的两个电极;(2)两电极必须插入电解质溶液中;(3)形成闭合回路;(4)能自发地发生氧化还原反应。
2.原电池工作原理口诀
原电池分为两极;负极氧化正还原;电子由负流向正;离子阳正阴向负。
3.原电池正、负极的判断方法
首先准确判断元素化合价的变化,然后根据原电池工作原理判断。
化合价升高―→失去电子―→发生氧化反应―→负极;
化合价降低―→得到电子―→发生还原反应―→正极。
