人教版高中化学必修二 2-1化学能与热能(27张ppt)
文档属性
| 名称 | 人教版高中化学必修二 2-1化学能与热能(27张ppt) |
|
|
| 格式 | zip | ||
| 文件大小 | 3.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-05-27 00:00:00 | ||
图片预览








文档简介
(共27张PPT)
第二章
化学反应与能量
恒温动物
一、化学反应中的能量变化
不在生物体内发生的化学反应,也会放出热量吗?请举例说明。
燃烧反应;
中和反应;
活泼金属与酸(或水)反应;
CaO等活泼金属氧化物与水反应;
其它:如Na2O2与水,
【问题探究1】
常见的放热反应
实验
:盐酸与铝片的反应
反应放出热量
有气泡放出,温度升高
实验
:酸与碱的中和反应
HCl与NaOH发生中和反应时放热。
强酸和强碱发生反应时放出热量。
资料卡片:
在稀溶液中,强酸和强碱中和生成1mol水时放出的热量是57.3kJ,称作“中和热”。
现象
结论
反应物及其用量
酸
HCl
20mL
1mol/L
碱
NaOH
20mL1mol/L
混合前温度
室温
混合后温度
结
论
归纳与概括
常见的吸热反应
吸热反应是否就一定需要“加热”呢?
实验
:Ba(OH)2·
8H2O与NH4Cl的反应
有刺激性气味,烧杯底部很冷,烧杯下面的玻璃片被冻在一起。
反应吸收热量。
现象
结论
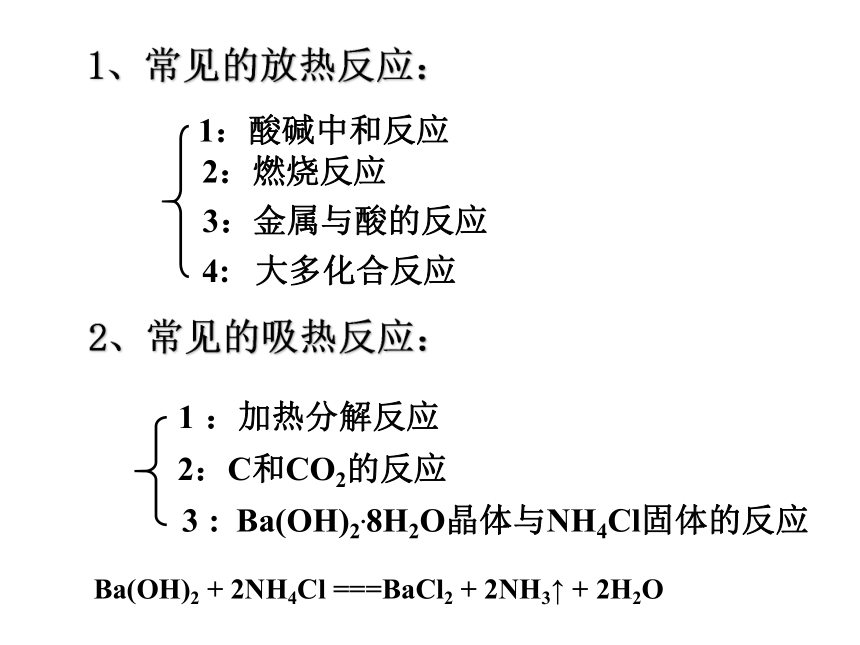
1、常见的放热反应:
2、常见的吸热反应:
2:C和CO2的反应
1
:加热分解反应
3
:
Ba(OH)2.8H2O晶体与NH4Cl固体的反应
1:酸碱中和反应
2:燃烧反应
3:金属与酸的反应
4:
大多化合反应
Ba(OH)2
+
2NH4Cl
===BaCl2
+
2NH3↑
+
2H2O
一个化学反应是吸热还是放热,既然与反应的条件无关,那与什么有关呢?
二、化学能与热能的相互转化
【问题探究2】
质量守恒定律
能量守恒定律
两个自然定律
物质本身的能量高——不稳定
物质本身的能量低——稳定
能量越低越稳定
1、从物质总能量的角度分析
反应物的能量之和(E反)
生成物的能量之和(E生)
①若E反<
E生,
吸收能量
吸热反应
②若E反>
E生,
放出能量
放热反应
一个化学反应是吸热反应还是放热反应取决于反应物总能量和生成物总能量的相对大小。
化学反应的过程实际上就是能量的“存储”和“释放”的过程。
思考:
(1)12g石墨转化成12g金刚石需要吸收1.9KJ热量,试比较石墨与金刚石哪个稳定?
(2)12g石墨和12g金刚石都能燃烧生成相同质量的二氧化碳,哪个放出的热量多?为什么?
巩固练习1
在一定温度和压强条件下,2molH2(g)和1molO2(g)完全化合生成2molH2O(g)会放出482kJ的热量。
(1)在相同条件下,
2molH2O(g)完全分解为2molH2(g)和1molO2(g)会
(“放出”或“吸收”)
kJ热量。
(2)1molH2(g)和0.5molO2(g)完全化合生成1molH2O(g)呢?
(3)2molH2(g)和1molO2(g)完全化合生成2molH2O(l)呢?
(4)根据以上计算,你能得出什么结论?
吸收
482
放出241kJ热量
放出热量,放出的热量大于482kJ
若正反应为吸热反应则逆反应为放热反应
2、从化学键的角度分析
H2
+
Cl2
==
2HCl
H—H
Cl
—Cl
H—Cl
断开
断开
形成
436kJ/mol
243kJ/mol
431kJ/mol
化学反应的本质是旧键的断裂,新键的形成。
断开化学键——吸收热量
形成化学键——放出热量
2
×
431
kJ
-436kJ+243kJ=?kJ
在反应H2
+
F2=2HF中,已知断开1molH-H键需要吸收热量436kJ,断开1molF-F键吸收热量155kJ,形成1molH-F放出565kJ热量,判断该反(
)
A.
吸热反应
B.
放热反应
C.
吸收539kJ热量
D.放出539kJ热量
巩固练习2
24
在25℃和101kPa的条件下,
即:由1mol的H2和1mol的F2,会释放出
2
×
565kJ-436kJ-155kJ=539kJ
H2
+
F2
2HF
kJ
F
-
F
F
+
F
吸收155kJ/mol
H-H
·H
+
·
H
吸收436kJ/mol
吸收还是放出热量?
放出539
H
+
F
H-F
放出565kJ/mol
例如
知识小结
从化学键
的角度
从物质总
能量角度
放热反应
断键吸收的总能量小于形成新键放出的总能量
反应物的总能量大于生成物的总能量
吸热反应
断键吸收的总能量大于形成新键放出的总能量
反应物的总能
量小于生成物的总能量
练
习
3
2、已知反应A+B=C+D为放热反应,对该反应的下列说法中正确的是(
)
A.A的能量一定高于C
B.B的能量一定高于D
C.A和B的总能量一定高于C和D的总能量
D.该反应为放热反应,故不必加热就一
定能发生
3
吸热反应与放热反应与是否需要加热并无必然的联系,那么反应过程的“加热”是用来干什么的?
【问题探究3】
能量
反应过程
3、石灰石(主要成分是CaCO3)要经过高温煅烧才能变成生石灰(CaO),高温条件提供的热能在石灰石的分解反应中起什么作用?
既然自然界能量是守恒的,不会消失,只会从一种形式转化为另一种形式,那为什么还要提倡“节约使用能源”呢?
课后思考:
一个化学反应是吸热反应还是放热反应,取决于旧键断裂所需总能量与新键形成所放出总能量的相对大小。
一个化学反应是吸热反应还是放热反应
【小结】
第二章
化学反应与能量
恒温动物
一、化学反应中的能量变化
不在生物体内发生的化学反应,也会放出热量吗?请举例说明。
燃烧反应;
中和反应;
活泼金属与酸(或水)反应;
CaO等活泼金属氧化物与水反应;
其它:如Na2O2与水,
【问题探究1】
常见的放热反应
实验
:盐酸与铝片的反应
反应放出热量
有气泡放出,温度升高
实验
:酸与碱的中和反应
HCl与NaOH发生中和反应时放热。
强酸和强碱发生反应时放出热量。
资料卡片:
在稀溶液中,强酸和强碱中和生成1mol水时放出的热量是57.3kJ,称作“中和热”。
现象
结论
反应物及其用量
酸
HCl
20mL
1mol/L
碱
NaOH
20mL1mol/L
混合前温度
室温
混合后温度
结
论
归纳与概括
常见的吸热反应
吸热反应是否就一定需要“加热”呢?
实验
:Ba(OH)2·
8H2O与NH4Cl的反应
有刺激性气味,烧杯底部很冷,烧杯下面的玻璃片被冻在一起。
反应吸收热量。
现象
结论
1、常见的放热反应:
2、常见的吸热反应:
2:C和CO2的反应
1
:加热分解反应
3
:
Ba(OH)2.8H2O晶体与NH4Cl固体的反应
1:酸碱中和反应
2:燃烧反应
3:金属与酸的反应
4:
大多化合反应
Ba(OH)2
+
2NH4Cl
===BaCl2
+
2NH3↑
+
2H2O
一个化学反应是吸热还是放热,既然与反应的条件无关,那与什么有关呢?
二、化学能与热能的相互转化
【问题探究2】
质量守恒定律
能量守恒定律
两个自然定律
物质本身的能量高——不稳定
物质本身的能量低——稳定
能量越低越稳定
1、从物质总能量的角度分析
反应物的能量之和(E反)
生成物的能量之和(E生)
①若E反<
E生,
吸收能量
吸热反应
②若E反>
E生,
放出能量
放热反应
一个化学反应是吸热反应还是放热反应取决于反应物总能量和生成物总能量的相对大小。
化学反应的过程实际上就是能量的“存储”和“释放”的过程。
思考:
(1)12g石墨转化成12g金刚石需要吸收1.9KJ热量,试比较石墨与金刚石哪个稳定?
(2)12g石墨和12g金刚石都能燃烧生成相同质量的二氧化碳,哪个放出的热量多?为什么?
巩固练习1
在一定温度和压强条件下,2molH2(g)和1molO2(g)完全化合生成2molH2O(g)会放出482kJ的热量。
(1)在相同条件下,
2molH2O(g)完全分解为2molH2(g)和1molO2(g)会
(“放出”或“吸收”)
kJ热量。
(2)1molH2(g)和0.5molO2(g)完全化合生成1molH2O(g)呢?
(3)2molH2(g)和1molO2(g)完全化合生成2molH2O(l)呢?
(4)根据以上计算,你能得出什么结论?
吸收
482
放出241kJ热量
放出热量,放出的热量大于482kJ
若正反应为吸热反应则逆反应为放热反应
2、从化学键的角度分析
H2
+
Cl2
==
2HCl
H—H
Cl
—Cl
H—Cl
断开
断开
形成
436kJ/mol
243kJ/mol
431kJ/mol
化学反应的本质是旧键的断裂,新键的形成。
断开化学键——吸收热量
形成化学键——放出热量
2
×
431
kJ
-436kJ+243kJ=?kJ
在反应H2
+
F2=2HF中,已知断开1molH-H键需要吸收热量436kJ,断开1molF-F键吸收热量155kJ,形成1molH-F放出565kJ热量,判断该反(
)
A.
吸热反应
B.
放热反应
C.
吸收539kJ热量
D.放出539kJ热量
巩固练习2
24
在25℃和101kPa的条件下,
即:由1mol的H2和1mol的F2,会释放出
2
×
565kJ-436kJ-155kJ=539kJ
H2
+
F2
2HF
kJ
F
-
F
F
+
F
吸收155kJ/mol
H-H
·H
+
·
H
吸收436kJ/mol
吸收还是放出热量?
放出539
H
+
F
H-F
放出565kJ/mol
例如
知识小结
从化学键
的角度
从物质总
能量角度
放热反应
断键吸收的总能量小于形成新键放出的总能量
反应物的总能量大于生成物的总能量
吸热反应
断键吸收的总能量大于形成新键放出的总能量
反应物的总能
量小于生成物的总能量
练
习
3
2、已知反应A+B=C+D为放热反应,对该反应的下列说法中正确的是(
)
A.A的能量一定高于C
B.B的能量一定高于D
C.A和B的总能量一定高于C和D的总能量
D.该反应为放热反应,故不必加热就一
定能发生
3
吸热反应与放热反应与是否需要加热并无必然的联系,那么反应过程的“加热”是用来干什么的?
【问题探究3】
能量
反应过程
3、石灰石(主要成分是CaCO3)要经过高温煅烧才能变成生石灰(CaO),高温条件提供的热能在石灰石的分解反应中起什么作用?
既然自然界能量是守恒的,不会消失,只会从一种形式转化为另一种形式,那为什么还要提倡“节约使用能源”呢?
课后思考:
一个化学反应是吸热反应还是放热反应,取决于旧键断裂所需总能量与新键形成所放出总能量的相对大小。
一个化学反应是吸热反应还是放热反应
【小结】
