人教版高二化学选修4第一章第2节燃烧热 能源(共21张PPT)
文档属性
| 名称 | 人教版高二化学选修4第一章第2节燃烧热 能源(共21张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 2.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-05-27 20:02:13 | ||
图片预览








文档简介
(共21张PPT)
第二节 燃烧热 能源
第一章 化学反应与能量
温故知新
1、说明下列热化学方程式中△H的涵义:
H+(aq)+OH-(aq)
=
H2O(1)
△H
=
-
57.3kJ/mol
2H2(g)
+
O2(g)
=
2H2O(g)
△H=-484kJ?mol-1
2、若将1L1mol/LNaOH溶液中加入稀醋酸、浓硫酸、稀硝酸,恰好完全反应时的热效应分别为△H1、△H2
、△H3
,则三者的大小关系为
。
CH3COOH
H2SO4(浓)
HNO3
放出的热:
热效应:
Q1(最少)
Q2
(最多)
Q
3
△H1>
△H3
>
△H2
温故知新
3、依据事实,写出下列反应的热化学方程式∶
(2)
1克甲醇(CH3OH)燃烧生成二氧化碳和水(液态)时放热22.68KJ
(1)
1mol碳完全燃烧放出393.5KJ的热量
(3)
1mol氯气和水蒸气通过灼热的炭层反应,生成氯化氢和二氧化碳放出145KJ的热量。
2Cl2(g)+2H2O(g)+C(s)=4HCl(g)+CO
2
(g)
△H=-290KJ/mol
C(s)+O2(g)=CO2(g)
△H=-393.5KJ/mol
CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l)
△H=-725.8KJ/mol
温故知新
一、燃烧热
25℃、101kPa下,1mol甲烷完全燃烧生成CO2(气)和H2O(液)时放出890.31kJ的热量,热化学方程式表示为:
CH4(g)+2O2(g)====CO2(g)+2H2O(l)
△H=-890.31kJ/mol
1:燃烧热:25℃、101kPa下,1mol纯物质完全燃烧生成稳定的化合物时所放出的热量。
思考:甲烷的燃烧热为890.31kJ其意义是什么?
教材解读
(1)研究条件:
25℃
101kPa,条件不同,反应热不同
(2)燃料的物质的量规定为1mol
(3)生成稳定化合物(即生成物不能继续燃烧)
一般如:C
--
CO2
(g)
S
–
SO2
(g)
H–
H2O(l)
(4)单位:KJ/mol
2、概念理解:
教材解读
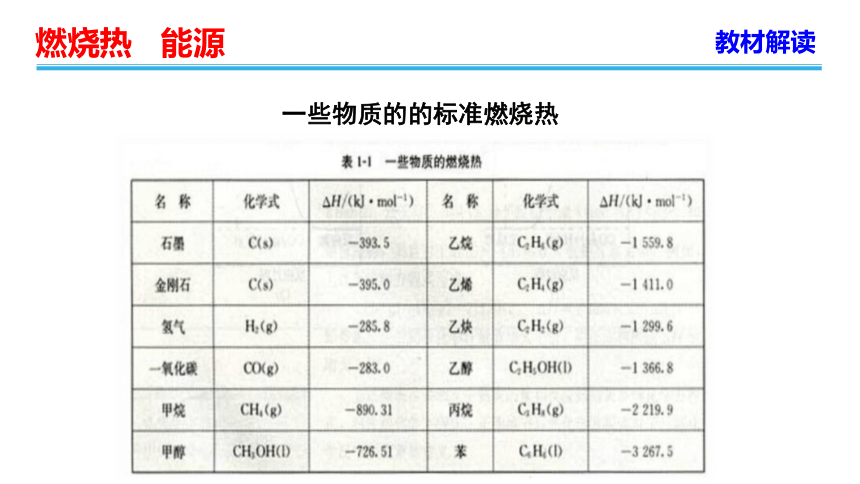
一些物质的的标准燃烧热
教材解读
3.表示燃烧热的热化学方程式的书写:
应以1mol物质的标准来配平其余物质的化学计量数(常出现分数)
4.一定量可燃物完全燃烧时放出的热量:
Q放=n(可燃物)ⅹ∣△Hc∣
Q放——可燃物燃烧反应放出的热量;
n——可燃物的物质的量;
△Hc——可燃物的燃烧热。
燃烧放出的热量与燃烧热有什么不同?
教材解读
(1)燃烧放出的热量与物质的多少有关,燃烧的物质越多,放出的热量就越多,而燃烧热规定是1
mol的可燃物。
(2)研究燃烧放出的热量并未限定燃烧产物的形态,而研究燃烧热必须是生成稳定的氧化物。
因此,不同量的同一物质完全燃烧,放出的热量可能不同,但燃烧热相等。
总结感悟
【例】?
在
101
kPa时,1mol
CH4
完全燃烧生成CO2和液态H2O,放出
890
kJ的热量,CH4
的燃烧热为多少?
1000
L
CH4(标准状况)燃烧后所产生的热量为多少?
【解】根据题意,在
101
kPa时,1mol
CH4
完全燃烧的热化学方程式为:
CH4(g)+2O2(g)=
CO2(g)+
2H2O(l)
ΔH=-890
kJ/mol
即CH4
的燃烧热为
890
kJ/mol。
当堂训练
1000
L
CH4
的物质的量为:
n(CH4)=V
(CH4)
/
Vm=1000L
/
22.4L·mol-1
=
44.6mol
1mol
CH4
完全燃烧放出
890
kJ的热量,44.6
molCH4
完全燃烧放出的热量为:
44.6
mol×890
kJ/mol=3.97×104kJ
答:CH4的燃烧热为
890
kJ/mol,1000
L
CH4(标准状况)完全燃烧产生的热量为
3.97×104kJ。
当堂训练
相
同
点
燃烧热
中和热
能量变化
ΔH
不
同
点
反应物的量
生成物的量
反应热
的含义
放热反应
ΔH<0
,
单位
kJ/mol
1mol可燃物
不限量
不限量
H2O
1mol
1mol反应物完全燃烧时放出的热量;不同的物质燃烧热不同
酸碱中和生成1molH2O时放出的热量,
燃烧热与中和热的区别与联系
总结感悟
[特别提醒]
(1)“燃烧热的热化学方程式”与“燃烧的热化学方程式”的书写不同。写燃烧热的热化学方程式时可燃物必须为1
mol,燃烧的热化学方程式不强调可燃物的物质的量,可为任意值。
(2)“中和热的热化学方程式”与“中和反应的热化学方程式”的书写不同。书写中和热的热化学方程式时生成的水必须为1
mol,书写中和反应的热化学方程式时生成的水的量可为任意值。
教材解读
1、分析以下几个热化学方程式,表示25℃时燃烧热的是(
)
A、C(s)+O2(g)=CO(g)
ΔH=
-110.5
kJ/mol
B、C(s)+O2(g)=CO2(g)
ΔH=-393.5
kJ/mol
C、2H2(g)+O2(g)=2H2O(l)
ΔH=-571.6
kJ/mol
D、H2(g)+1/2O2(g)=H2O(g)
ΔH=-241.8
kJ/mol
E、H2(g)+1/2O2(g)=H2O(l)
ΔH=-285.8
kJ/mol
BE
当堂训练
2、已知下列两个热化学方程式:
2H2(g)+O2(g)
=2H2O(l)
△H=-571.6
kJ?mol-1
C3H8(g)+5O2(g)
=3CO2(g)+4
H2O(l)
△H=-2
220
kJ?mol-1
(1)H2的燃烧热为______________,
C3H8的燃烧热为______________
(2)2gH2和2mol
C3H8组成的混合气体完全燃烧放出的热量为____________
(3)现有H2和C3H8的混合气体5
mol,完全燃烧时放出热量3847
kJ,则混合气体中H2和C3H8的体积比为____________
3:1
285.8
kJ?mol-1
2
220
kJ?mol-1
4725.8
kJ
当堂训练
二、能源
1、概念:能提供能量的资源
教材解读
分类依据
种类
举例
转换过程
一次能源
太阳能、风能、化石能源、地热能、潮汐能等
二次能源
电能、氢能、石油和煤的加工产品
使用历史
常规能源
化石燃料
新能源
太阳能、核能、风能、氢能、生物质能等
性质
可再生能源
太阳能、风能、氢能、生物质能等
不可再生能源
化石燃料、核能
2、分类:
教材解读
一次能源是指自然界中以原有形式存在的、未经加工转换的能量资源,又称天然能源。
一次能源包括化石燃料(如煤、石油、天然气等)、核燃料、生物质能、水能、风能、太阳能、地热能、海洋能、潮汐能等。一次能源又分为可再生能源和不可再生能源,前者指能够重复产生的天然能源,如太阳能、风能、水能、生物质能等,这些能源均来自太阳,可以重复产生;后者用一点少一点,主要是各类化石燃料、核燃料。
教材解读
二次能源是指由一次能源经过加工转换以后得到的能源,包括电能、汽油、柴油、液化石油气和氢能等。例如将煤燃烧产生蒸气能推动发电机,所产生的电能即可称为二次能源。或者电能被利用后,经由电风扇,再转化成风能,这时风能亦可称为二次能源,二次能源与一次能源间必定有一定程度的损耗。
教材解读
(1)我国目前使用的主要是何种能源?
(2)我国的能源储量。
(3)我国的人均能源拥有量。
(4)近年来我国能源的总消费量与人均消费量情况。
开源、节流
3、能源问题
了解了我国的能源利用率,你有何感想?
教材解读
应根据什么标准来选择燃料?
物质的燃烧热
燃料的储量
燃料的开采、运输
燃料储存的条件、价格
燃料对生态环境的影响
例:丙烷
石油中储量丰富
开采容易
燃烧热值高
燃烧时污染小
储存、运输不方便
总结感悟
第二节 燃烧热 能源
第一章 化学反应与能量
温故知新
1、说明下列热化学方程式中△H的涵义:
H+(aq)+OH-(aq)
=
H2O(1)
△H
=
-
57.3kJ/mol
2H2(g)
+
O2(g)
=
2H2O(g)
△H=-484kJ?mol-1
2、若将1L1mol/LNaOH溶液中加入稀醋酸、浓硫酸、稀硝酸,恰好完全反应时的热效应分别为△H1、△H2
、△H3
,则三者的大小关系为
。
CH3COOH
H2SO4(浓)
HNO3
放出的热:
热效应:
Q1(最少)
Q2
(最多)
Q
3
△H1>
△H3
>
△H2
温故知新
3、依据事实,写出下列反应的热化学方程式∶
(2)
1克甲醇(CH3OH)燃烧生成二氧化碳和水(液态)时放热22.68KJ
(1)
1mol碳完全燃烧放出393.5KJ的热量
(3)
1mol氯气和水蒸气通过灼热的炭层反应,生成氯化氢和二氧化碳放出145KJ的热量。
2Cl2(g)+2H2O(g)+C(s)=4HCl(g)+CO
2
(g)
△H=-290KJ/mol
C(s)+O2(g)=CO2(g)
△H=-393.5KJ/mol
CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l)
△H=-725.8KJ/mol
温故知新
一、燃烧热
25℃、101kPa下,1mol甲烷完全燃烧生成CO2(气)和H2O(液)时放出890.31kJ的热量,热化学方程式表示为:
CH4(g)+2O2(g)====CO2(g)+2H2O(l)
△H=-890.31kJ/mol
1:燃烧热:25℃、101kPa下,1mol纯物质完全燃烧生成稳定的化合物时所放出的热量。
思考:甲烷的燃烧热为890.31kJ其意义是什么?
教材解读
(1)研究条件:
25℃
101kPa,条件不同,反应热不同
(2)燃料的物质的量规定为1mol
(3)生成稳定化合物(即生成物不能继续燃烧)
一般如:C
--
CO2
(g)
S
–
SO2
(g)
H–
H2O(l)
(4)单位:KJ/mol
2、概念理解:
教材解读
一些物质的的标准燃烧热
教材解读
3.表示燃烧热的热化学方程式的书写:
应以1mol物质的标准来配平其余物质的化学计量数(常出现分数)
4.一定量可燃物完全燃烧时放出的热量:
Q放=n(可燃物)ⅹ∣△Hc∣
Q放——可燃物燃烧反应放出的热量;
n——可燃物的物质的量;
△Hc——可燃物的燃烧热。
燃烧放出的热量与燃烧热有什么不同?
教材解读
(1)燃烧放出的热量与物质的多少有关,燃烧的物质越多,放出的热量就越多,而燃烧热规定是1
mol的可燃物。
(2)研究燃烧放出的热量并未限定燃烧产物的形态,而研究燃烧热必须是生成稳定的氧化物。
因此,不同量的同一物质完全燃烧,放出的热量可能不同,但燃烧热相等。
总结感悟
【例】?
在
101
kPa时,1mol
CH4
完全燃烧生成CO2和液态H2O,放出
890
kJ的热量,CH4
的燃烧热为多少?
1000
L
CH4(标准状况)燃烧后所产生的热量为多少?
【解】根据题意,在
101
kPa时,1mol
CH4
完全燃烧的热化学方程式为:
CH4(g)+2O2(g)=
CO2(g)+
2H2O(l)
ΔH=-890
kJ/mol
即CH4
的燃烧热为
890
kJ/mol。
当堂训练
1000
L
CH4
的物质的量为:
n(CH4)=V
(CH4)
/
Vm=1000L
/
22.4L·mol-1
=
44.6mol
1mol
CH4
完全燃烧放出
890
kJ的热量,44.6
molCH4
完全燃烧放出的热量为:
44.6
mol×890
kJ/mol=3.97×104kJ
答:CH4的燃烧热为
890
kJ/mol,1000
L
CH4(标准状况)完全燃烧产生的热量为
3.97×104kJ。
当堂训练
相
同
点
燃烧热
中和热
能量变化
ΔH
不
同
点
反应物的量
生成物的量
反应热
的含义
放热反应
ΔH<0
,
单位
kJ/mol
1mol可燃物
不限量
不限量
H2O
1mol
1mol反应物完全燃烧时放出的热量;不同的物质燃烧热不同
酸碱中和生成1molH2O时放出的热量,
燃烧热与中和热的区别与联系
总结感悟
[特别提醒]
(1)“燃烧热的热化学方程式”与“燃烧的热化学方程式”的书写不同。写燃烧热的热化学方程式时可燃物必须为1
mol,燃烧的热化学方程式不强调可燃物的物质的量,可为任意值。
(2)“中和热的热化学方程式”与“中和反应的热化学方程式”的书写不同。书写中和热的热化学方程式时生成的水必须为1
mol,书写中和反应的热化学方程式时生成的水的量可为任意值。
教材解读
1、分析以下几个热化学方程式,表示25℃时燃烧热的是(
)
A、C(s)+O2(g)=CO(g)
ΔH=
-110.5
kJ/mol
B、C(s)+O2(g)=CO2(g)
ΔH=-393.5
kJ/mol
C、2H2(g)+O2(g)=2H2O(l)
ΔH=-571.6
kJ/mol
D、H2(g)+1/2O2(g)=H2O(g)
ΔH=-241.8
kJ/mol
E、H2(g)+1/2O2(g)=H2O(l)
ΔH=-285.8
kJ/mol
BE
当堂训练
2、已知下列两个热化学方程式:
2H2(g)+O2(g)
=2H2O(l)
△H=-571.6
kJ?mol-1
C3H8(g)+5O2(g)
=3CO2(g)+4
H2O(l)
△H=-2
220
kJ?mol-1
(1)H2的燃烧热为______________,
C3H8的燃烧热为______________
(2)2gH2和2mol
C3H8组成的混合气体完全燃烧放出的热量为____________
(3)现有H2和C3H8的混合气体5
mol,完全燃烧时放出热量3847
kJ,则混合气体中H2和C3H8的体积比为____________
3:1
285.8
kJ?mol-1
2
220
kJ?mol-1
4725.8
kJ
当堂训练
二、能源
1、概念:能提供能量的资源
教材解读
分类依据
种类
举例
转换过程
一次能源
太阳能、风能、化石能源、地热能、潮汐能等
二次能源
电能、氢能、石油和煤的加工产品
使用历史
常规能源
化石燃料
新能源
太阳能、核能、风能、氢能、生物质能等
性质
可再生能源
太阳能、风能、氢能、生物质能等
不可再生能源
化石燃料、核能
2、分类:
教材解读
一次能源是指自然界中以原有形式存在的、未经加工转换的能量资源,又称天然能源。
一次能源包括化石燃料(如煤、石油、天然气等)、核燃料、生物质能、水能、风能、太阳能、地热能、海洋能、潮汐能等。一次能源又分为可再生能源和不可再生能源,前者指能够重复产生的天然能源,如太阳能、风能、水能、生物质能等,这些能源均来自太阳,可以重复产生;后者用一点少一点,主要是各类化石燃料、核燃料。
教材解读
二次能源是指由一次能源经过加工转换以后得到的能源,包括电能、汽油、柴油、液化石油气和氢能等。例如将煤燃烧产生蒸气能推动发电机,所产生的电能即可称为二次能源。或者电能被利用后,经由电风扇,再转化成风能,这时风能亦可称为二次能源,二次能源与一次能源间必定有一定程度的损耗。
教材解读
(1)我国目前使用的主要是何种能源?
(2)我国的能源储量。
(3)我国的人均能源拥有量。
(4)近年来我国能源的总消费量与人均消费量情况。
开源、节流
3、能源问题
了解了我国的能源利用率,你有何感想?
教材解读
应根据什么标准来选择燃料?
物质的燃烧热
燃料的储量
燃料的开采、运输
燃料储存的条件、价格
燃料对生态环境的影响
例:丙烷
石油中储量丰富
开采容易
燃烧热值高
燃烧时污染小
储存、运输不方便
总结感悟
