人教版高一必修二第三章第四节第一课时:糖类课件(共20张PPT)
文档属性
| 名称 | 人教版高一必修二第三章第四节第一课时:糖类课件(共20张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 813.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-05-27 20:07:44 | ||
图片预览





文档简介
(共20张PPT)
学习目标
第四节
基本营养物质
第1课时
糖类
1.了解糖类的组成、分类和结构和主要应用。(学习重点)
2.掌握糖类的主要性质和特征反应。(学习重难点)
3.能够设计实验确认淀粉水解的产物及水解的程度。
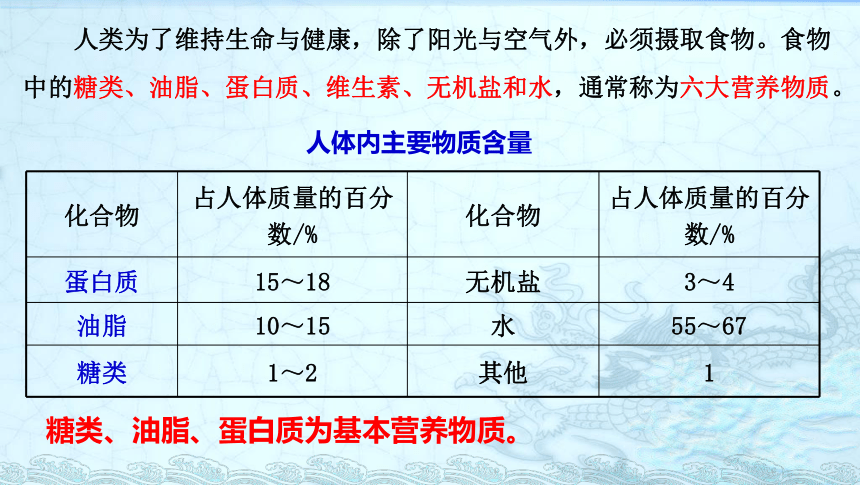
人类为了维持生命与健康,除了阳光与空气外,必须摄取食物。食物中的糖类、油脂、蛋白质、维生素、无机盐和水,通常称为六大营养物质。
化合物
占人体质量的百分数/%
化合物
占人体质量的百分数/%
蛋白质
15~18
无机盐
3~4
油脂
10~15
水
55~67
糖类
1~2
其他
1
人体内主要物质含量
糖类、油脂、蛋白质为基本营养物质。
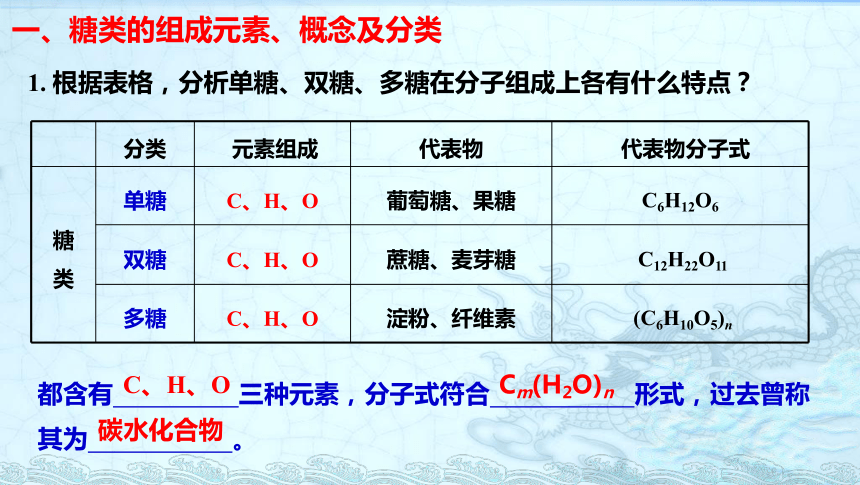
一、糖类的组成元素、概念及分类
分类
元素组成
代表物
代表物分子式
糖
类
单糖
C、H、O
葡萄糖、果糖
C6H12O6
双糖
C、H、O
蔗糖、麦芽糖
C12H22O11
多糖
C、H、O
淀粉、纤维素
(C6H10O5)n
1.
根据表格,分析单糖、双糖、多糖在分子组成上各有什么特点?
都含有
三种元素,分子式符合
形式,过去曾称其为
。
C、H、O
Cm(H2O)n
碳水化合物
H-C-OH
H-C-OH
H-C-OH
CHO
CH2OH
H-C-H
H-C-OH
H-C-OH
CHO
CH2OH
核糖
2-脱氧核糖
核糖(C5H10O5)和脱氧核糖(C5H10O4)是单糖中两种重要的五碳醛糖,其结构简式分别为:
小结一:糖的分子式不一定符合Cm(H2O)n
的形式
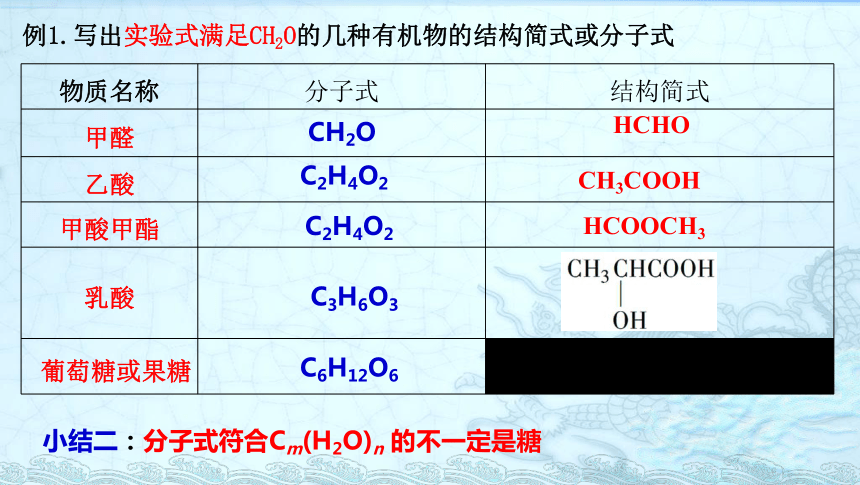
例1.写出实验式满足CH2O的几种有机物的结构简式或分子式
物质名称
分子式
结构简式
甲醛
乙酸
甲酸甲酯
乳酸
葡萄糖或果糖
C6H12O6
C2H4O2
C3H6O3
CH2O
C2H4O2
CH3COOH
HCHO
HCOOCH3
小结二:分子式符合Cm(H2O)n
的不一定是糖
生活中的甜味物质
小结三:有甜味的比一定是糖,糖不一定有甜味
糖精,化学合成甜味剂,甜度为蔗糖的300倍到500倍,无营养。
阿斯巴甜,化学合成甜味剂,甜度一般约为蔗糖的200倍。
木糖醇,天然植物甜味剂
,其甜度可达到蔗糖的1.2倍。
甜蜜素,化学合成甜味剂,甜度是蔗糖的30~40倍,摄入过量对人体的肝脏和神经系统造成危害。
2.
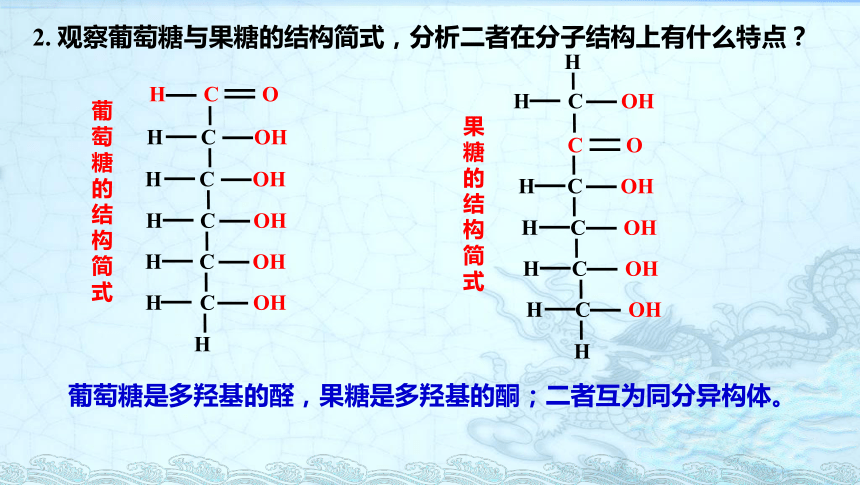
观察葡萄糖与果糖的结构简式,分析二者在分子结构上有什么特点?
葡
萄
糖
的
结
构
简
式
果
糖
的
结
构
简
式
H
H
C
O
H
C
OH
H
C
OH
H
C
OH
H
C
OH
H
C
OH
H
C
O
H
C
OH
H
C
OH
H
C
OH
H
C
OH
H
C
OH
H
葡萄糖是多羟基的醛,果糖是多羟基的酮;二者互为同分异构体。
由
三种元素组成的一类有机化合物,从结构上看,它一般是多羟基醛或多羟基酮,以及水解生成它们的物质。
1.糖类的定义
①糖的分子式不一定符合Cm(H2O)n
的形式
③有甜味的比一定是糖,糖不一定有甜味
②分子式符合Cm(H2O)n
的不一定是糖
C、H、O
2.糖的分类
根据其能否水解以及水解产物的多少不同,分为:
、
、
。
单糖
双糖
多糖
(3)多糖:1
mol多糖水解后能产生很多摩尔单糖,如淀粉、
等,
是
,是
。
(2)低聚糖:1
mol低聚糖水解后能产生
单糖。若水解生成2
mol单糖,则称为
,重要的二糖有
、
和
等。
(1)单糖:凡是
的糖称为单糖。如
、
核糖及脱氧核糖等。
不能水解
葡萄糖
果糖
2~10
mol
二糖
麦芽糖
乳糖
蔗糖
纤维素
高分子
混合物
二、葡萄糖的结构和性质
葡萄糖
葡萄糖的特征反应
碱性条件下煮沸与新制Cu(OH)2反应,产生砖红色沉淀。
工业制镜原理
碱性条件下温水浴与银氨溶液反应,有银镜生成。
糖尿病检验
葡萄糖的化学反应
C6H12O6(s)+6O2(g)→6CO2(g)+6H2O(l)
葡萄糖的生理氧化:
C6H12O6
2C2H5OH+2CO2
葡萄糖酿酒:
决定
结构
性质
体现
—OH
(醇的性质)
—CHO(醛的性质)
(1)羟基的性质(类比乙醇)
①与金属钠反应放出H2:1
mol葡萄糖与足量钠反应放出H2
mol。
②酯化反应:1
mol葡萄糖能与
mol乙酸发生酯化反应。
2.5
5
(2)醛基的还原性(氧化反应)
①银镜反应
配制银氨溶液:在稀硝酸银溶液中逐滴滴加稀氨水溶液,至产生的白色沉淀恰好溶解为止。
AgNO3+NH3·H2O
=
AgOH↓+NH4NO3
AgOH+NH3·H2O
=[Ag(NH3)2]OH
+2H2O
(氢氧化二氨合银)
[Ag(NH3)2]OH
=[Ag(NH3)2]++OH—
CH2OH(CHOH)4CHO
+
2Ag(NH3)2OH
△
CH2OH(CHOH)4COONH4
+
H2O
+
2Ag↓+
3NH3
1.反应条件必须是在碱性环境且温水浴下;
2.醛基(—CHO)被氧化成羧基(—COOH)后又与NH3反应生成—COONH4。
3.1mol
–CHO被氧化,就应有2molAg被还原。
4.可用稀HNO3清洗试管内壁的银镜。
5.银氨溶液必须随配随用,不可久置,否则会产生易爆炸的物质。
银镜反应实验注意事项:
不加热时,多羟基物质能与新制氢氧化铜生成绛蓝色溶液
②与新制Cu(OH)2悬浊液反应
CH2OH(CHOH)4CHO
+
2Cu(OH)2
+NaOH
CH2OH(CHOH)4COONa
+
Cu2O↓
+
3H2O
(碱必须过量)
新制Cu(OH)2悬浊液的配置:在氢氧化钠溶液中滴加几滴稀的硫酸铜溶液。
注意:1.氢氧化铜悬浊液一定要新制
2.碱一定要过量
3.加热的温度为煮沸
因为醛基的存在,葡萄糖能被酸性KMnO4溶液、酸性K2Cr2O7溶液溴水等强氧化剂氧化
(2)醛基的氧化性(还原反应)
CH2
CH
CH
CH
CH
CHO
OH
OH
OH
OH
OH
CH2
CH
CH
CH
CH
CH2
OH
OH
OH
OH
OH
OH
己六醇(山梨醇)
+
H2
氧化反应:
还原反应:
有机物加氧去氢的反应,反应中,有机物被氧化
有机物加氢去氧的反应,反应中,有机物被还原
加成反应
三、蔗糖和麦芽糖(
分子式:C12H22O11
)-—二糖
1.蔗糖溶液、麦芽糖溶液还原性实验探究:
在盛有新制Cu(OH)2悬浊液的两支试管中,一支加入蔗糖溶液,另一支
加入麦芽糖溶液,分别加热。现象:
。
加蔗糖溶液的试管无明显现象,加入麦芽糖的试管有红色沉淀生成
小结:蔗糖分子中无醛基;
麦芽糖分子中有醛基,具有还原性
2.蔗糖溶液、麦芽糖溶液的的水解反应:
①实验现象:试管中最终有砖红色沉淀生成。
②实验结论:蔗糖水解产物中有
生成。
③实验成功的关键:先加足量NaOH溶液(中和酸),然后与新制Cu(OH)2悬浊液共热煮沸。
④反应方程式:
葡萄糖
C12H22O11+H2O
2C6H12O6
硫酸
△
C12H22O11+H2O
C6H12O6
+
C6H12O6
硫酸
△
蔗糖
葡萄糖
果糖
麦芽糖
葡萄糖
四、淀粉和纤维素[
分子式:(C6H10O5)n]—多糖
1.都没有还原性。由于n值不同,它们
同分异构体,它们都属于
化合物。
不是
天然高分子
2.淀粉是无嗅、无味的粉末状物质,除做食物外,主要用来生产葡萄糖和酒精,
溶于冷水,在热水中
。
不
淀粉颗粒会膨胀破裂(或形成胶状淀粉糊)
3.纤维素是
白色、无嗅、无味的具有纤维状结构的物质,
被人体吸收,在人体中的作用是
,一般不溶于
,纤维素含有
,可以与硝酸、醋酸等发生
反应,生成重要的化工原料硝酸纤维素和醋酸纤维素。
水和有机溶剂
羟基
酯化
不能
加强肠胃的蠕动,有通便功能
水解反应的化学方程式:
情况
现象A
现象B
结论
①
②
③
溶液呈蓝色
溶液呈蓝色
溶液不呈蓝色
未产生银镜
出现银镜
出现银镜
未水解
部分水解
完全水解
五、糖类物质的存在与应用
糖类
存在
主要应用
葡萄糖
蔗糖
淀粉
纤维素
水果、蔬菜、血液
工业原料、食品加工、医疗输液
甘蔗、甜菜
工业原料、食品加工
植物的种子和块茎
食品加工、生产葡萄糖和酒精
植物的茎、叶和皮
促进胃肠蠕动、造纸
学习目标
第四节
基本营养物质
第1课时
糖类
1.了解糖类的组成、分类和结构和主要应用。(学习重点)
2.掌握糖类的主要性质和特征反应。(学习重难点)
3.能够设计实验确认淀粉水解的产物及水解的程度。
人类为了维持生命与健康,除了阳光与空气外,必须摄取食物。食物中的糖类、油脂、蛋白质、维生素、无机盐和水,通常称为六大营养物质。
化合物
占人体质量的百分数/%
化合物
占人体质量的百分数/%
蛋白质
15~18
无机盐
3~4
油脂
10~15
水
55~67
糖类
1~2
其他
1
人体内主要物质含量
糖类、油脂、蛋白质为基本营养物质。
一、糖类的组成元素、概念及分类
分类
元素组成
代表物
代表物分子式
糖
类
单糖
C、H、O
葡萄糖、果糖
C6H12O6
双糖
C、H、O
蔗糖、麦芽糖
C12H22O11
多糖
C、H、O
淀粉、纤维素
(C6H10O5)n
1.
根据表格,分析单糖、双糖、多糖在分子组成上各有什么特点?
都含有
三种元素,分子式符合
形式,过去曾称其为
。
C、H、O
Cm(H2O)n
碳水化合物
H-C-OH
H-C-OH
H-C-OH
CHO
CH2OH
H-C-H
H-C-OH
H-C-OH
CHO
CH2OH
核糖
2-脱氧核糖
核糖(C5H10O5)和脱氧核糖(C5H10O4)是单糖中两种重要的五碳醛糖,其结构简式分别为:
小结一:糖的分子式不一定符合Cm(H2O)n
的形式
例1.写出实验式满足CH2O的几种有机物的结构简式或分子式
物质名称
分子式
结构简式
甲醛
乙酸
甲酸甲酯
乳酸
葡萄糖或果糖
C6H12O6
C2H4O2
C3H6O3
CH2O
C2H4O2
CH3COOH
HCHO
HCOOCH3
小结二:分子式符合Cm(H2O)n
的不一定是糖
生活中的甜味物质
小结三:有甜味的比一定是糖,糖不一定有甜味
糖精,化学合成甜味剂,甜度为蔗糖的300倍到500倍,无营养。
阿斯巴甜,化学合成甜味剂,甜度一般约为蔗糖的200倍。
木糖醇,天然植物甜味剂
,其甜度可达到蔗糖的1.2倍。
甜蜜素,化学合成甜味剂,甜度是蔗糖的30~40倍,摄入过量对人体的肝脏和神经系统造成危害。
2.
观察葡萄糖与果糖的结构简式,分析二者在分子结构上有什么特点?
葡
萄
糖
的
结
构
简
式
果
糖
的
结
构
简
式
H
H
C
O
H
C
OH
H
C
OH
H
C
OH
H
C
OH
H
C
OH
H
C
O
H
C
OH
H
C
OH
H
C
OH
H
C
OH
H
C
OH
H
葡萄糖是多羟基的醛,果糖是多羟基的酮;二者互为同分异构体。
由
三种元素组成的一类有机化合物,从结构上看,它一般是多羟基醛或多羟基酮,以及水解生成它们的物质。
1.糖类的定义
①糖的分子式不一定符合Cm(H2O)n
的形式
③有甜味的比一定是糖,糖不一定有甜味
②分子式符合Cm(H2O)n
的不一定是糖
C、H、O
2.糖的分类
根据其能否水解以及水解产物的多少不同,分为:
、
、
。
单糖
双糖
多糖
(3)多糖:1
mol多糖水解后能产生很多摩尔单糖,如淀粉、
等,
是
,是
。
(2)低聚糖:1
mol低聚糖水解后能产生
单糖。若水解生成2
mol单糖,则称为
,重要的二糖有
、
和
等。
(1)单糖:凡是
的糖称为单糖。如
、
核糖及脱氧核糖等。
不能水解
葡萄糖
果糖
2~10
mol
二糖
麦芽糖
乳糖
蔗糖
纤维素
高分子
混合物
二、葡萄糖的结构和性质
葡萄糖
葡萄糖的特征反应
碱性条件下煮沸与新制Cu(OH)2反应,产生砖红色沉淀。
工业制镜原理
碱性条件下温水浴与银氨溶液反应,有银镜生成。
糖尿病检验
葡萄糖的化学反应
C6H12O6(s)+6O2(g)→6CO2(g)+6H2O(l)
葡萄糖的生理氧化:
C6H12O6
2C2H5OH+2CO2
葡萄糖酿酒:
决定
结构
性质
体现
—OH
(醇的性质)
—CHO(醛的性质)
(1)羟基的性质(类比乙醇)
①与金属钠反应放出H2:1
mol葡萄糖与足量钠反应放出H2
mol。
②酯化反应:1
mol葡萄糖能与
mol乙酸发生酯化反应。
2.5
5
(2)醛基的还原性(氧化反应)
①银镜反应
配制银氨溶液:在稀硝酸银溶液中逐滴滴加稀氨水溶液,至产生的白色沉淀恰好溶解为止。
AgNO3+NH3·H2O
=
AgOH↓+NH4NO3
AgOH+NH3·H2O
=[Ag(NH3)2]OH
+2H2O
(氢氧化二氨合银)
[Ag(NH3)2]OH
=[Ag(NH3)2]++OH—
CH2OH(CHOH)4CHO
+
2Ag(NH3)2OH
△
CH2OH(CHOH)4COONH4
+
H2O
+
2Ag↓+
3NH3
1.反应条件必须是在碱性环境且温水浴下;
2.醛基(—CHO)被氧化成羧基(—COOH)后又与NH3反应生成—COONH4。
3.1mol
–CHO被氧化,就应有2molAg被还原。
4.可用稀HNO3清洗试管内壁的银镜。
5.银氨溶液必须随配随用,不可久置,否则会产生易爆炸的物质。
银镜反应实验注意事项:
不加热时,多羟基物质能与新制氢氧化铜生成绛蓝色溶液
②与新制Cu(OH)2悬浊液反应
CH2OH(CHOH)4CHO
+
2Cu(OH)2
+NaOH
CH2OH(CHOH)4COONa
+
Cu2O↓
+
3H2O
(碱必须过量)
新制Cu(OH)2悬浊液的配置:在氢氧化钠溶液中滴加几滴稀的硫酸铜溶液。
注意:1.氢氧化铜悬浊液一定要新制
2.碱一定要过量
3.加热的温度为煮沸
因为醛基的存在,葡萄糖能被酸性KMnO4溶液、酸性K2Cr2O7溶液溴水等强氧化剂氧化
(2)醛基的氧化性(还原反应)
CH2
CH
CH
CH
CH
CHO
OH
OH
OH
OH
OH
CH2
CH
CH
CH
CH
CH2
OH
OH
OH
OH
OH
OH
己六醇(山梨醇)
+
H2
氧化反应:
还原反应:
有机物加氧去氢的反应,反应中,有机物被氧化
有机物加氢去氧的反应,反应中,有机物被还原
加成反应
三、蔗糖和麦芽糖(
分子式:C12H22O11
)-—二糖
1.蔗糖溶液、麦芽糖溶液还原性实验探究:
在盛有新制Cu(OH)2悬浊液的两支试管中,一支加入蔗糖溶液,另一支
加入麦芽糖溶液,分别加热。现象:
。
加蔗糖溶液的试管无明显现象,加入麦芽糖的试管有红色沉淀生成
小结:蔗糖分子中无醛基;
麦芽糖分子中有醛基,具有还原性
2.蔗糖溶液、麦芽糖溶液的的水解反应:
①实验现象:试管中最终有砖红色沉淀生成。
②实验结论:蔗糖水解产物中有
生成。
③实验成功的关键:先加足量NaOH溶液(中和酸),然后与新制Cu(OH)2悬浊液共热煮沸。
④反应方程式:
葡萄糖
C12H22O11+H2O
2C6H12O6
硫酸
△
C12H22O11+H2O
C6H12O6
+
C6H12O6
硫酸
△
蔗糖
葡萄糖
果糖
麦芽糖
葡萄糖
四、淀粉和纤维素[
分子式:(C6H10O5)n]—多糖
1.都没有还原性。由于n值不同,它们
同分异构体,它们都属于
化合物。
不是
天然高分子
2.淀粉是无嗅、无味的粉末状物质,除做食物外,主要用来生产葡萄糖和酒精,
溶于冷水,在热水中
。
不
淀粉颗粒会膨胀破裂(或形成胶状淀粉糊)
3.纤维素是
白色、无嗅、无味的具有纤维状结构的物质,
被人体吸收,在人体中的作用是
,一般不溶于
,纤维素含有
,可以与硝酸、醋酸等发生
反应,生成重要的化工原料硝酸纤维素和醋酸纤维素。
水和有机溶剂
羟基
酯化
不能
加强肠胃的蠕动,有通便功能
水解反应的化学方程式:
情况
现象A
现象B
结论
①
②
③
溶液呈蓝色
溶液呈蓝色
溶液不呈蓝色
未产生银镜
出现银镜
出现银镜
未水解
部分水解
完全水解
五、糖类物质的存在与应用
糖类
存在
主要应用
葡萄糖
蔗糖
淀粉
纤维素
水果、蔬菜、血液
工业原料、食品加工、医疗输液
甘蔗、甜菜
工业原料、食品加工
植物的种子和块茎
食品加工、生产葡萄糖和酒精
植物的茎、叶和皮
促进胃肠蠕动、造纸
