人教版九年级下册化学:10.2 酸和碱的中和反应 课件(共26张PPT)
文档属性
| 名称 | 人教版九年级下册化学:10.2 酸和碱的中和反应 课件(共26张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 1.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-05-26 20:20:19 | ||
图片预览




文档简介
(共26张PPT)
【学习目标】
1、知道酸和碱之间发生的中和反应;
2、了解酸碱性对生命活动和农作物的影响,以及中和反应在实际中的应用;
3、会用PH试纸检验溶液的酸碱性.了解溶液的酸碱度在实际中的意义;
4、会用分析、归纳的方法对有关信息加工处理;
5、会用观察的方法辨析事物;
6、学习化学应理论联系实际;
7、进一步
增强学习化学的兴趣。
写出下列常见物质的化学式
HCl
H2SO4
H2CO3
NaOH
Ca(OH)2
Cu(OH)2
?
【我会填空】
酸
盐酸_______
硫酸_______
碳酸_______
氢氧化钠__________
碱
氢氧化钙__________
氢氧化铜__________
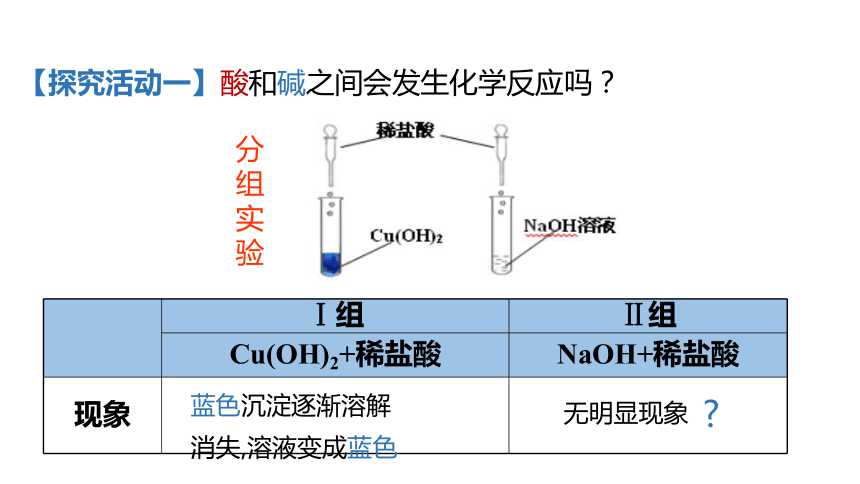
【探究活动一】酸和碱之间会发生化学反应吗?
分
组
实
验
蓝色沉淀逐渐溶解
消失,溶液变成蓝色
无明显现象
?
Ⅰ组
Ⅱ组
Cu(OH)2+稀盐酸
NaOH+稀盐酸
现象
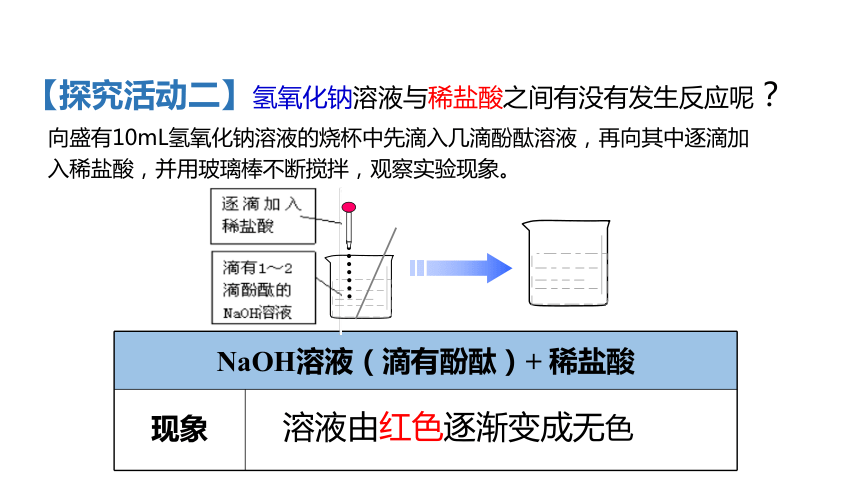
【探究活动二】氢氧化钠溶液与稀盐酸之间有没有发生反应呢?
向盛有10mL氢氧化钠溶液的烧杯中先滴入几滴酚酞溶液,再向其中逐滴加入稀盐酸,并用玻璃棒不断搅拌,观察实验现象。
溶液由红色逐渐变成无色
NaOH溶液(滴有酚酞)+
稀盐酸
现象
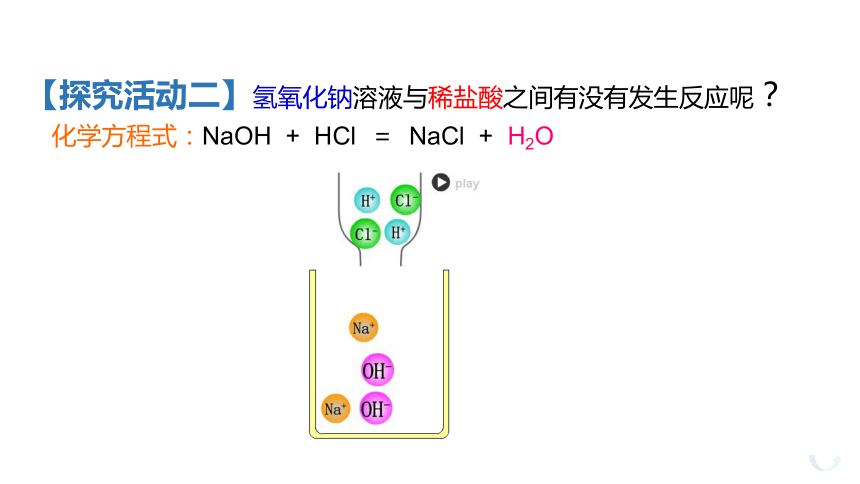
化学方程式:NaOH
+
HCl
=
NaCl
+
H2O
【探究活动二】氢氧化钠溶液与稀盐酸之间有没有发生反应呢?
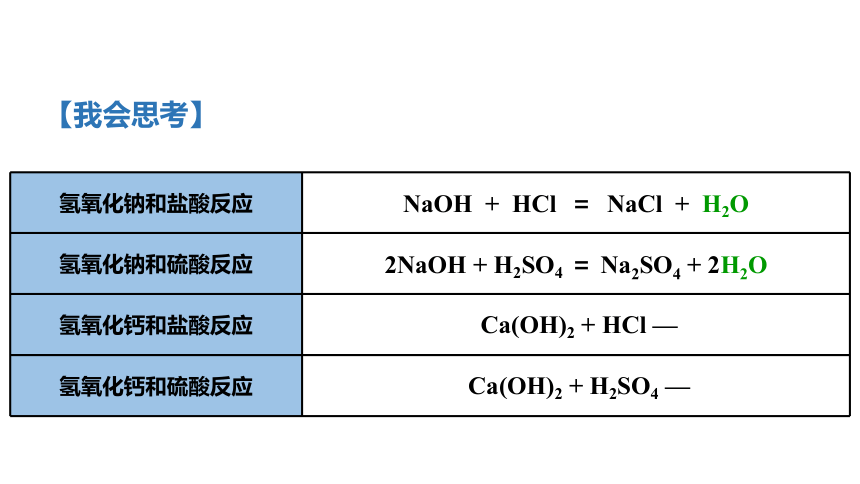
【我会思考】
氢氧化钠和盐酸反应
NaOH
+
HCl
=
NaCl
+
H2O
氢氧化钠和硫酸反应
2NaOH
+
H2SO4
=
Na2SO4
+
2H2O
氢氧化钙和盐酸反应
Ca(OH)2
+
HCl
—
氢氧化钙和硫酸反应
Ca(OH)2
+
H2SO4
—
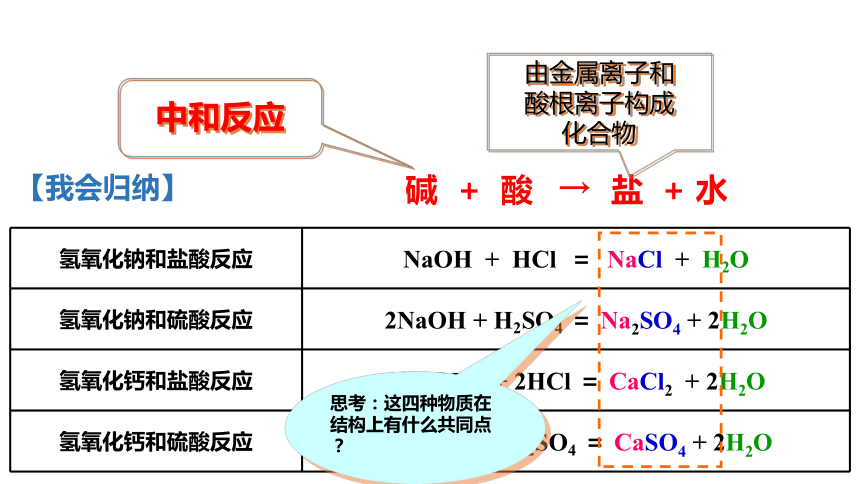
思考:这四种物质在结构上有什么共同点?
盐
由金属离子和
酸根离子构成
化合物
碱
+
酸
→
+
水
中和反应
【我会归纳】
氢氧化钠和盐酸反应
NaOH
+
HCl
=
NaCl
+
H2O
氢氧化钠和硫酸反应
2NaOH
+
H2SO4
=
Na2SO4
+
2H2O
氢氧化钙和盐酸反应
Ca(OH)2
+
2HCl
=
CaCl2
+
2H2O
氢氧化钙和硫酸反应
Ca(OH)2
+
H2SO4
=
CaSO4
+
2H2O
1.下列化合物中属于盐的是(
)
A.CO2
B.Ca(OH)2
C.Na2CO3
D.H2SO4
C
2.
下列物质之间的反应属于中和反应的是
(
)
A.
2NaOH+CO2=Na2CO3+H2O
B.
CaCO3+2HCl=CaCl2+H2O+CO2↑
C.
Fe+2HCl=FeCl2+H2↑
D.
2NaOH+H2SO4=Na2SO4+2H2O
D
【课堂练习】
中和反应的实质:
【探究活动三】中和反应的实质是什么?
+
反应前
反应后
1.如图所示是盐酸滴入氢氧化钠溶液时,有关粒子之间反应的示意图,下列说法错误的是(
)
A.
盐酸溶液中含有氢离子和氯离子
B.
氢氧化钠溶液中含有钠离子和氢氧根离子
C.
两种溶液混合时,氢离子与氢氧根离子结合生成水分子
D.
两种溶液混合时,钠离子与氯离子结合生成氯化钠分子
D
【我会思考】
(1)一块土壤酸性太强,不利于作物的生长,怎样降低土壤的酸性?
(2)做完实验后剩余的盐酸能否直接倒入下水道中?应怎样处理?
(3)治疗胃酸过多的药物的主要成分是Al(OH)3,它的作用原理是什么?(写出化学方程式)
Al(OH)3
+
___HCl
=
_______
+
________
【探究活动四】中和反应在实际生活中的应用
3
AlCl3
3H2O
1.农业上:
改变土壤的酸碱性(在酸性土壤中加入
)
熟石灰
2.工业上:
处理工厂的废水(如中和硫酸厂排放的废硫酸常用
)
3.医药上:
治疗胃酸过多;蚊虫叮咬等
熟石灰
中和反应在实际生活中的应用
中和反应
应
用
农业
工业
医药
定义
实质
【课堂总结】
你知道橘子汁和白醋显酸性还是碱性?
哪种酸性更强?
【生活中的化学】
在生产生活和科学研究中,有时仅知道溶液是酸性还是碱性是不够的,经常还需要知道溶液的酸碱性强弱程度(溶液的酸碱度)。
溶液酸碱度的表示法——pH,pH的范围通常在0~14之间。
pH<7溶液显酸性
pH=7溶液显中性
pH>7溶液显碱性
【知识探索】
测定pH最简便的方法是用pH试纸。
pH试纸
【知识探索】
酸溶液变稀,酸性变弱,
pH变大;
碱溶液变稀,碱性变弱,
pH变小。
【活动探究】
使用的注意事项:
1、不能直接把试纸浸入试液,否则会污染试液。
2、不能先用蒸馏水湿润pH试纸,否则会稀释试液的浓度,测出来的pH就不准确了。
在测定某未知待测液时,先用水润湿pH试纸,其测定结果会如何?
若未知液显酸性,则pH偏大;
若未知液显碱性,则pH偏小;
若未知液显中性,则pH不变。
测定生活中一些物质的pH,说明它们的酸碱性。
3-4
7
6-7
4-5
10
3-4
7
6-7
11
12-13
【动手试一试】
如图,身边一些物质的pH,下列说法正确的是(
)
A.胃酸过多的人不宜多吃柠檬
B.橘子的酸性比牛奶弱
C.肥皂水能使紫色石蕊溶液变红
D.西瓜属于碱性食品
A
【知识探究】
◆
化工生产中许多反应必须在一定pH溶液里才能进行。
◆
在农业生产中,农作物一般适宜在pH为7或接近7的土壤中生长。
◆
测定雨水的pH(因溶解有二氧化碳,正常雨水的pH约为5.6,酸雨的pH小于5.6),可以了解空气的污染情况。
◆
测定人体内排出的液体的pH,可以了解人体的健康状况。
了解溶液的酸碱度有重要的意义。例如:
【知识探究】
溶液的酸碱度对头发有什么影响?对你选择洗发液有什么启示?
健康的头发
受损伤的头发
【你能解释吗】
改变酸碱度强弱的方法
⑴使酸性溶液的pH升高
⑵使碱性溶液的pH降低
酸中加水
酸中加碱
碱中加酸
碱中加水
应加水或碱性溶液
应加水或酸性溶液
【练习】在用稀盐酸和氢氧化钠溶液进行中和反应实验时,反应过程中该溶液的酸碱度变化如图:
(1)该反应的化学方程式为:
。
(2)该实验操作是将
滴到另一种溶液中。
(3)当加入溶液的质量为a
g时,所得溶液中的溶质是
。(填化学式)
(4)当加入溶液的质量为b
g时,向所得溶液中滴加酚酞溶液,溶液呈
。
(5)若用10%的氢氧化钠溶液恰好中和60g稀盐酸,求所得溶液溶质的质量分数为多少?(Na-23
Cl-35.5
O-16
H-1)
HCl+NaOH═NaCl+H2O
氢氧化钠溶液
HCl
和
NaCl
红色
5.85%
【学习目标】
1、知道酸和碱之间发生的中和反应;
2、了解酸碱性对生命活动和农作物的影响,以及中和反应在实际中的应用;
3、会用PH试纸检验溶液的酸碱性.了解溶液的酸碱度在实际中的意义;
4、会用分析、归纳的方法对有关信息加工处理;
5、会用观察的方法辨析事物;
6、学习化学应理论联系实际;
7、进一步
增强学习化学的兴趣。
写出下列常见物质的化学式
HCl
H2SO4
H2CO3
NaOH
Ca(OH)2
Cu(OH)2
?
【我会填空】
酸
盐酸_______
硫酸_______
碳酸_______
氢氧化钠__________
碱
氢氧化钙__________
氢氧化铜__________
【探究活动一】酸和碱之间会发生化学反应吗?
分
组
实
验
蓝色沉淀逐渐溶解
消失,溶液变成蓝色
无明显现象
?
Ⅰ组
Ⅱ组
Cu(OH)2+稀盐酸
NaOH+稀盐酸
现象
【探究活动二】氢氧化钠溶液与稀盐酸之间有没有发生反应呢?
向盛有10mL氢氧化钠溶液的烧杯中先滴入几滴酚酞溶液,再向其中逐滴加入稀盐酸,并用玻璃棒不断搅拌,观察实验现象。
溶液由红色逐渐变成无色
NaOH溶液(滴有酚酞)+
稀盐酸
现象
化学方程式:NaOH
+
HCl
=
NaCl
+
H2O
【探究活动二】氢氧化钠溶液与稀盐酸之间有没有发生反应呢?
【我会思考】
氢氧化钠和盐酸反应
NaOH
+
HCl
=
NaCl
+
H2O
氢氧化钠和硫酸反应
2NaOH
+
H2SO4
=
Na2SO4
+
2H2O
氢氧化钙和盐酸反应
Ca(OH)2
+
HCl
—
氢氧化钙和硫酸反应
Ca(OH)2
+
H2SO4
—
思考:这四种物质在结构上有什么共同点?
盐
由金属离子和
酸根离子构成
化合物
碱
+
酸
→
+
水
中和反应
【我会归纳】
氢氧化钠和盐酸反应
NaOH
+
HCl
=
NaCl
+
H2O
氢氧化钠和硫酸反应
2NaOH
+
H2SO4
=
Na2SO4
+
2H2O
氢氧化钙和盐酸反应
Ca(OH)2
+
2HCl
=
CaCl2
+
2H2O
氢氧化钙和硫酸反应
Ca(OH)2
+
H2SO4
=
CaSO4
+
2H2O
1.下列化合物中属于盐的是(
)
A.CO2
B.Ca(OH)2
C.Na2CO3
D.H2SO4
C
2.
下列物质之间的反应属于中和反应的是
(
)
A.
2NaOH+CO2=Na2CO3+H2O
B.
CaCO3+2HCl=CaCl2+H2O+CO2↑
C.
Fe+2HCl=FeCl2+H2↑
D.
2NaOH+H2SO4=Na2SO4+2H2O
D
【课堂练习】
中和反应的实质:
【探究活动三】中和反应的实质是什么?
+
反应前
反应后
1.如图所示是盐酸滴入氢氧化钠溶液时,有关粒子之间反应的示意图,下列说法错误的是(
)
A.
盐酸溶液中含有氢离子和氯离子
B.
氢氧化钠溶液中含有钠离子和氢氧根离子
C.
两种溶液混合时,氢离子与氢氧根离子结合生成水分子
D.
两种溶液混合时,钠离子与氯离子结合生成氯化钠分子
D
【我会思考】
(1)一块土壤酸性太强,不利于作物的生长,怎样降低土壤的酸性?
(2)做完实验后剩余的盐酸能否直接倒入下水道中?应怎样处理?
(3)治疗胃酸过多的药物的主要成分是Al(OH)3,它的作用原理是什么?(写出化学方程式)
Al(OH)3
+
___HCl
=
_______
+
________
【探究活动四】中和反应在实际生活中的应用
3
AlCl3
3H2O
1.农业上:
改变土壤的酸碱性(在酸性土壤中加入
)
熟石灰
2.工业上:
处理工厂的废水(如中和硫酸厂排放的废硫酸常用
)
3.医药上:
治疗胃酸过多;蚊虫叮咬等
熟石灰
中和反应在实际生活中的应用
中和反应
应
用
农业
工业
医药
定义
实质
【课堂总结】
你知道橘子汁和白醋显酸性还是碱性?
哪种酸性更强?
【生活中的化学】
在生产生活和科学研究中,有时仅知道溶液是酸性还是碱性是不够的,经常还需要知道溶液的酸碱性强弱程度(溶液的酸碱度)。
溶液酸碱度的表示法——pH,pH的范围通常在0~14之间。
pH<7溶液显酸性
pH=7溶液显中性
pH>7溶液显碱性
【知识探索】
测定pH最简便的方法是用pH试纸。
pH试纸
【知识探索】
酸溶液变稀,酸性变弱,
pH变大;
碱溶液变稀,碱性变弱,
pH变小。
【活动探究】
使用的注意事项:
1、不能直接把试纸浸入试液,否则会污染试液。
2、不能先用蒸馏水湿润pH试纸,否则会稀释试液的浓度,测出来的pH就不准确了。
在测定某未知待测液时,先用水润湿pH试纸,其测定结果会如何?
若未知液显酸性,则pH偏大;
若未知液显碱性,则pH偏小;
若未知液显中性,则pH不变。
测定生活中一些物质的pH,说明它们的酸碱性。
3-4
7
6-7
4-5
10
3-4
7
6-7
11
12-13
【动手试一试】
如图,身边一些物质的pH,下列说法正确的是(
)
A.胃酸过多的人不宜多吃柠檬
B.橘子的酸性比牛奶弱
C.肥皂水能使紫色石蕊溶液变红
D.西瓜属于碱性食品
A
【知识探究】
◆
化工生产中许多反应必须在一定pH溶液里才能进行。
◆
在农业生产中,农作物一般适宜在pH为7或接近7的土壤中生长。
◆
测定雨水的pH(因溶解有二氧化碳,正常雨水的pH约为5.6,酸雨的pH小于5.6),可以了解空气的污染情况。
◆
测定人体内排出的液体的pH,可以了解人体的健康状况。
了解溶液的酸碱度有重要的意义。例如:
【知识探究】
溶液的酸碱度对头发有什么影响?对你选择洗发液有什么启示?
健康的头发
受损伤的头发
【你能解释吗】
改变酸碱度强弱的方法
⑴使酸性溶液的pH升高
⑵使碱性溶液的pH降低
酸中加水
酸中加碱
碱中加酸
碱中加水
应加水或碱性溶液
应加水或酸性溶液
【练习】在用稀盐酸和氢氧化钠溶液进行中和反应实验时,反应过程中该溶液的酸碱度变化如图:
(1)该反应的化学方程式为:
。
(2)该实验操作是将
滴到另一种溶液中。
(3)当加入溶液的质量为a
g时,所得溶液中的溶质是
。(填化学式)
(4)当加入溶液的质量为b
g时,向所得溶液中滴加酚酞溶液,溶液呈
。
(5)若用10%的氢氧化钠溶液恰好中和60g稀盐酸,求所得溶液溶质的质量分数为多少?(Na-23
Cl-35.5
O-16
H-1)
HCl+NaOH═NaCl+H2O
氢氧化钠溶液
HCl
和
NaCl
红色
5.85%
同课章节目录
