人教版高中化学选修4第二章第二节 影响化学反应速率的因素课件(共16张PPT)
文档属性
| 名称 | 人教版高中化学选修4第二章第二节 影响化学反应速率的因素课件(共16张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 383.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-05-27 20:14:08 | ||
图片预览





文档简介
(共16张PPT)
影响化学反应的因素
1、
在通常情况下,Na与水的反应和Mg与水的反应哪个剧烈(反应速率快)?为什么?
2、将等物质的量的碳酸钠与碳酸氢钠放入等体积等浓度的盐酸中,产生CO2的速率哪个较快?为什么?
以上说明化学反应速率的决定因素是什么?
决定化学反应速率的主要因素
决定化学反应速率的因素是参加反应的物质本身的化学性质。
没合适的取向
没足够的能量
足够的能量
+合适的取向
类比法:借鉴投篮
碰
撞
理
论
n活=n总×活%
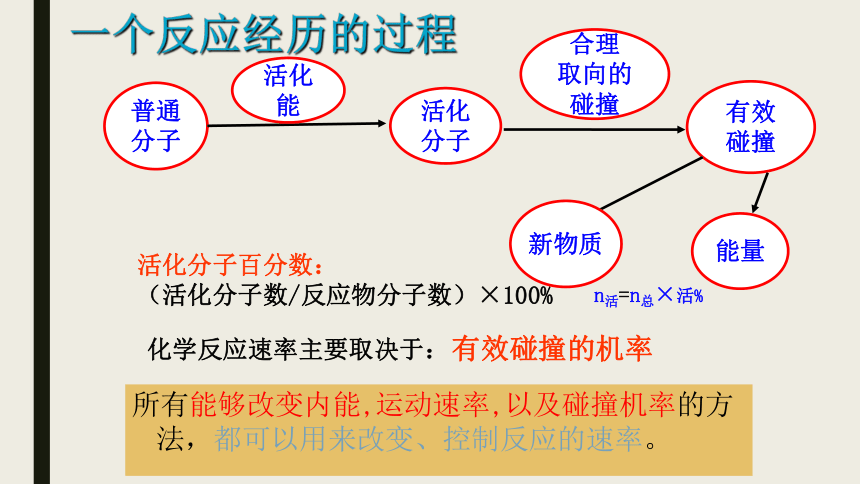
活化分子百分数:
(活化分子数/反应物分子数)×100%
化学反应速率主要取决于:
所有能够改变内能,运动速率,以及碰撞机率的方法,都可以用来改变、控制反应的速率。
一个反应经历的过程
普通
分子
活化
能
活化
分子
合理
取向的
碰撞
有效
碰撞
新物质
能量
有效碰撞的机率
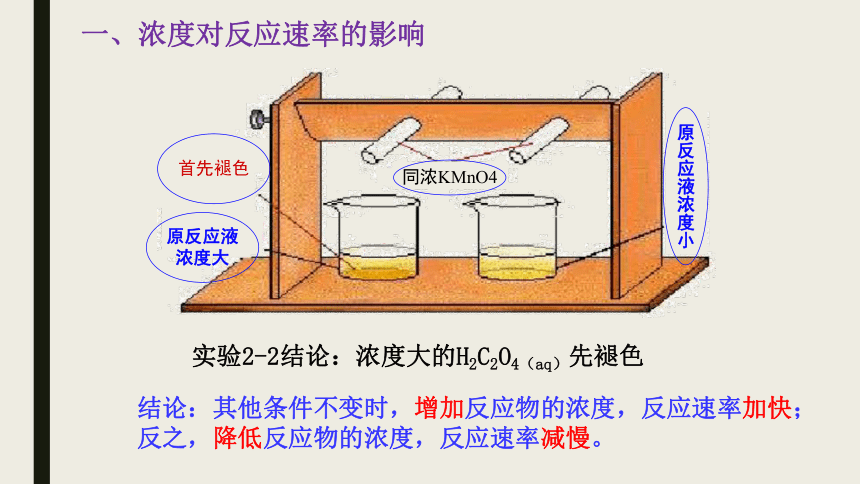
一、浓度对反应速率的影响
实验2-2结论:浓度大的H2C2O4(aq)先褪色
结论:其他条件不变时,增加反应物的浓度,反应速率加快;反之,降低反应物的浓度,反应速率减慢。
本质原因
浓度对反应速率的影响
浓度↑→单位体积内总分子数↑
温度不变,活化分子百分比不变
→有效碰撞↑
→V↑
反应物浓度增大,单位体积内活化分子数增多,有效碰撞的频率增加,反应速率增大。
注
意
1、对于纯固体或纯液体,其浓度可视为常数,因而其物质的量改变时不影响化学反应速率;
2、随着化学反应的进行,反应物的浓度会逐渐减小,因此一般反应速率也会逐渐减小。
二、压强对反应速率的影响
原因:对气体来说,若其他条件不变,增大压强,就是增加单位体积的反应物的物质的量,即增加反应物的浓度
压强增大
→
体积减小→气体浓度增大
温度不变,活化分子百分比不变
分子数不变
→V↑
有效碰撞↑
规律:对于有气体参加的反应,若其他条件不变,增大压强,气体体积缩小,浓度增大,反应速率加快;减小压强,反应速率减慢。
1、压强对于反应速率的影响是通过对浓度的影响实现的
2、压强只对于有气体参加的反应的速率有影响
注
意
三、温度对反应速率的影响
实验2-3结论:温度高的溶液先出现浑浊
结论:其他条件不变时,升高温度,反应速率增大;
反之,降低温度,反应速率减慢。
本质原因
温度增大
→
普通分子变为活化分子→活化分子百分比增大→活化分子数增大→V↑
1、温度对反应速率影响的规律,对吸热反应,放热反应
都适用
2、反应若是可逆反应,升高温度,正、逆反应速率都加快,
降低温度,正、逆反应速率都减小
3、一般说来,温度每升高10℃,速率增加2-4倍
注
意
四、催化剂对反应速率的影响
实验2-4结论:加入催化剂可以加快反应的速率
催化剂:能改变化学反应速率而自身的化学组成和质量在反应前后保持不变
加快化学反应速率
减慢化学反应速率
注:不说明指正催化剂
能量
反应过程
E1
E2
反应物
生成物
活化分子
活化能
活化分子变成生成物分子放出的能量
反应热
没加催化剂
加了催化剂
使用催化剂→
反应所需能量降低→普通分子变成活化分子→活化分子数百分数增大→V↑
本质原因
1、凡是能改变反应速率而自身在化学变化前后化学性质和质量
没有发生变化的物质叫催化剂。
2、催化剂只能催化可能发生的反应,对不发生的反应无作用
3、催化剂中毒:催化剂的活性因接触少量的杂质而明显下降甚
至遭到破坏,这种现象叫催化剂中毒。
注
意
外界条件对化学反应速率的影响(总结)
增加
不变
不变
不变
不变
不变
增加
增加
增加
增加
增加
增加
增加
增加
增加
不变
影响因素
分子总数
活化分子
百分数
活化分子总数
活化分子浓度
(单位体积活化分子数)
增大浓度
增大压强
升高温度
正催化剂
影响化学反应的因素
1、
在通常情况下,Na与水的反应和Mg与水的反应哪个剧烈(反应速率快)?为什么?
2、将等物质的量的碳酸钠与碳酸氢钠放入等体积等浓度的盐酸中,产生CO2的速率哪个较快?为什么?
以上说明化学反应速率的决定因素是什么?
决定化学反应速率的主要因素
决定化学反应速率的因素是参加反应的物质本身的化学性质。
没合适的取向
没足够的能量
足够的能量
+合适的取向
类比法:借鉴投篮
碰
撞
理
论
n活=n总×活%
活化分子百分数:
(活化分子数/反应物分子数)×100%
化学反应速率主要取决于:
所有能够改变内能,运动速率,以及碰撞机率的方法,都可以用来改变、控制反应的速率。
一个反应经历的过程
普通
分子
活化
能
活化
分子
合理
取向的
碰撞
有效
碰撞
新物质
能量
有效碰撞的机率
一、浓度对反应速率的影响
实验2-2结论:浓度大的H2C2O4(aq)先褪色
结论:其他条件不变时,增加反应物的浓度,反应速率加快;反之,降低反应物的浓度,反应速率减慢。
本质原因
浓度对反应速率的影响
浓度↑→单位体积内总分子数↑
温度不变,活化分子百分比不变
→有效碰撞↑
→V↑
反应物浓度增大,单位体积内活化分子数增多,有效碰撞的频率增加,反应速率增大。
注
意
1、对于纯固体或纯液体,其浓度可视为常数,因而其物质的量改变时不影响化学反应速率;
2、随着化学反应的进行,反应物的浓度会逐渐减小,因此一般反应速率也会逐渐减小。
二、压强对反应速率的影响
原因:对气体来说,若其他条件不变,增大压强,就是增加单位体积的反应物的物质的量,即增加反应物的浓度
压强增大
→
体积减小→气体浓度增大
温度不变,活化分子百分比不变
分子数不变
→V↑
有效碰撞↑
规律:对于有气体参加的反应,若其他条件不变,增大压强,气体体积缩小,浓度增大,反应速率加快;减小压强,反应速率减慢。
1、压强对于反应速率的影响是通过对浓度的影响实现的
2、压强只对于有气体参加的反应的速率有影响
注
意
三、温度对反应速率的影响
实验2-3结论:温度高的溶液先出现浑浊
结论:其他条件不变时,升高温度,反应速率增大;
反之,降低温度,反应速率减慢。
本质原因
温度增大
→
普通分子变为活化分子→活化分子百分比增大→活化分子数增大→V↑
1、温度对反应速率影响的规律,对吸热反应,放热反应
都适用
2、反应若是可逆反应,升高温度,正、逆反应速率都加快,
降低温度,正、逆反应速率都减小
3、一般说来,温度每升高10℃,速率增加2-4倍
注
意
四、催化剂对反应速率的影响
实验2-4结论:加入催化剂可以加快反应的速率
催化剂:能改变化学反应速率而自身的化学组成和质量在反应前后保持不变
加快化学反应速率
减慢化学反应速率
注:不说明指正催化剂
能量
反应过程
E1
E2
反应物
生成物
活化分子
活化能
活化分子变成生成物分子放出的能量
反应热
没加催化剂
加了催化剂
使用催化剂→
反应所需能量降低→普通分子变成活化分子→活化分子数百分数增大→V↑
本质原因
1、凡是能改变反应速率而自身在化学变化前后化学性质和质量
没有发生变化的物质叫催化剂。
2、催化剂只能催化可能发生的反应,对不发生的反应无作用
3、催化剂中毒:催化剂的活性因接触少量的杂质而明显下降甚
至遭到破坏,这种现象叫催化剂中毒。
注
意
外界条件对化学反应速率的影响(总结)
增加
不变
不变
不变
不变
不变
增加
增加
增加
增加
增加
增加
增加
增加
增加
不变
影响因素
分子总数
活化分子
百分数
活化分子总数
活化分子浓度
(单位体积活化分子数)
增大浓度
增大压强
升高温度
正催化剂
