人教版高二化学选修4第二章 第4节化学反应进行的方向(共23张PPT)
文档属性
| 名称 | 人教版高二化学选修4第二章 第4节化学反应进行的方向(共23张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 4.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-05-27 20:16:06 | ||
图片预览








文档简介
(共23张PPT)
第四节
化学反应进行的方向
自然界中水总是从高处往低处流;
正电荷是从电势高的地方向电势低的地方流动;
室温下冰块自动融化;
墨水扩散;
食盐溶解于水;
火柴棒散落等。
自发反应:在一定条件下不需外界帮助就能自动进行的反应。
自发过程:在一定条件下,不借助外部力量就能自动进行的过程。
如何判断一个过程、一个反应能否自发进行?
下列反应在一定条件下都能自发进行,你知道这些自发进行反应的共同特点吗?
C3H8(g)
+
5O2(g)
=
3CO2(g)
+
4H2O(l)
△H
=
-2217.5
kJ·mol-1
2Na(s)
+
Cl2(g)
=
2NaCl(s)
△H
=
-822
kJ·mol-1
4Fe(s)
+
3O2(g)
=
Fe2O3(s)
△H
=
-1648.4
kJ·mol-1
从能量角度分析它们为什么可以自发?
共同特点:△H
<
O
即放热反应
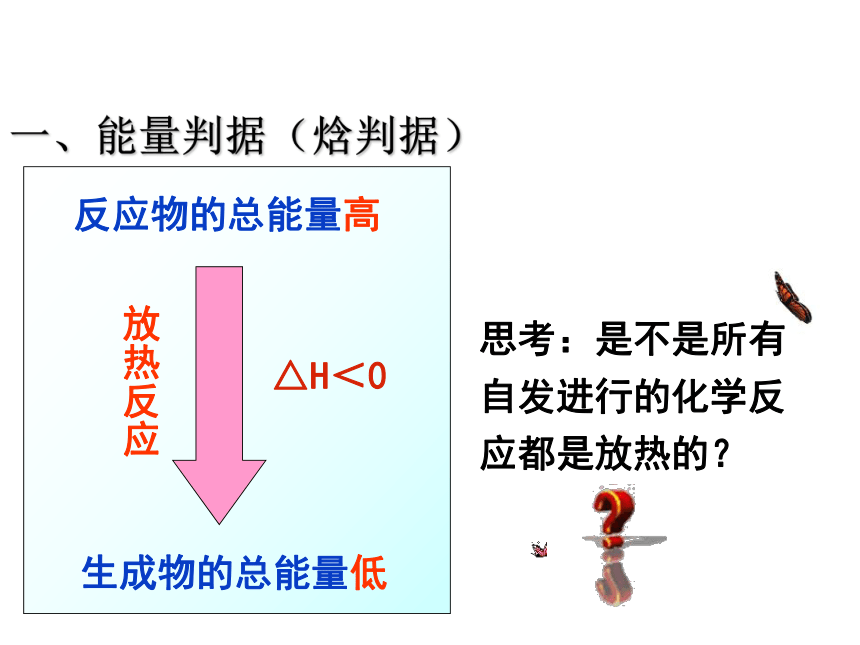
放热反应使体系能量降低,能量越低越稳定,△H
<
O
有利于反应自发进行
能量判据(焓判据)∶自发过程体系趋向于从高能状态转变为低能状态(这时体系会对外做功或者释放热量即△H
﹤0)。
思
与
题
问
考
化学反应进行方向的判据
一、能量判据(焓判据)
思考:是不是所有自发进行的化学反应都是放热的?
结论:△H
<
0有利于反应自发进行,
但自发反应不一定要△H
<
0
2N2O5(g)=4NO2(g)+O2
(g)
△H=+
56.7kJ/mol
(NH4)
2CO3(s)
=
NH4HCO3(s)+NH3(g)
△H=
+74.9kJ/mol
焓变只是反应能否自发进行的一个因素,但不是惟一因素。只根据焓变来判断反应方向是不全面的。
有序
混乱
火柴散落有趋向于最大混乱度的倾向
二、熵判据
1.
熵的含义:
熵是衡量体系混乱度大小的物理量,即熵是用来描述体系的混乱度的,符号用S表示,单位:
J?mol-1?K-1
。体系混乱度越大,熵值越大;体系混乱度越小,熵值越小
1、同一条件下,不同物质的熵值不同
2、同一物质气态时熵值最大,液态较小,固态时最小。
3、产生气体的反应,熵值增大。
4、反应过程中气体物质的量增加的反应,熵值增大。
熵值大小判断
2.
熵判据:
自发过程的体系趋向于由有序转变为无序,导致体系的熵增大,这一经验规律叫做熵增原理,也就是反应方向判断的熵判据
(NH4)2CO3(s)===NH4HCO3(s)+NH3(g)
2N2O5(g)===4NO(g)+O2(g)
体系熵增加
2NH4Cl(s)+Ba(OH)2(s)=BaCl2(s)+2NH3(g)+2H2O(l)
自发反应:
冰(有序)
水蒸气(无序)
自发过程,体系熵增加
反应的熵变与反应方向的关系:
1.多数熵增的反应在常温下自发进行(△S
>0)
2.有些熵增的反应在常温下不能进行,但在高温下则能自发进行.(△S
>0)
3.有些熵减的反应在一定条件下也能自发进行。
(△S
<0)
3.
熵
变:△S
=
S(生成物)-S(反应物)
2H2(g)+O2(g)=2H2O(l)
结论:△S
>
0
有利于反应自发进行
,自发反应不一定要△S
>
O
熵变是反应能否自发进行的又一个因素,但不是惟一因素。
△
G=△H—T
△S
三、复合判据(自由能变化)
当△
G<0时,反应自发进行
当△
G>0时,反应不自发进行
当△
G=0时,平衡状态
一个化学反应能否自发进行,既与反应焓变有关,又与反应熵变有关,恒温、恒压下,反应方向的判据是体系自由能变化(△
G)。
△H
△S
CaCO3(s)=
CaO(s)+
CO2(g)
△H
=
+
178.2
KJ·mol-1
△S
=
+169.6
J·mol-1·K-1
室温下反应不能自发进行;但在高温的条件下,则△H
-
T△S
<
0反应自发进行。
2NO(g)+
2CO(g)=
N2(g)
+
2CO2(g)
△H
=
-
113.0
KJ·mol-1
△S
=
-143.5
J·mol-1·K-1
室温下反应能自发进行,但该反应速率极慢,需要使用催化剂来加速反应。
2.在讨论过程的方向时,指的是没有外界干扰时体系的性质。如果允许外界对体系施加某种作用,就可能出现相反的结果。
(1)由能量判据知:放热过程常常是容易进行的。
(2)由熵判据知:若干熵增的过程是自发的。
(3)由能量判据(以焓变为基础)和熵判据组合成的复合
判据(吉布斯自由能变△G)将更适合于所有的过程
(4)同时反应能否自发还与温度有关。
要正确判断一个化学反应能否自发进行,必须综合考虑反应的焓变△H和熵变△S
1、下列说法正确的是∶(
)
A、凡是放热反应都是自发的,由于吸热反应都是非自发的;
B、自发反应一定是熵增大,非自发反应一定是熵减少或不变;
C、自发反应在恰当条件下才能实现;
D、自发反应在任何条件下都能实现。
C
D
2、自发进行的反应一定是∶(
)
A、吸热反应;
B、放热反应;
C、熵增加反应;D、熵增加或者放热反应;
【课堂达标测试】
3、下列说法不正确的是(
)
A.放热反应一定是自发进行的反应;
B.吸热反应一定是非自发进行的;
C.自发进行的反应一定容易发生;
D.有些吸热反应也能自发进行。
C
4.250C和1.01×105Pa时,反应2N2O5(g)=4NO2(g)+
O2(g)
△H=+56.76kJ/mol,自发进行的原因是(
)
A.是吸热反应;
B.是放热反应;
C.是熵减少的反应;
D.熵增大效应大于能量效应。
D
第四节
化学反应进行的方向
自然界中水总是从高处往低处流;
正电荷是从电势高的地方向电势低的地方流动;
室温下冰块自动融化;
墨水扩散;
食盐溶解于水;
火柴棒散落等。
自发反应:在一定条件下不需外界帮助就能自动进行的反应。
自发过程:在一定条件下,不借助外部力量就能自动进行的过程。
如何判断一个过程、一个反应能否自发进行?
下列反应在一定条件下都能自发进行,你知道这些自发进行反应的共同特点吗?
C3H8(g)
+
5O2(g)
=
3CO2(g)
+
4H2O(l)
△H
=
-2217.5
kJ·mol-1
2Na(s)
+
Cl2(g)
=
2NaCl(s)
△H
=
-822
kJ·mol-1
4Fe(s)
+
3O2(g)
=
Fe2O3(s)
△H
=
-1648.4
kJ·mol-1
从能量角度分析它们为什么可以自发?
共同特点:△H
<
O
即放热反应
放热反应使体系能量降低,能量越低越稳定,△H
<
O
有利于反应自发进行
能量判据(焓判据)∶自发过程体系趋向于从高能状态转变为低能状态(这时体系会对外做功或者释放热量即△H
﹤0)。
思
与
题
问
考
化学反应进行方向的判据
一、能量判据(焓判据)
思考:是不是所有自发进行的化学反应都是放热的?
结论:△H
<
0有利于反应自发进行,
但自发反应不一定要△H
<
0
2N2O5(g)=4NO2(g)+O2
(g)
△H=+
56.7kJ/mol
(NH4)
2CO3(s)
=
NH4HCO3(s)+NH3(g)
△H=
+74.9kJ/mol
焓变只是反应能否自发进行的一个因素,但不是惟一因素。只根据焓变来判断反应方向是不全面的。
有序
混乱
火柴散落有趋向于最大混乱度的倾向
二、熵判据
1.
熵的含义:
熵是衡量体系混乱度大小的物理量,即熵是用来描述体系的混乱度的,符号用S表示,单位:
J?mol-1?K-1
。体系混乱度越大,熵值越大;体系混乱度越小,熵值越小
1、同一条件下,不同物质的熵值不同
2、同一物质气态时熵值最大,液态较小,固态时最小。
3、产生气体的反应,熵值增大。
4、反应过程中气体物质的量增加的反应,熵值增大。
熵值大小判断
2.
熵判据:
自发过程的体系趋向于由有序转变为无序,导致体系的熵增大,这一经验规律叫做熵增原理,也就是反应方向判断的熵判据
(NH4)2CO3(s)===NH4HCO3(s)+NH3(g)
2N2O5(g)===4NO(g)+O2(g)
体系熵增加
2NH4Cl(s)+Ba(OH)2(s)=BaCl2(s)+2NH3(g)+2H2O(l)
自发反应:
冰(有序)
水蒸气(无序)
自发过程,体系熵增加
反应的熵变与反应方向的关系:
1.多数熵增的反应在常温下自发进行(△S
>0)
2.有些熵增的反应在常温下不能进行,但在高温下则能自发进行.(△S
>0)
3.有些熵减的反应在一定条件下也能自发进行。
(△S
<0)
3.
熵
变:△S
=
S(生成物)-S(反应物)
2H2(g)+O2(g)=2H2O(l)
结论:△S
>
0
有利于反应自发进行
,自发反应不一定要△S
>
O
熵变是反应能否自发进行的又一个因素,但不是惟一因素。
△
G=△H—T
△S
三、复合判据(自由能变化)
当△
G<0时,反应自发进行
当△
G>0时,反应不自发进行
当△
G=0时,平衡状态
一个化学反应能否自发进行,既与反应焓变有关,又与反应熵变有关,恒温、恒压下,反应方向的判据是体系自由能变化(△
G)。
△H
△S
CaCO3(s)=
CaO(s)+
CO2(g)
△H
=
+
178.2
KJ·mol-1
△S
=
+169.6
J·mol-1·K-1
室温下反应不能自发进行;但在高温的条件下,则△H
-
T△S
<
0反应自发进行。
2NO(g)+
2CO(g)=
N2(g)
+
2CO2(g)
△H
=
-
113.0
KJ·mol-1
△S
=
-143.5
J·mol-1·K-1
室温下反应能自发进行,但该反应速率极慢,需要使用催化剂来加速反应。
2.在讨论过程的方向时,指的是没有外界干扰时体系的性质。如果允许外界对体系施加某种作用,就可能出现相反的结果。
(1)由能量判据知:放热过程常常是容易进行的。
(2)由熵判据知:若干熵增的过程是自发的。
(3)由能量判据(以焓变为基础)和熵判据组合成的复合
判据(吉布斯自由能变△G)将更适合于所有的过程
(4)同时反应能否自发还与温度有关。
要正确判断一个化学反应能否自发进行,必须综合考虑反应的焓变△H和熵变△S
1、下列说法正确的是∶(
)
A、凡是放热反应都是自发的,由于吸热反应都是非自发的;
B、自发反应一定是熵增大,非自发反应一定是熵减少或不变;
C、自发反应在恰当条件下才能实现;
D、自发反应在任何条件下都能实现。
C
D
2、自发进行的反应一定是∶(
)
A、吸热反应;
B、放热反应;
C、熵增加反应;D、熵增加或者放热反应;
【课堂达标测试】
3、下列说法不正确的是(
)
A.放热反应一定是自发进行的反应;
B.吸热反应一定是非自发进行的;
C.自发进行的反应一定容易发生;
D.有些吸热反应也能自发进行。
C
4.250C和1.01×105Pa时,反应2N2O5(g)=4NO2(g)+
O2(g)
△H=+56.76kJ/mol,自发进行的原因是(
)
A.是吸热反应;
B.是放热反应;
C.是熵减少的反应;
D.熵增大效应大于能量效应。
D
