高中化学必修2第2章第2节第1课时《化学反应中能量变化的本质及转化形式》33张ppt
文档属性
| 名称 | 高中化学必修2第2章第2节第1课时《化学反应中能量变化的本质及转化形式》33张ppt |

|
|
| 格式 | zip | ||
| 文件大小 | 3.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-05-27 00:00:00 | ||
图片预览










文档简介
(共33张PPT)
鲁科版必修第二册
第1课时
化学反应中能量变化的本质及转化形式
第2节
化学反应与能量变化
1.如何区分化学变化和物理变化?化学反应的实质是什么?
2.前面我们学过了哪些类型的化学反应?这些反应都有什么特征?
3.现实生活中我们是如何利用化学反应的?
回顾思考
是否有新物质生成
四种基本反应类型
氧化还原反应
离子反应
燃烧反应
化合价变化
离子参加
发光发热
旧键的断裂和新键的形成
物质种类变化
制备新物质
提供热能、光能等
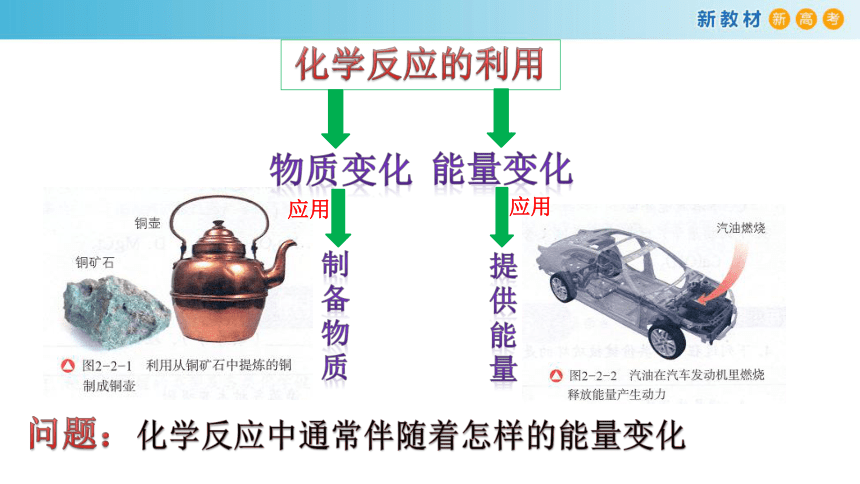
化学反应的利用
物质变化
能量变化
应用
应用
制
备
物
质
提
供
能
量
问题:
化学反应中通常伴随着怎样的能量变化
联想质疑
1.
化学反应中能量变化的本质是什么?
2.
木炭在空气中燃烧时,化学能会转化成哪些形式的能量?
3.
电解水的过程中,电能转化成化学能。那么,化学能可以转化成电能吗?
化学能
化学能是指储存在物质当中的能量。不同的物质不仅组成不同、结构不同,所包含的化学能也不同。
化学能
热能、光能
化学能
电能
在以下两个你熟悉的化学反应中,除了物质的变化外是否还有能量的变化?如果有,是什么样的能量变化?
活动·探究
结合课本P47页,利用所给用品小组合作设计实验方案并进行实验,感受化学反应中的能量变化。
实验用品
锌粉,铁粉,碳酸氢钠,稀盐酸,柠檬酸,蒸馏水;
试管,烧杯,温度计,胶头滴管,药匙。
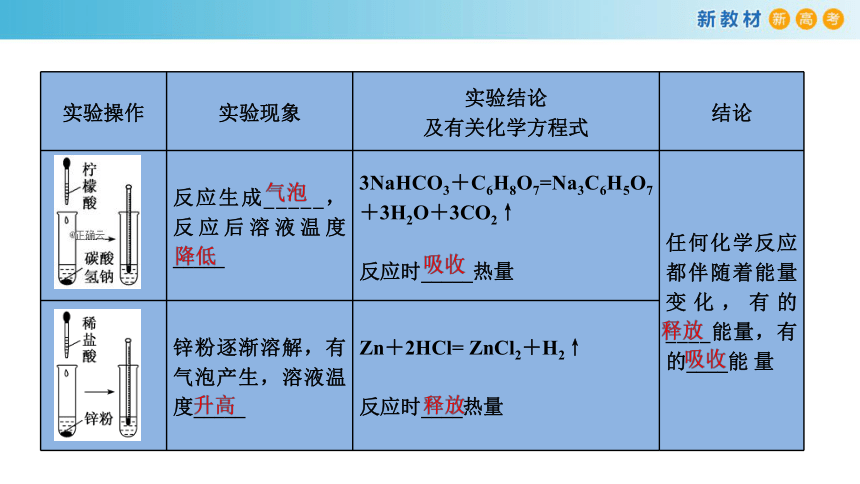
感受化学反应中的能量变化
实验操作
实验现象
实验结论
及有关化学方程式
结论
反应生成_____,反应后溶液温度_____
3NaHCO3+C6H8O7=Na3C6H5O7+3H2O+3CO2↑
反应时_____热量
任何化学反应都伴随着能量变化,有的____能量,有的____能
量
锌粉逐渐溶解,有气泡产生,溶液温度_____
Zn+2HCl=
ZnCl2+H2↑
反应时____热量
一、化学反应的分类(从能量变化的角度)
1、放热反应:最终表现为释放热量的化学反应
2、吸热反应:最终表现为吸收热量的化学反应
(5)
需加热才能发生的反应不一定是吸热反应,如碳和氧气的反应;反应吸热还是放热与反应条件没有直接关系,吸热反应不一定需要加热。如碳酸氢钠与柠檬酸的反应。
迁移应用
《石灰吟》
千锤万凿出深山,烈火焚烧若等闲。
粉骨碎身浑不怕,要留清白在人间。
古诗词中的化学反应
该诗是一首托物言志诗。作者以石灰作比喻,表达自己为国尽忠,不怕牺牲的意愿和坚守高洁的决心。通过古诗的描述,制取石灰的反应是放热反应还是吸热反应?石灰遇水的反应呢?
CaCO3===CaO+CO2↑
高温
CaO+H2O==Ca(OH)2
吸热反应
放热反应
随堂练习
√
×
×
×
C
问题:
化学反应中为什么会有能量的变化?
反应吸热还是放热是由什么决定的呢?
吸热过程
放热反应
放热反应,是食物中的有机物质被空气中的氧气氧化生成一些小分子产物,同时放出热量的过程
二、化学反应中能量变化的本质
1、从化学键的角度分析化学反应中能量变化的本质
(1)实例分析
①断裂1molH2和1/2molO2中的化学键吸收的能量=436KJ+249KJ=685KJ
②形成1
molH20时,成键释放的能量=930KJ
③燃烧1molH2生成生成1
molH20释放能量=930KJ-685KJ=245KJ
释放能量>吸收能量,反应过程释放能量
E1<E2
E1>E2
释放能量
吸收能量
反应物
新键形成释放能量E2
放热反应
吸热反应
旧键断裂吸收能量E1
生成物
化学反应的实质
(2)图示
①若形成新化学键释放的能量(E2)小于破坏旧化学键吸收的能量(E1),则需要吸收能量——吸热反应。
②若形成新化学键释放的能量(E2)大于破坏旧化学键吸收的能量(E1),就会有一定的能量以热能、电能或光能等形式释放出来——放热反应;
问题:
不同的物质不仅组成不同、结构不同,其内部所储存的能量(化学能)也不同,是否可以从物质自身储存的化学能的变化来分析化学反应能量变化的原因呢?
(3)结论
反应物
生成物
能量E(生)
能量E(反)
E(反)
>E(生)
释放能量
E(反)
<
E(生)
吸收能量
热能、光能、电能
热能、光能、电能
2、从物质内部能量的角度分析化学反应中能量变化的本质
(1)图示
一个确定的化学反应发生时是吸收能量还是释放能量,取决于反应物的总能量与生成物的总能量的相对大小。
①如果反应物的总能量(E反)大于生成物的总能量(E生),就会向外界释放能量—放热反应。
②如果反应物的总能量(E反)小于生成物的总能量(E生),就会从外界吸收能量——吸热反应。
(2)结论
化学反应中能量变化的原因
1.从化学键的角度分析
2.从物质内部能量的角度分析
放热反应
吸热反应
放热反应
吸热反应
断裂化学键吸收的能量<形成化学键释放的能量
反应物的总能量>生成物的总能量
断裂化学键吸收的能量>形成化学键释放的能量
反应物的总能量<生成物的总能量
微观角度
宏观角度
归纳总结
化
学
能
热能
电能
热能
光能
电能
光能
铝热反应焊接钢轨
三、化学反应中能量转化的形式
最具发展潜力的清洁能源——氢能
氢能被视为
21
世纪最具发展潜力的清洁能源,世界上许多国家和地区已经广泛开展了氢能研究。
20
世纪
50
年代,科学家利用液氢作为超音速和亚音速飞机的燃料,成功地使氢能飞机上天。
氢氧燃料电池被认为是利用氢能解决未来人类能源危机的途径之一。氢氧燃料电池可将化学能直接转换为电能,能量转换效率通常为
60%
~
80%,而且污染少、噪音小、装置可大可小、使用方便。
重点难点一:放热反应与吸热反应的判断
A
D
重点难点二:反应中能量变化大小的计算方法
反应
反应物断键吸收的总能量E1
生成物成键放出的总能量E2
比较E1E2大小
反应类型
H2+Cl2=2HCl
E1放热反应
H2+Br2=2HBr
E1放热反应
H2+I2=2HI
E1放热反应
D
B
知识框架
化学
反应
实质
特征
能量变化
物质变化
形式
本质
化学键
物质能量
——化学能转化为热能、电能等
能量形式
反应类型
吸热反应
放热反应
(微观角度)
(宏观角度)
——断键吸收能量和成键释放能量的相对大小
——反应物总能量和生成物总能量相对大小
——旧化学键断裂和新化学键形成
鲁科版必修第二册
第1课时
化学反应中能量变化的本质及转化形式
第2节
化学反应与能量变化
1.如何区分化学变化和物理变化?化学反应的实质是什么?
2.前面我们学过了哪些类型的化学反应?这些反应都有什么特征?
3.现实生活中我们是如何利用化学反应的?
回顾思考
是否有新物质生成
四种基本反应类型
氧化还原反应
离子反应
燃烧反应
化合价变化
离子参加
发光发热
旧键的断裂和新键的形成
物质种类变化
制备新物质
提供热能、光能等
化学反应的利用
物质变化
能量变化
应用
应用
制
备
物
质
提
供
能
量
问题:
化学反应中通常伴随着怎样的能量变化
联想质疑
1.
化学反应中能量变化的本质是什么?
2.
木炭在空气中燃烧时,化学能会转化成哪些形式的能量?
3.
电解水的过程中,电能转化成化学能。那么,化学能可以转化成电能吗?
化学能
化学能是指储存在物质当中的能量。不同的物质不仅组成不同、结构不同,所包含的化学能也不同。
化学能
热能、光能
化学能
电能
在以下两个你熟悉的化学反应中,除了物质的变化外是否还有能量的变化?如果有,是什么样的能量变化?
活动·探究
结合课本P47页,利用所给用品小组合作设计实验方案并进行实验,感受化学反应中的能量变化。
实验用品
锌粉,铁粉,碳酸氢钠,稀盐酸,柠檬酸,蒸馏水;
试管,烧杯,温度计,胶头滴管,药匙。
感受化学反应中的能量变化
实验操作
实验现象
实验结论
及有关化学方程式
结论
反应生成_____,反应后溶液温度_____
3NaHCO3+C6H8O7=Na3C6H5O7+3H2O+3CO2↑
反应时_____热量
任何化学反应都伴随着能量变化,有的____能量,有的____能
量
锌粉逐渐溶解,有气泡产生,溶液温度_____
Zn+2HCl=
ZnCl2+H2↑
反应时____热量
一、化学反应的分类(从能量变化的角度)
1、放热反应:最终表现为释放热量的化学反应
2、吸热反应:最终表现为吸收热量的化学反应
(5)
需加热才能发生的反应不一定是吸热反应,如碳和氧气的反应;反应吸热还是放热与反应条件没有直接关系,吸热反应不一定需要加热。如碳酸氢钠与柠檬酸的反应。
迁移应用
《石灰吟》
千锤万凿出深山,烈火焚烧若等闲。
粉骨碎身浑不怕,要留清白在人间。
古诗词中的化学反应
该诗是一首托物言志诗。作者以石灰作比喻,表达自己为国尽忠,不怕牺牲的意愿和坚守高洁的决心。通过古诗的描述,制取石灰的反应是放热反应还是吸热反应?石灰遇水的反应呢?
CaCO3===CaO+CO2↑
高温
CaO+H2O==Ca(OH)2
吸热反应
放热反应
随堂练习
√
×
×
×
C
问题:
化学反应中为什么会有能量的变化?
反应吸热还是放热是由什么决定的呢?
吸热过程
放热反应
放热反应,是食物中的有机物质被空气中的氧气氧化生成一些小分子产物,同时放出热量的过程
二、化学反应中能量变化的本质
1、从化学键的角度分析化学反应中能量变化的本质
(1)实例分析
①断裂1molH2和1/2molO2中的化学键吸收的能量=436KJ+249KJ=685KJ
②形成1
molH20时,成键释放的能量=930KJ
③燃烧1molH2生成生成1
molH20释放能量=930KJ-685KJ=245KJ
释放能量>吸收能量,反应过程释放能量
E1<E2
E1>E2
释放能量
吸收能量
反应物
新键形成释放能量E2
放热反应
吸热反应
旧键断裂吸收能量E1
生成物
化学反应的实质
(2)图示
①若形成新化学键释放的能量(E2)小于破坏旧化学键吸收的能量(E1),则需要吸收能量——吸热反应。
②若形成新化学键释放的能量(E2)大于破坏旧化学键吸收的能量(E1),就会有一定的能量以热能、电能或光能等形式释放出来——放热反应;
问题:
不同的物质不仅组成不同、结构不同,其内部所储存的能量(化学能)也不同,是否可以从物质自身储存的化学能的变化来分析化学反应能量变化的原因呢?
(3)结论
反应物
生成物
能量E(生)
能量E(反)
E(反)
>E(生)
释放能量
E(反)
<
E(生)
吸收能量
热能、光能、电能
热能、光能、电能
2、从物质内部能量的角度分析化学反应中能量变化的本质
(1)图示
一个确定的化学反应发生时是吸收能量还是释放能量,取决于反应物的总能量与生成物的总能量的相对大小。
①如果反应物的总能量(E反)大于生成物的总能量(E生),就会向外界释放能量—放热反应。
②如果反应物的总能量(E反)小于生成物的总能量(E生),就会从外界吸收能量——吸热反应。
(2)结论
化学反应中能量变化的原因
1.从化学键的角度分析
2.从物质内部能量的角度分析
放热反应
吸热反应
放热反应
吸热反应
断裂化学键吸收的能量<形成化学键释放的能量
反应物的总能量>生成物的总能量
断裂化学键吸收的能量>形成化学键释放的能量
反应物的总能量<生成物的总能量
微观角度
宏观角度
归纳总结
化
学
能
热能
电能
热能
光能
电能
光能
铝热反应焊接钢轨
三、化学反应中能量转化的形式
最具发展潜力的清洁能源——氢能
氢能被视为
21
世纪最具发展潜力的清洁能源,世界上许多国家和地区已经广泛开展了氢能研究。
20
世纪
50
年代,科学家利用液氢作为超音速和亚音速飞机的燃料,成功地使氢能飞机上天。
氢氧燃料电池被认为是利用氢能解决未来人类能源危机的途径之一。氢氧燃料电池可将化学能直接转换为电能,能量转换效率通常为
60%
~
80%,而且污染少、噪音小、装置可大可小、使用方便。
重点难点一:放热反应与吸热反应的判断
A
D
重点难点二:反应中能量变化大小的计算方法
反应
反应物断键吸收的总能量E1
生成物成键放出的总能量E2
比较E1E2大小
反应类型
H2+Cl2=2HCl
E1
H2+Br2=2HBr
E1
H2+I2=2HI
E1
D
B
知识框架
化学
反应
实质
特征
能量变化
物质变化
形式
本质
化学键
物质能量
——化学能转化为热能、电能等
能量形式
反应类型
吸热反应
放热反应
(微观角度)
(宏观角度)
——断键吸收能量和成键释放能量的相对大小
——反应物总能量和生成物总能量相对大小
——旧化学键断裂和新化学键形成
