科粤版九年级下册化学《8.3酸和碱的反应》课件 (共20张PPT)
文档属性
| 名称 | 科粤版九年级下册化学《8.3酸和碱的反应》课件 (共20张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 814.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-05-28 14:48:55 | ||
图片预览








文档简介
(共20张PPT)
专题探究
氢氧化钠溶液与稀盐酸
反应的探究
温故而知新
酸有很多共同的化学性质
(1)如都能使紫色石蕊溶液显红色,是酚酞溶液显无色
(2)都可与活泼金属单质反应,且都生成盐和氢气。
(3)都可与某些金属氧化物反应,且都生成盐和水。
酸具有共同化学性质的原因是什么?
HCl
=
H+
+
Cl-
H2SO4
=
2H+
+
SO42-
答:酸在水中都可解离出相同的H+。
碱有很多共同的化学性质
(1)都能使紫色石蕊溶液显蓝色,是酚酞溶液显红色
(2)都可与某些非金属氧化物反应,且都生成盐和水。
2NaOH
+
CO2
=
Na2CO3
+
H2O
Ca(OH)2
+
CO2
=
CaCO3
↓+
H2O
NaOH
=
Na+
+
OH-
Ca(OH)2
=
Ca2+
+
2OH-
答:
碱在水中都可解离出相同的OH-。
碱具有共同化学性质的原因是什么?
探究:
氢氧化钠溶液与稀盐酸是否会发生化学反应?
做出猜想!
猜想1、氢氧化钠与稀盐酸没有发生化学反应
猜想2、氢氧化钠与稀盐酸发生了化学反应
如何证明你的猜想?
妙招一:
步骤:向氢氧化钠溶液中添加稀盐酸溶液,搅拌,观察现象。
现象:无明显现象
分析:有些化学反应本来就没有明显现象,如氢氧化钠溶液与二氧化碳可反应生成碳酸钠和水,但该实验也吴明显现象!
结论:此方案不可行!
如何证明你的猜想?
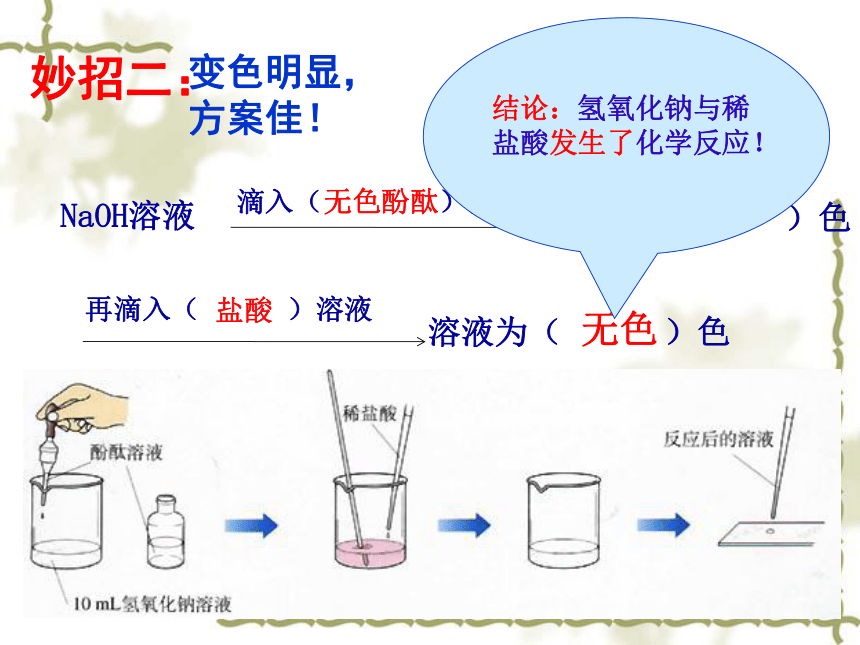
妙招二:
步骤:向氢氧化钠溶液滴加酚酞溶液,再逐滴加入稀盐酸溶液,振荡,观察现象。
妙招二:
无色酚酞
红
盐酸
无色
结论:氢氧化钠与稀盐酸发生了化学反应!
变色明显,方案佳!
氢氧化钠与盐酸反应示意图
HCl→H+
+
Cl-
NaOH→
OH-+
Na+
HCl和NaOH在水中电离出离子
H2O
NaCl
反应的实质:H+
+
OH
-
=
H2O
答:防止稀盐酸滴加过量。
答:起指示作用。因为NaOH与HCl反应无明显的现象发生,根据酚酞溶液由红色变为无色来判断NaOH和HCl是否反应完全。
2.
为什么在操作中必须逐滴滴入稀盐酸?
1.
酚酞在实验中起什么作用?
注意:
滴加盐酸至红色恰好变成无色时即止。否则盐酸过量。
讨论:
妙招三:
向稀盐酸中滴加无色酚酞溶液,再逐滴加入氢氧化钠溶液。
实验现象:滴加无色酚酞溶液后溶液显无色,后溶液由无色变为浅红色时。
此方案可行,
但反应现象不易观察!
步骤:
向稀盐酸溶液中滴加紫色石蕊溶液,再逐滴加入氢氧化钠溶液。
现象:溶液由蓝色变为紫色。
妙招四:
蓝色和紫色颜色接近,不易观察。
妙招五:
向稀盐酸中滴加紫色石蕊溶液,再逐滴加入氢氧化钠溶液。
推测现象:滴加紫色溶液后溶液显红色,后溶液由红色变为紫色时。
此方案实验现象明显!此方案可行
若只需证明氢氧化钠溶液与稀盐酸反生反应,先加酸溶液或先加碱溶液,或选择不同的指示剂原理上都可行。但先加碱溶液,并用酚酞做指示剂,再逐滴加入稀盐酸的方案中变色现象最易观察!所以选用指示剂前提下,碱溶液+酚酞试剂+酸溶液为最佳方案!(“碱太酸”)
总结
小马虎在做“盐酸与氢氧化钠”实验,滴加稀盐酸前忘了加入指示剂,导致无法判断中和反应进行的程度,于是他对所得溶液的酸碱性进行了探究。
打破砂锅问到底
大胆猜想!
猜想1、氯化钠
猜想2、氯化钠和氢氧化钠
猜想3、氯化钠和氯化氢
再探究竟
取少量上述无色溶液,向其中加入紫色石蕊溶液,若溶液显紫色;猜想1成立,若溶液为蓝色,猜想2成立;若溶液显红色,猜想3成立。
化学是一门以实验为基础的科学。在做实验与探究题时,同学们要善于发现和分析问题,并逐步提高收集、处理和使用信息的能力;形成科学态度,学会科学方法;从而提高解决实践问题的能力。
课堂小结
课后作业
中考新评价第十单元
酸和碱习题
专题探究
氢氧化钠溶液与稀盐酸
反应的探究
温故而知新
酸有很多共同的化学性质
(1)如都能使紫色石蕊溶液显红色,是酚酞溶液显无色
(2)都可与活泼金属单质反应,且都生成盐和氢气。
(3)都可与某些金属氧化物反应,且都生成盐和水。
酸具有共同化学性质的原因是什么?
HCl
=
H+
+
Cl-
H2SO4
=
2H+
+
SO42-
答:酸在水中都可解离出相同的H+。
碱有很多共同的化学性质
(1)都能使紫色石蕊溶液显蓝色,是酚酞溶液显红色
(2)都可与某些非金属氧化物反应,且都生成盐和水。
2NaOH
+
CO2
=
Na2CO3
+
H2O
Ca(OH)2
+
CO2
=
CaCO3
↓+
H2O
NaOH
=
Na+
+
OH-
Ca(OH)2
=
Ca2+
+
2OH-
答:
碱在水中都可解离出相同的OH-。
碱具有共同化学性质的原因是什么?
探究:
氢氧化钠溶液与稀盐酸是否会发生化学反应?
做出猜想!
猜想1、氢氧化钠与稀盐酸没有发生化学反应
猜想2、氢氧化钠与稀盐酸发生了化学反应
如何证明你的猜想?
妙招一:
步骤:向氢氧化钠溶液中添加稀盐酸溶液,搅拌,观察现象。
现象:无明显现象
分析:有些化学反应本来就没有明显现象,如氢氧化钠溶液与二氧化碳可反应生成碳酸钠和水,但该实验也吴明显现象!
结论:此方案不可行!
如何证明你的猜想?
妙招二:
步骤:向氢氧化钠溶液滴加酚酞溶液,再逐滴加入稀盐酸溶液,振荡,观察现象。
妙招二:
无色酚酞
红
盐酸
无色
结论:氢氧化钠与稀盐酸发生了化学反应!
变色明显,方案佳!
氢氧化钠与盐酸反应示意图
HCl→H+
+
Cl-
NaOH→
OH-+
Na+
HCl和NaOH在水中电离出离子
H2O
NaCl
反应的实质:H+
+
OH
-
=
H2O
答:防止稀盐酸滴加过量。
答:起指示作用。因为NaOH与HCl反应无明显的现象发生,根据酚酞溶液由红色变为无色来判断NaOH和HCl是否反应完全。
2.
为什么在操作中必须逐滴滴入稀盐酸?
1.
酚酞在实验中起什么作用?
注意:
滴加盐酸至红色恰好变成无色时即止。否则盐酸过量。
讨论:
妙招三:
向稀盐酸中滴加无色酚酞溶液,再逐滴加入氢氧化钠溶液。
实验现象:滴加无色酚酞溶液后溶液显无色,后溶液由无色变为浅红色时。
此方案可行,
但反应现象不易观察!
步骤:
向稀盐酸溶液中滴加紫色石蕊溶液,再逐滴加入氢氧化钠溶液。
现象:溶液由蓝色变为紫色。
妙招四:
蓝色和紫色颜色接近,不易观察。
妙招五:
向稀盐酸中滴加紫色石蕊溶液,再逐滴加入氢氧化钠溶液。
推测现象:滴加紫色溶液后溶液显红色,后溶液由红色变为紫色时。
此方案实验现象明显!此方案可行
若只需证明氢氧化钠溶液与稀盐酸反生反应,先加酸溶液或先加碱溶液,或选择不同的指示剂原理上都可行。但先加碱溶液,并用酚酞做指示剂,再逐滴加入稀盐酸的方案中变色现象最易观察!所以选用指示剂前提下,碱溶液+酚酞试剂+酸溶液为最佳方案!(“碱太酸”)
总结
小马虎在做“盐酸与氢氧化钠”实验,滴加稀盐酸前忘了加入指示剂,导致无法判断中和反应进行的程度,于是他对所得溶液的酸碱性进行了探究。
打破砂锅问到底
大胆猜想!
猜想1、氯化钠
猜想2、氯化钠和氢氧化钠
猜想3、氯化钠和氯化氢
再探究竟
取少量上述无色溶液,向其中加入紫色石蕊溶液,若溶液显紫色;猜想1成立,若溶液为蓝色,猜想2成立;若溶液显红色,猜想3成立。
化学是一门以实验为基础的科学。在做实验与探究题时,同学们要善于发现和分析问题,并逐步提高收集、处理和使用信息的能力;形成科学态度,学会科学方法;从而提高解决实践问题的能力。
课堂小结
课后作业
中考新评价第十单元
酸和碱习题
