6.1化学反应与能量变化 第1课时 (课件25页)
文档属性
| 名称 | 6.1化学反应与能量变化 第1课时 (课件25页) |  | |
| 格式 | zip | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-05-29 09:10:49 | ||
图片预览







文档简介
(共25张PPT)
第一节
化学反应与能量变化(第1课时)
第六章
化学反应与能量
一、导入新课
现代社会中,人类的一切活动(从衣食住行到文化娱乐,从社会生产到科学研究等)都离不开能量,而许多能量的利用与化学反应中的能量变化密切相关。从煤、石油和天然气等提供的热能,到各种化学电池提供的电能的电能,都是通过化学反应获得的。
二、推进新课
教学环节一:通过实验了解化学反应与能量的关系
【实验6-1】在一支试管中加入2mL
2mol/L盐酸,并用温度计测量其温度。再向试管中放入用砂纸打磨光亮的镁条,观察现象,并测量溶液温度的变化。
实验步骤
眼睛看到的现象
用手触摸的感觉
用温度计测量的数据
在一支试管中加入2~3
mL
6
mol/L的盐酸
——
——
向含有盐酸的试管中插人用砂纸打磨光的铝条
?
?
?
结论
?
铝条逐渐溶解并有气泡产生
用手触摸试管,试管发热
温度计显示温度升高
该反应为放热反应
二、推进新课
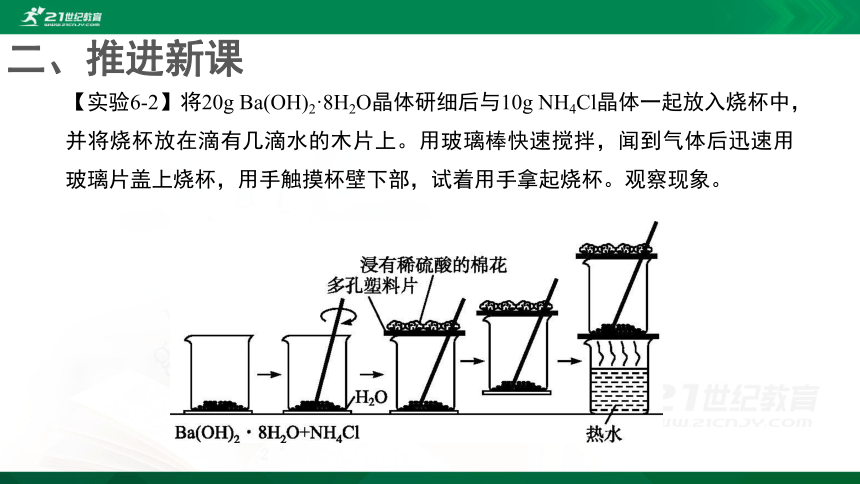
【实验6-2】将20g
Ba(OH)2·8H2O晶体研细后与10g
NH4Cl晶体一起放入烧杯中,并将烧杯放在滴有几滴水的木片上。用玻璃棒快速搅拌,闻到气体后迅速用玻璃片盖上烧杯,用手触摸杯壁下部,试着用手拿起烧杯。观察现象。
二、推进新课
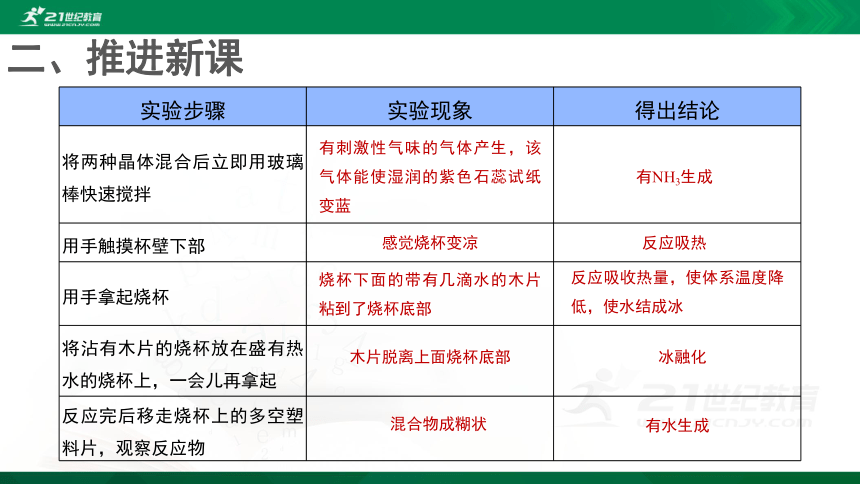
实验步骤
实验现象
得出结论
将两种晶体混合后立即用玻璃棒快速搅拌
用手触摸杯壁下部
用手拿起烧杯
将沾有木片的烧杯放在盛有热水的烧杯上,一会儿再拿起
反应完后移走烧杯上的多空塑料片,观察反应物
有刺激性气味的气体产生,该气体能使湿润的紫色石蕊试纸变蓝
有NH3生成
感觉烧杯变凉
反应吸热
烧杯下面的带有几滴水的木片粘到了烧杯底部
反应吸收热量,使体系温度降低,使水结成冰
木片脱离上面烧杯底部
冰融化
混合物成糊状
有水生成
二、推进新课
1.由实验6-1中温度计的示数变化可知铝与盐酸反应是______反应(填“放热”或“吸热”),反应方程式为_________________________。用砂纸打磨光铝条的目的是______________________。由实验的现象可知该反应为______(填“放热”或“吸热”)反应。
放热
2Al+6HCl=2AlCl3+3H2↑
除去铝条表面的氧化膜
2.实验6-2中能产生有气味的物质,该物质是______(填化学式),反应方程式为_________________________________________________。由实验的现象可知该反应为______(填“放热”或“吸热”)反应。
NH3
吸热
放热
Ba(OH)2·
8H2O
+
2NH4Cl=BaCl2
+2NH3
+10H2O
二、推进新课
化学能与热能的相互转化
化学反应
放热反应:放出热的化学反应
吸热反应:吸收热的化学反应
误区警示:
反应条件和该反应的能量变化之间没有必然联系
1.放热反应往往也需要加热
2.吸热反应也可以自发进行
二、推进新课
一些物质溶于水,也会有吸热和放热现象
1.浓H2SO4、NaOH(s)等溶于水要放热
2.NH4NO3(s)、KNO3(s)、NH4Cl(s)等溶于水要吸热
3.NaCl、酒精等溶于水则热效应不大
二、推进新课
如何判断某反应是放热还是吸热反应
(1)物质的燃烧
C
+
O2
CO2
(2)常见金属(Al、Fe、Zn等)与酸(HCl、H2SO4等)的反应
(3)酸碱中和反应:HCl
+
NaOH
=
NaCl
+
H2O
(4)大多数化合反应:2H2+O2=2H2O
点燃
1.放热反应
二、推进新课
(1)大多数分解反应:CaCO3
CaO
+CO2↑
(2)铵盐与强碱的反应:Ba(OH)2·8H2O+2NH4Cl=BaCl2+2NH3↑+10H2O
(3)碳与CO2气体的反应:C
+
CO2
2CO
(4)氢气还原氧化铜:H2
+
CuO
H2O
+
Cu
2.吸热反应(一般为需要持续加热的反应)
高温
高温
二、推进新课
【实验方法】中和热的测定
1.中和热的定义:在稀溶液中,酸与碱发生中和反应生成1mol
H2O时所释放的热量。
2.测定方法:
(1)所用装置:
(2)所用试剂:
50mL
0.50mol/L盐酸与50mL
0.55mol/L
NaOH溶液在如图所示的装置中进行中和反应。
(3)中和反应放出的热量近似等于水溶液吸收的热量,其计算公式为Q=cm(t-t0),其中c表示水的比热容,数值为4.18
J/(g·℃),m表示水溶液的质量(单位:g)。
二、推进新课
反应物及用量
酸
碱
混合前温度
混合后温度
结论
对实验进行
归纳和概括
HNO3
50
mL
0.5
mol/L
NaOH
50
mL
0.55
mol/L
HCl
50
mL
0.5
mol/L
NaOH
50mL
0.55
mol/L
HCl
50
mL
0.5
mol/L
KOH
50mL
0.55
mol/L
室温t0
室温t0
室温t0
t1
t2
t3
HNO3与NaOH发生中和反应时放热
HCl与NaOH发生中和反应时放热
HCl与KOH发生中和反应时放热
强酸与强碱发生中和反应时放出热量
二、推进新课
中和热的理解:
①中和反应都放出热量;
②稀溶液中,强酸与强碱的中和热为定值:57.3
kJ/mol;
③弱酸或弱碱在中和反应中由于电离吸热,中和热小于57.3
kJ/mol。
实质:H+
+
OH-
=
H2O
二、推进新课
1.生物体内的能量转化
植物通过光合作用将______转化为化学能;而在人体内,淀粉等糖类物质经过一系列变化将_______转化为_____。
2.人类对能源利用的三个阶段
(1)柴草时期:主要能源有树枝杂草、人力、畜力、风和水的动力等。
(2)_________时期:主要能源有煤、石油、天然气。
(3)多能源结构时期:核能、太阳能、氢能等。
光能
化学能
热能
化石能源
三、课堂练习
【例1】(广东广州检测)下列说法不正确的是(
)
A.化学反应除了生成新物质外,还伴随着能量的变化
B.1
mol
硫酸与足量氢氧化钠发生中和反应生成水所释放的热量称为中和热
C.氢气燃烧放出大量的热,说明参加反应的氢气和氧气总能量比生成物水的总能量高
D.放热反应有时也需要加热才可发生
三、课堂练习
解析:中和热是指强酸与强碱的稀溶液发生中和反应生成1
mol
H2O
时所释放的热量,1
mol
硫酸与足量的氢氧化钠反应生成水的物质的量为2
mol,B
错;放热反应有时需要加热,如大多数燃烧反应,通常情况下需要点燃或者加热才能发生,D
正确。
答案:B
三、课堂练习
1.反应
C(石墨)
C(金刚石)是吸收能量的反应,由此可知(
)。
A
A.石墨比金刚石稳定
B.金刚石和石墨可以相互转化
C.石墨转化为金刚石是物理变化
D.金刚石和石墨不能相互转化
解析:由已知石墨转化为金刚石需要吸收能量,说明金刚石的总能量比石墨高,能量越低越稳定,说明石墨比金刚石稳定;由题意可知,石墨在一定条件下可转化为金刚石,但不能知道金刚石是否可转化为石墨,B、D
错。
三、课堂练习
BC
A.化学反应中既有物质变化又有能量变化
B.化学键的断裂和形成与反应放热和吸热无关
C.反应物的总能量与生成物的总能量一定相等
D.H2SO4
与
NaOH
的反应是放热反应
2.(双选)下列关于化学反应与能量变化的说法不正确的是(
)
解析:化学键的断裂和形成是反应放热和吸热的根本原因,B
错;一个化学反应,可能涉及化学能、热能、光能等能量之间的转化,故反应物与生成物之间的总能量不一定相等,但反应体系的总能量一定相等,C
错。
三、课堂练习
3
.下列反应属于吸热反应的是(
)
C
A.Ba(OH)2
与
HCl
的中和反应
B.葡萄糖在人体内氧化分解
C.Ba(OH)2·8H2O
与
NH4Cl
反应
D.锌粒与稀
H2SO4
反应制取
H2
三、课堂练习
4.下列反应中,既属于氧化还原反应同时又是吸热反应的是(
)
C
A.Ba(OH)2·8H2O
与
NH4Cl
反应
B.铝与稀盐酸反应
C.灼热的炭与
CO2
反应
D.甲烷与
O2
的燃烧反应
解析:A
项虽然也是吸热反应,但不是氧化还原反应。
三、课堂练习
5.下列说法正确的是(
)
A.若氢气和氧气化合是放热反应,则水电解生成氢气和氧气是吸热反应
B.需要加热才能进行的反应是吸热反应
C.反应放出热量的多少与反应物的质量和状态无关
D.对放热反应
A+B→C+D
,A、B
的能量总和大于
C、D
的能量总和
AD
解析:大多数燃烧反应都需要加热或点燃才能进行,但都是放热反应,B
错;反应物的状态不同,其自身具有的能量也不同,且相同状态,质量不同,总能量也不相同。
四、课堂小结
第二章
化学反应与能量
第1节
化学反应与能量变化
第1课时
化学键与热能的相互转化
一、化学反应与能量的相互转化
2Al
+
6HCI
=
2AlCl3
+
3H2↑
反应放热
Ba(OH)2·8H2O
+
2NH4Cl
=
BaCl2
+
2NH3↑+
10H2O
反应吸热
二、中和热的测定
H+
+
OH-
=
H2O
反应放热
化学反应
放热反应:放出热的化学反应
吸热反应:吸收热的化学反应
再
见
谢谢
21世纪教育网(www.21cnjy.com)
中小学教育资源网站
有大把高质量资料?一线教师?一线教研员?
欢迎加入21世纪教育网教师合作团队!!月薪过万不是梦!!
详情请看:
https://www.21cnjy.com/help/help_extract.php
第一节
化学反应与能量变化(第1课时)
第六章
化学反应与能量
一、导入新课
现代社会中,人类的一切活动(从衣食住行到文化娱乐,从社会生产到科学研究等)都离不开能量,而许多能量的利用与化学反应中的能量变化密切相关。从煤、石油和天然气等提供的热能,到各种化学电池提供的电能的电能,都是通过化学反应获得的。
二、推进新课
教学环节一:通过实验了解化学反应与能量的关系
【实验6-1】在一支试管中加入2mL
2mol/L盐酸,并用温度计测量其温度。再向试管中放入用砂纸打磨光亮的镁条,观察现象,并测量溶液温度的变化。
实验步骤
眼睛看到的现象
用手触摸的感觉
用温度计测量的数据
在一支试管中加入2~3
mL
6
mol/L的盐酸
——
——
向含有盐酸的试管中插人用砂纸打磨光的铝条
?
?
?
结论
?
铝条逐渐溶解并有气泡产生
用手触摸试管,试管发热
温度计显示温度升高
该反应为放热反应
二、推进新课
【实验6-2】将20g
Ba(OH)2·8H2O晶体研细后与10g
NH4Cl晶体一起放入烧杯中,并将烧杯放在滴有几滴水的木片上。用玻璃棒快速搅拌,闻到气体后迅速用玻璃片盖上烧杯,用手触摸杯壁下部,试着用手拿起烧杯。观察现象。
二、推进新课
实验步骤
实验现象
得出结论
将两种晶体混合后立即用玻璃棒快速搅拌
用手触摸杯壁下部
用手拿起烧杯
将沾有木片的烧杯放在盛有热水的烧杯上,一会儿再拿起
反应完后移走烧杯上的多空塑料片,观察反应物
有刺激性气味的气体产生,该气体能使湿润的紫色石蕊试纸变蓝
有NH3生成
感觉烧杯变凉
反应吸热
烧杯下面的带有几滴水的木片粘到了烧杯底部
反应吸收热量,使体系温度降低,使水结成冰
木片脱离上面烧杯底部
冰融化
混合物成糊状
有水生成
二、推进新课
1.由实验6-1中温度计的示数变化可知铝与盐酸反应是______反应(填“放热”或“吸热”),反应方程式为_________________________。用砂纸打磨光铝条的目的是______________________。由实验的现象可知该反应为______(填“放热”或“吸热”)反应。
放热
2Al+6HCl=2AlCl3+3H2↑
除去铝条表面的氧化膜
2.实验6-2中能产生有气味的物质,该物质是______(填化学式),反应方程式为_________________________________________________。由实验的现象可知该反应为______(填“放热”或“吸热”)反应。
NH3
吸热
放热
Ba(OH)2·
8H2O
+
2NH4Cl=BaCl2
+2NH3
+10H2O
二、推进新课
化学能与热能的相互转化
化学反应
放热反应:放出热的化学反应
吸热反应:吸收热的化学反应
误区警示:
反应条件和该反应的能量变化之间没有必然联系
1.放热反应往往也需要加热
2.吸热反应也可以自发进行
二、推进新课
一些物质溶于水,也会有吸热和放热现象
1.浓H2SO4、NaOH(s)等溶于水要放热
2.NH4NO3(s)、KNO3(s)、NH4Cl(s)等溶于水要吸热
3.NaCl、酒精等溶于水则热效应不大
二、推进新课
如何判断某反应是放热还是吸热反应
(1)物质的燃烧
C
+
O2
CO2
(2)常见金属(Al、Fe、Zn等)与酸(HCl、H2SO4等)的反应
(3)酸碱中和反应:HCl
+
NaOH
=
NaCl
+
H2O
(4)大多数化合反应:2H2+O2=2H2O
点燃
1.放热反应
二、推进新课
(1)大多数分解反应:CaCO3
CaO
+CO2↑
(2)铵盐与强碱的反应:Ba(OH)2·8H2O+2NH4Cl=BaCl2+2NH3↑+10H2O
(3)碳与CO2气体的反应:C
+
CO2
2CO
(4)氢气还原氧化铜:H2
+
CuO
H2O
+
Cu
2.吸热反应(一般为需要持续加热的反应)
高温
高温
二、推进新课
【实验方法】中和热的测定
1.中和热的定义:在稀溶液中,酸与碱发生中和反应生成1mol
H2O时所释放的热量。
2.测定方法:
(1)所用装置:
(2)所用试剂:
50mL
0.50mol/L盐酸与50mL
0.55mol/L
NaOH溶液在如图所示的装置中进行中和反应。
(3)中和反应放出的热量近似等于水溶液吸收的热量,其计算公式为Q=cm(t-t0),其中c表示水的比热容,数值为4.18
J/(g·℃),m表示水溶液的质量(单位:g)。
二、推进新课
反应物及用量
酸
碱
混合前温度
混合后温度
结论
对实验进行
归纳和概括
HNO3
50
mL
0.5
mol/L
NaOH
50
mL
0.55
mol/L
HCl
50
mL
0.5
mol/L
NaOH
50mL
0.55
mol/L
HCl
50
mL
0.5
mol/L
KOH
50mL
0.55
mol/L
室温t0
室温t0
室温t0
t1
t2
t3
HNO3与NaOH发生中和反应时放热
HCl与NaOH发生中和反应时放热
HCl与KOH发生中和反应时放热
强酸与强碱发生中和反应时放出热量
二、推进新课
中和热的理解:
①中和反应都放出热量;
②稀溶液中,强酸与强碱的中和热为定值:57.3
kJ/mol;
③弱酸或弱碱在中和反应中由于电离吸热,中和热小于57.3
kJ/mol。
实质:H+
+
OH-
=
H2O
二、推进新课
1.生物体内的能量转化
植物通过光合作用将______转化为化学能;而在人体内,淀粉等糖类物质经过一系列变化将_______转化为_____。
2.人类对能源利用的三个阶段
(1)柴草时期:主要能源有树枝杂草、人力、畜力、风和水的动力等。
(2)_________时期:主要能源有煤、石油、天然气。
(3)多能源结构时期:核能、太阳能、氢能等。
光能
化学能
热能
化石能源
三、课堂练习
【例1】(广东广州检测)下列说法不正确的是(
)
A.化学反应除了生成新物质外,还伴随着能量的变化
B.1
mol
硫酸与足量氢氧化钠发生中和反应生成水所释放的热量称为中和热
C.氢气燃烧放出大量的热,说明参加反应的氢气和氧气总能量比生成物水的总能量高
D.放热反应有时也需要加热才可发生
三、课堂练习
解析:中和热是指强酸与强碱的稀溶液发生中和反应生成1
mol
H2O
时所释放的热量,1
mol
硫酸与足量的氢氧化钠反应生成水的物质的量为2
mol,B
错;放热反应有时需要加热,如大多数燃烧反应,通常情况下需要点燃或者加热才能发生,D
正确。
答案:B
三、课堂练习
1.反应
C(石墨)
C(金刚石)是吸收能量的反应,由此可知(
)。
A
A.石墨比金刚石稳定
B.金刚石和石墨可以相互转化
C.石墨转化为金刚石是物理变化
D.金刚石和石墨不能相互转化
解析:由已知石墨转化为金刚石需要吸收能量,说明金刚石的总能量比石墨高,能量越低越稳定,说明石墨比金刚石稳定;由题意可知,石墨在一定条件下可转化为金刚石,但不能知道金刚石是否可转化为石墨,B、D
错。
三、课堂练习
BC
A.化学反应中既有物质变化又有能量变化
B.化学键的断裂和形成与反应放热和吸热无关
C.反应物的总能量与生成物的总能量一定相等
D.H2SO4
与
NaOH
的反应是放热反应
2.(双选)下列关于化学反应与能量变化的说法不正确的是(
)
解析:化学键的断裂和形成是反应放热和吸热的根本原因,B
错;一个化学反应,可能涉及化学能、热能、光能等能量之间的转化,故反应物与生成物之间的总能量不一定相等,但反应体系的总能量一定相等,C
错。
三、课堂练习
3
.下列反应属于吸热反应的是(
)
C
A.Ba(OH)2
与
HCl
的中和反应
B.葡萄糖在人体内氧化分解
C.Ba(OH)2·8H2O
与
NH4Cl
反应
D.锌粒与稀
H2SO4
反应制取
H2
三、课堂练习
4.下列反应中,既属于氧化还原反应同时又是吸热反应的是(
)
C
A.Ba(OH)2·8H2O
与
NH4Cl
反应
B.铝与稀盐酸反应
C.灼热的炭与
CO2
反应
D.甲烷与
O2
的燃烧反应
解析:A
项虽然也是吸热反应,但不是氧化还原反应。
三、课堂练习
5.下列说法正确的是(
)
A.若氢气和氧气化合是放热反应,则水电解生成氢气和氧气是吸热反应
B.需要加热才能进行的反应是吸热反应
C.反应放出热量的多少与反应物的质量和状态无关
D.对放热反应
A+B→C+D
,A、B
的能量总和大于
C、D
的能量总和
AD
解析:大多数燃烧反应都需要加热或点燃才能进行,但都是放热反应,B
错;反应物的状态不同,其自身具有的能量也不同,且相同状态,质量不同,总能量也不相同。
四、课堂小结
第二章
化学反应与能量
第1节
化学反应与能量变化
第1课时
化学键与热能的相互转化
一、化学反应与能量的相互转化
2Al
+
6HCI
=
2AlCl3
+
3H2↑
反应放热
Ba(OH)2·8H2O
+
2NH4Cl
=
BaCl2
+
2NH3↑+
10H2O
反应吸热
二、中和热的测定
H+
+
OH-
=
H2O
反应放热
化学反应
放热反应:放出热的化学反应
吸热反应:吸收热的化学反应
再
见
谢谢
21世纪教育网(www.21cnjy.com)
中小学教育资源网站
有大把高质量资料?一线教师?一线教研员?
欢迎加入21世纪教育网教师合作团队!!月薪过万不是梦!!
详情请看:
https://www.21cnjy.com/help/help_extract.php
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
