沪教版(上海)化学九年级第二学期第五单元 初识酸和碱测试题(含答案)
文档属性
| 名称 | 沪教版(上海)化学九年级第二学期第五单元 初识酸和碱测试题(含答案) |

|
|
| 格式 | zip | ||
| 文件大小 | 225.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版(试用本) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-05-29 00:00:00 | ||
图片预览


文档简介
《初识酸和碱》测试题
一、单选题(每小题只有一个正确答案)
1.用浓硫酸配制一定质量分数的稀硫酸,不需要用到的仪器是( )
A.托盘天平
B.烧杯
C.量筒
D.玻璃棒
2.科学的方法是实验成功的前提条件。下列方法或要求存在错误的是( )
A.用胶头滴管吸取液体时,要先挤瘪橡胶头,再将滴管伸入到液体中吸取
B.稀释浓硫酸时,将水慢慢地注入浓硫酸中,并用玻璃棒不断地搅拌
C.实验室进行模拟炼铁时,应先通一段时间的CO气体,然后再加热
D.测定空气中氧气体积含量时,点燃红磷后要迅速将燃烧匙伸入集气瓶并塞紧橡皮塞
3.下列发生在家庭生活中的变化属于物理变化的是
A.牛奶变酸
B.葡萄酿酒
C.食醋除水垢
D.洗洁精除油污
4.以下几种气体,能用如图装置干燥并收集的是(
)
①H2
②O2
③CO2
④SO2
⑤CH4
⑥HCl
A.①②
B.①⑤
C.①③④
D.③④⑥
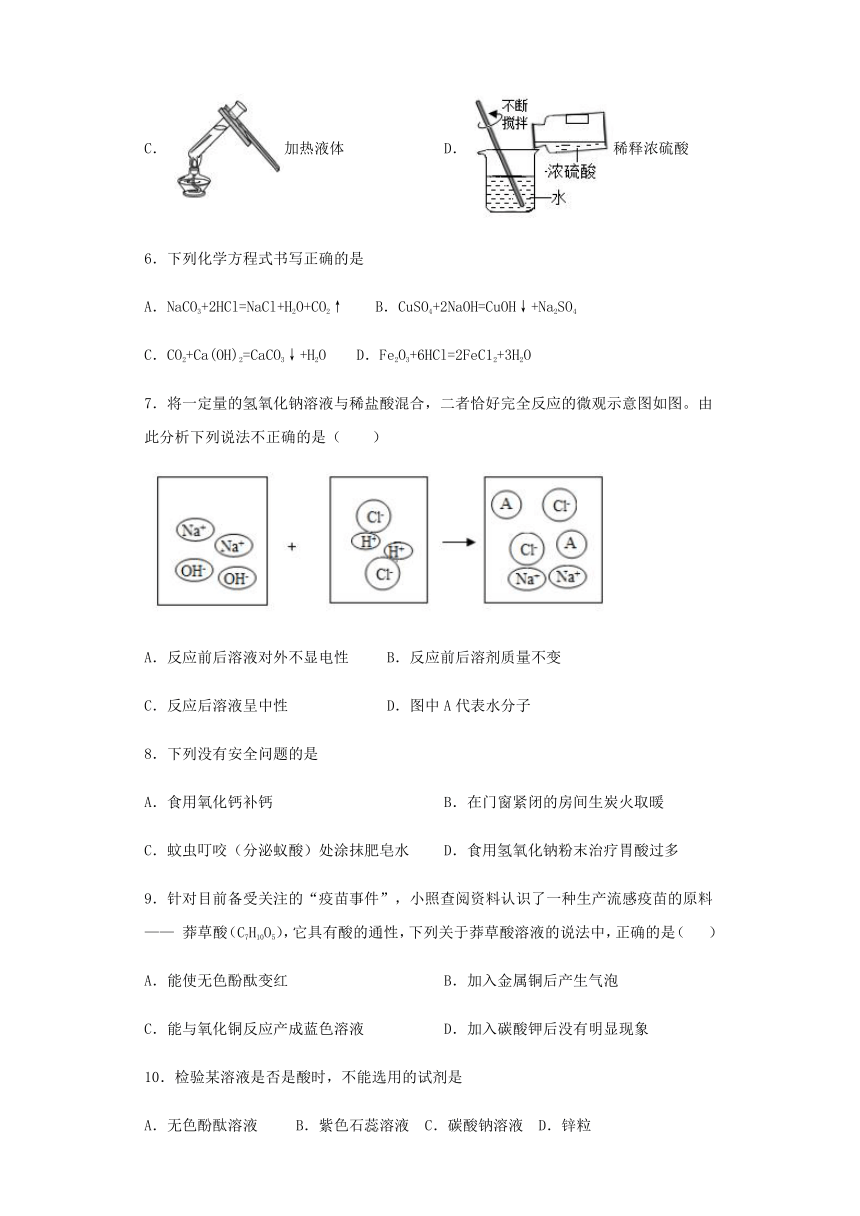
5.下列基本实验操作正确的是
A.
读出液体体积
B.
测溶液的pH
C.
加热液体
D.稀释浓硫酸
6.下列化学方程式书写正确的是
A.NaCO3+2HCl=NaCl+H2O+CO2↑
B.CuSO4+2NaOH=CuOH↓+Na2SO4
C.CO2+Ca(OH)2=CaCO3↓+H2O
D.Fe2O3+6HCl=2FeC12+3H2O
7.将一定量的氢氧化钠溶液与稀盐酸混合,二者恰好完全反应的微观示意图如图。由此分析下列说法不正确的是( )
A.反应前后溶液对外不显电性
B.反应前后溶剂质量不变
C.反应后溶液呈中性
D.图中A代表水分子
8.下列没有安全问题的是
A.食用氧化钙补钙
B.在门窗紧闭的房间生炭火取暖
C.蚊虫叮咬(分泌蚁酸)处涂抹肥皂水
D.食用氢氧化钠粉末治疗胃酸过多
9.针对目前备受关注的“疫苗事件”,小照查阅资料认识了一种生产流感疫苗的原料——
莽草酸(C7H10O5),它具有酸的通性,下列关于莽草酸溶液的说法中,正确的是(
)
A.能使无色酚酞变红
B.加入金属铜后产生气泡
C.能与氧化铜反应产成蓝色溶液
D.加入碳酸钾后没有明显现象
10.检验某溶液是否是酸时,不能选用的试剂是
A.无色酚酞溶液
B.紫色石蕊溶液
C.碳酸钠溶液
D.锌粒
11.家庭生活中要洗涤热水瓶内少量的水垢,实际可行的方法是
A.用稀盐酸洗涤
B.用食盐水洗涤
C.用热纯碱水洗涤
D.用食醋洗涤
12.分类是学习化学的一种重要方法.以下分类正确的是( )
A.常见的酸溶液:H2O、HCl、H2SO4
B.常见的黑色固体:CuO、MnO2、Fe3O4
C.常见的有还原性的物质:C、CO、O2
D.常见的氧化物:CO2?、?KMnO4?、?H2O
13.常温下,往盛放适量M物质的烧杯中逐渐加入N物质并充分搅拌,下图横坐标x表示N物质的质量,纵坐标y表示烧杯中的某物理量(见下表),下列实验与图像对应关系合理的是()
M
N
y
A
水
浓硫酸
溶液的温度
B
水
碳酸钠
溶液的pH
C
饱和氯化钠溶液
氯化钠
溶液的溶质质量分数
D
硫酸铜溶液
铝粉
溶液质量
A.A
B.B
C.C
D.D
14.下列叙述中正确的是( )
A.将氯化氢和二氧化碳分别通入石蕊溶液中,溶液都变为红色,所以它们都是酸类物质
B.中和反应生成盐和水,有盐和水生成的反应一定是中和反应
C.化合物是含有不同种元素的纯净物,所以含有不同种元素的纯净物一定是化合物
D.离子是带电荷的原子或原子团,所以带电荷的粒子一定是离子
15.下列与水有关的说法中,不正确的是( )
A.少量白磷保存在冷水中
B.可用肥皂水区别软水和硬水
C.生活中常用煮沸的方法降低水的硬度
D.稀释浓硫酸时,一定要在浓硫酸中缓缓加入水
二、填空题
16.下面是实验室常用的仪器
请回答下列的问题:
(1)可直接加热的有__________
(填序号)。
(2)滴加少量液体用__________
(填序号)。
(3)过滤时玻璃仪器除了用到⑧外,还需用到漏斗及以上的__________
(填仪器名称)。
(4)用仪器①能否量取8.68ml溶液__________
(填“能”或“否”)。
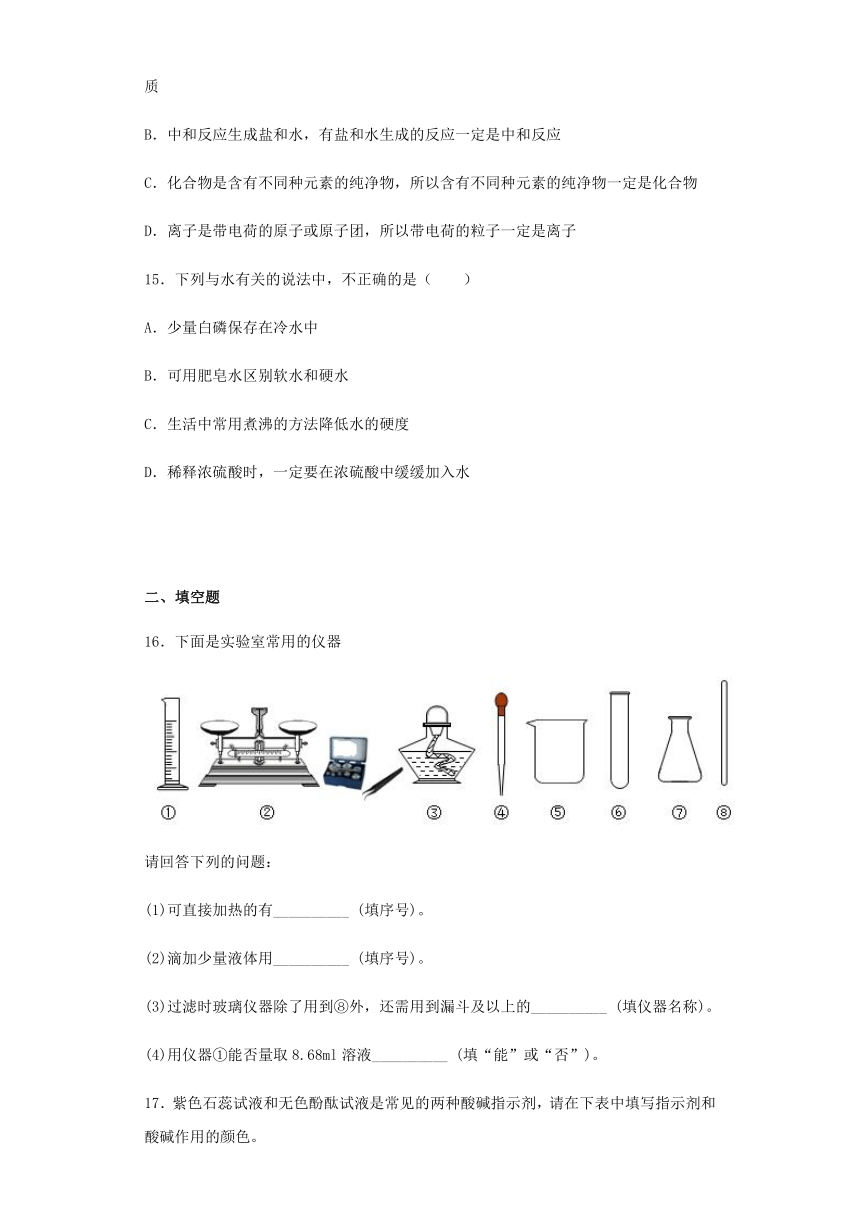
17.紫色石蕊试液和无色酚酞试液是常见的两种酸碱指示剂,请在下表中填写指示剂和酸碱作用的颜色。
紫色石蕊试液
无色酚酞试液
中性溶液
________色
__________色
酸性溶液
________色
__________色
碱性溶液
________色
__________色
18.元旦联欢会上,雯雯拿出一幅画(如图所示),表演了一个化学魔术.
(1)她向画中的衣服上喷了一种无色溶液,衣服由紫色变成红色,若衣服上预先涂过石蕊溶液,则喷的无色溶液可能是__.
(2)她向画中的灯笼上喷了另一种无色溶液,灯笼由白色变成红色,则该无色溶液及灯笼上预先涂过的试剂分别是__.
19.请用化学方程式解释下列现象:
(1)可以服用小苏打治疗胃酸过多_____。
(2)铝制品不易锈蚀_____。
(3)铁桶不能盛放波尔多液_____。
(4)常用稀盐酸除铁锈_____。
(5)石灰浆粉刷墙壁,干燥后墙面变硬_____。
(6)氢气作为最理想的燃料_____。
三、推断题
20.下图中的物质为初中化学所学的物质,其中属于碱的是B、C,属于盐的是D、E;胃中含有F能帮助消化;A是食品包装中常用的干燥剂。图中“——”表示两端的物质问能发生化学反应;“→”表示物质间存在的转化关系;部分反应物或生成物已略去。
(1)写出化学式:B_______________。
(2)写出A和F反应的化学方程式:________________。
(3)写出D→C的化学方程式:____________。
21.如图是中学化学中常见物质的转化关系,A与B常温下反应放出大量热,A常温为液体,F与H组成元素相同,E是红色粉末(反应条件、部分反应物和生成物均已略去)。
(1)A物质的化学式为_______________________;
(2)H的一种用途________________________;
(3)写出E+F→G+H的化学方程式_________________________;
(4)按物质的分类I属于__________________________。
四、实验题
22.下图是化学兴趣小组同学设计和改进的实验装置,请你参与他们的探究活动。回答下列问题:
(1)图1:小镜同学用一根粗铜丝绕成线圈罩在蜡烛的火焰上,火焰很快熄灭。请分析蜡烛火焰熄灭的原因______,此实验说明金属铜具有______性。小易同学在铺有一层纯碱粉末的烧杯中点燃一支蜡烛,然后沿着烧杯壁缓缓倒入稀硫酸,蜡烛火焰熄灭。请分析蜡烛熄灭的原因______。
(2)图2:小含同学在烧杯中加入浓氨水;在烧杯、中都加入蒸馏水,并分别滴加3滴酚酞试液于蒸馏水中,得到无色溶液。用一只大烧杯把、两烧杯罩在一起,几分钟后,溶液颜色变成红色的烧杯是______(填“”“”或“”),请你用分子的知识解释烧杯中溶液变红的原因______。
23.初中化学课上,同学们利用下列实验探究碱的化学性质:
(1)写出仪器①的名称_____;
(2)A实验证明反应发生的现象是_____。
五、计算题
24.将100g氯化钙样品(含有碳酸钙)加入150g盐酸中完全反应,气体全部逸出,得到245.6g溶液。则:
(1)产生的气体质量为________g。
(2)反应后溶液中溶质的质量分数________。
(计算结果保留一位小数)
25.某兴趣小组为测定某赤铁矿中氧化铁的含量,取10
g赤铁矿(主要成分为Fe2O3,假设其中的杂质不溶于水,也不与稀硫酸反应)置于烧杯中,加入足量的稀硫酸,烧杯中剩余固体的质量随反应时间的变化曲线如图所示。
请计算:(1)Fe2O3中铁元素的质量分数为_______
。
(2)反应中消耗H2SO4的质量_________。
参考答案
1.A
2.B
3.D
4.B
5.D
6.C
7.B
8.C
9.C
10.A
11.D
12.B
13.D
14.C
15.D
16.⑥
④
烧杯
否
17.紫
无
红
无
蓝
红
18.(1)HCl(无色的酸性溶液都可以)
(2)NaOH溶液、无色酚酞试液(其他合理答案也可)
19.NaHCO3+HCl=NaCl+H2O+CO2↑
4Al+3O2=2Al2O3
Fe+CuSO4=FeSO4+Cu
Fe2O3+6HCl═2FeCl3+3H2O
Ca(OH)2+CO2═CaCO3↓+H2O
2H2+O22H2O
20.
21.
制冷剂、人工降雨、制饮料、灭火等
盐
22.铜丝具有导热性,能将蜡烛燃烧产生的热量传导出去,使得蜡烛周围的温度低于蜡烛的着火点,致使蜡烛的火焰熄灭(合理即可)
导热
烧杯中的纯碱与稀硫酸反应产生大量的二氧化碳,二氧化碳不燃烧也不支持燃烧,使蜡烛熄灭(合理即可)
浓氨水具有挥发性,氨分子运动到烧杯中,溶于水得到氨水,氨水呈碱性,遇酚酞试液,会使溶液变为红色(合理即可)
23.胶头滴管
溶液由红色恰好变为无色
24.4.4
41.1%
25.70%
14.7g
一、单选题(每小题只有一个正确答案)
1.用浓硫酸配制一定质量分数的稀硫酸,不需要用到的仪器是( )
A.托盘天平
B.烧杯
C.量筒
D.玻璃棒
2.科学的方法是实验成功的前提条件。下列方法或要求存在错误的是( )
A.用胶头滴管吸取液体时,要先挤瘪橡胶头,再将滴管伸入到液体中吸取
B.稀释浓硫酸时,将水慢慢地注入浓硫酸中,并用玻璃棒不断地搅拌
C.实验室进行模拟炼铁时,应先通一段时间的CO气体,然后再加热
D.测定空气中氧气体积含量时,点燃红磷后要迅速将燃烧匙伸入集气瓶并塞紧橡皮塞
3.下列发生在家庭生活中的变化属于物理变化的是
A.牛奶变酸
B.葡萄酿酒
C.食醋除水垢
D.洗洁精除油污
4.以下几种气体,能用如图装置干燥并收集的是(
)
①H2
②O2
③CO2
④SO2
⑤CH4
⑥HCl
A.①②
B.①⑤
C.①③④
D.③④⑥
5.下列基本实验操作正确的是
A.
读出液体体积
B.
测溶液的pH
C.
加热液体
D.稀释浓硫酸
6.下列化学方程式书写正确的是
A.NaCO3+2HCl=NaCl+H2O+CO2↑
B.CuSO4+2NaOH=CuOH↓+Na2SO4
C.CO2+Ca(OH)2=CaCO3↓+H2O
D.Fe2O3+6HCl=2FeC12+3H2O
7.将一定量的氢氧化钠溶液与稀盐酸混合,二者恰好完全反应的微观示意图如图。由此分析下列说法不正确的是( )
A.反应前后溶液对外不显电性
B.反应前后溶剂质量不变
C.反应后溶液呈中性
D.图中A代表水分子
8.下列没有安全问题的是
A.食用氧化钙补钙
B.在门窗紧闭的房间生炭火取暖
C.蚊虫叮咬(分泌蚁酸)处涂抹肥皂水
D.食用氢氧化钠粉末治疗胃酸过多
9.针对目前备受关注的“疫苗事件”,小照查阅资料认识了一种生产流感疫苗的原料——
莽草酸(C7H10O5),它具有酸的通性,下列关于莽草酸溶液的说法中,正确的是(
)
A.能使无色酚酞变红
B.加入金属铜后产生气泡
C.能与氧化铜反应产成蓝色溶液
D.加入碳酸钾后没有明显现象
10.检验某溶液是否是酸时,不能选用的试剂是
A.无色酚酞溶液
B.紫色石蕊溶液
C.碳酸钠溶液
D.锌粒
11.家庭生活中要洗涤热水瓶内少量的水垢,实际可行的方法是
A.用稀盐酸洗涤
B.用食盐水洗涤
C.用热纯碱水洗涤
D.用食醋洗涤
12.分类是学习化学的一种重要方法.以下分类正确的是( )
A.常见的酸溶液:H2O、HCl、H2SO4
B.常见的黑色固体:CuO、MnO2、Fe3O4
C.常见的有还原性的物质:C、CO、O2
D.常见的氧化物:CO2?、?KMnO4?、?H2O
13.常温下,往盛放适量M物质的烧杯中逐渐加入N物质并充分搅拌,下图横坐标x表示N物质的质量,纵坐标y表示烧杯中的某物理量(见下表),下列实验与图像对应关系合理的是()
M
N
y
A
水
浓硫酸
溶液的温度
B
水
碳酸钠
溶液的pH
C
饱和氯化钠溶液
氯化钠
溶液的溶质质量分数
D
硫酸铜溶液
铝粉
溶液质量
A.A
B.B
C.C
D.D
14.下列叙述中正确的是( )
A.将氯化氢和二氧化碳分别通入石蕊溶液中,溶液都变为红色,所以它们都是酸类物质
B.中和反应生成盐和水,有盐和水生成的反应一定是中和反应
C.化合物是含有不同种元素的纯净物,所以含有不同种元素的纯净物一定是化合物
D.离子是带电荷的原子或原子团,所以带电荷的粒子一定是离子
15.下列与水有关的说法中,不正确的是( )
A.少量白磷保存在冷水中
B.可用肥皂水区别软水和硬水
C.生活中常用煮沸的方法降低水的硬度
D.稀释浓硫酸时,一定要在浓硫酸中缓缓加入水
二、填空题
16.下面是实验室常用的仪器
请回答下列的问题:
(1)可直接加热的有__________
(填序号)。
(2)滴加少量液体用__________
(填序号)。
(3)过滤时玻璃仪器除了用到⑧外,还需用到漏斗及以上的__________
(填仪器名称)。
(4)用仪器①能否量取8.68ml溶液__________
(填“能”或“否”)。
17.紫色石蕊试液和无色酚酞试液是常见的两种酸碱指示剂,请在下表中填写指示剂和酸碱作用的颜色。
紫色石蕊试液
无色酚酞试液
中性溶液
________色
__________色
酸性溶液
________色
__________色
碱性溶液
________色
__________色
18.元旦联欢会上,雯雯拿出一幅画(如图所示),表演了一个化学魔术.
(1)她向画中的衣服上喷了一种无色溶液,衣服由紫色变成红色,若衣服上预先涂过石蕊溶液,则喷的无色溶液可能是__.
(2)她向画中的灯笼上喷了另一种无色溶液,灯笼由白色变成红色,则该无色溶液及灯笼上预先涂过的试剂分别是__.
19.请用化学方程式解释下列现象:
(1)可以服用小苏打治疗胃酸过多_____。
(2)铝制品不易锈蚀_____。
(3)铁桶不能盛放波尔多液_____。
(4)常用稀盐酸除铁锈_____。
(5)石灰浆粉刷墙壁,干燥后墙面变硬_____。
(6)氢气作为最理想的燃料_____。
三、推断题
20.下图中的物质为初中化学所学的物质,其中属于碱的是B、C,属于盐的是D、E;胃中含有F能帮助消化;A是食品包装中常用的干燥剂。图中“——”表示两端的物质问能发生化学反应;“→”表示物质间存在的转化关系;部分反应物或生成物已略去。
(1)写出化学式:B_______________。
(2)写出A和F反应的化学方程式:________________。
(3)写出D→C的化学方程式:____________。
21.如图是中学化学中常见物质的转化关系,A与B常温下反应放出大量热,A常温为液体,F与H组成元素相同,E是红色粉末(反应条件、部分反应物和生成物均已略去)。
(1)A物质的化学式为_______________________;
(2)H的一种用途________________________;
(3)写出E+F→G+H的化学方程式_________________________;
(4)按物质的分类I属于__________________________。
四、实验题
22.下图是化学兴趣小组同学设计和改进的实验装置,请你参与他们的探究活动。回答下列问题:
(1)图1:小镜同学用一根粗铜丝绕成线圈罩在蜡烛的火焰上,火焰很快熄灭。请分析蜡烛火焰熄灭的原因______,此实验说明金属铜具有______性。小易同学在铺有一层纯碱粉末的烧杯中点燃一支蜡烛,然后沿着烧杯壁缓缓倒入稀硫酸,蜡烛火焰熄灭。请分析蜡烛熄灭的原因______。
(2)图2:小含同学在烧杯中加入浓氨水;在烧杯、中都加入蒸馏水,并分别滴加3滴酚酞试液于蒸馏水中,得到无色溶液。用一只大烧杯把、两烧杯罩在一起,几分钟后,溶液颜色变成红色的烧杯是______(填“”“”或“”),请你用分子的知识解释烧杯中溶液变红的原因______。
23.初中化学课上,同学们利用下列实验探究碱的化学性质:
(1)写出仪器①的名称_____;
(2)A实验证明反应发生的现象是_____。
五、计算题
24.将100g氯化钙样品(含有碳酸钙)加入150g盐酸中完全反应,气体全部逸出,得到245.6g溶液。则:
(1)产生的气体质量为________g。
(2)反应后溶液中溶质的质量分数________。
(计算结果保留一位小数)
25.某兴趣小组为测定某赤铁矿中氧化铁的含量,取10
g赤铁矿(主要成分为Fe2O3,假设其中的杂质不溶于水,也不与稀硫酸反应)置于烧杯中,加入足量的稀硫酸,烧杯中剩余固体的质量随反应时间的变化曲线如图所示。
请计算:(1)Fe2O3中铁元素的质量分数为_______
。
(2)反应中消耗H2SO4的质量_________。
参考答案
1.A
2.B
3.D
4.B
5.D
6.C
7.B
8.C
9.C
10.A
11.D
12.B
13.D
14.C
15.D
16.⑥
④
烧杯
否
17.紫
无
红
无
蓝
红
18.(1)HCl(无色的酸性溶液都可以)
(2)NaOH溶液、无色酚酞试液(其他合理答案也可)
19.NaHCO3+HCl=NaCl+H2O+CO2↑
4Al+3O2=2Al2O3
Fe+CuSO4=FeSO4+Cu
Fe2O3+6HCl═2FeCl3+3H2O
Ca(OH)2+CO2═CaCO3↓+H2O
2H2+O22H2O
20.
21.
制冷剂、人工降雨、制饮料、灭火等
盐
22.铜丝具有导热性,能将蜡烛燃烧产生的热量传导出去,使得蜡烛周围的温度低于蜡烛的着火点,致使蜡烛的火焰熄灭(合理即可)
导热
烧杯中的纯碱与稀硫酸反应产生大量的二氧化碳,二氧化碳不燃烧也不支持燃烧,使蜡烛熄灭(合理即可)
浓氨水具有挥发性,氨分子运动到烧杯中,溶于水得到氨水,氨水呈碱性,遇酚酞试液,会使溶液变为红色(合理即可)
23.胶头滴管
溶液由红色恰好变为无色
24.4.4
41.1%
25.70%
14.7g
