实验活动9 乙醇、乙酸的主要性质(课件25页)
文档属性
| 名称 | 实验活动9 乙醇、乙酸的主要性质(课件25页) |

|
|
| 格式 | zip | ||
| 文件大小 | 56.7MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-05-29 00:00:00 | ||
图片预览








文档简介
(共25张PPT)
实验活动9
乙醇、乙酸的主要性质
第七章
有机化合物
第四节
基本营养物质
1.通过实验加深对乙醇、乙酸的主要性质的认识。
2.初步了解有机化合物的制备方法。
3.提高实验设计能力,体会实验设计在实验探究中的应用。
【实验目的】
乙醇、乙酸的主要性质
试管、试管夹、量筒、胶头滴管、玻璃导管、乳胶管、橡胶塞、铁架台、试管架、酒精灯、碎瓷片、火柴、乙醇、乙酸、饱和Na2CO3溶液、浓H2SO4、铜丝,实验还需用品有澄清石灰水、石蕊溶液、酚酞溶液、锌粒、NaOH溶液、蒸发皿。
【实验用品】
乙醇、乙酸的主要性质
1.乙醇的性质
【实验步骤】
序号
实验内容
操作
现象
①
感知乙醇的物理性质
向试管中加入少量乙醇观察,闻气味
液体,有__________
②
乙醇的燃烧
在蒸发皿中滴入少量乙醇点燃,用干燥烧杯罩在火焰上方,然后迅速正立,滴入适量澄清石灰水,振荡
安静燃烧,火焰呈淡蓝色,烧杯内壁有水珠凝结,滴入石灰水,石灰水变浑浊
无色
特殊香味
乙醇、乙酸的主要性质
③
乙醇的催化氧化
向试管中滴入少量乙醇,将铜丝燃烧片刻,立即伸入试管中,反复操作几次
铜丝灼烧后变黑,伸入乙醇中,又变红,有刺激性气味的物质生成
乙醇、乙酸的主要性质
试写出实验②、③过程中有关的化学方程式:
①
;
②
、
;
总方程式:
。
乙醇、乙酸的主要性质
序号
实验内容
操作
现象
①
感知乙酸的物理性质
向试管中加入少量乙酸,观察其状态,闻气味
液体,有
气味
②
乙酸的酸性
分别向盛有CaCO3固体,石蕊溶液,锌粒和含酚酞的NaOH溶液中加入适量乙酸
盛有CaCO3固体的试管中有___
,石蕊溶液
,锌粒
,有
生成,含酚酞的NaOH溶液_________
2.乙酸的性质
无色
强烈刺激性
气
泡生成
变红
溶解
气泡
红色褪去
乙醇、乙酸的主要性质
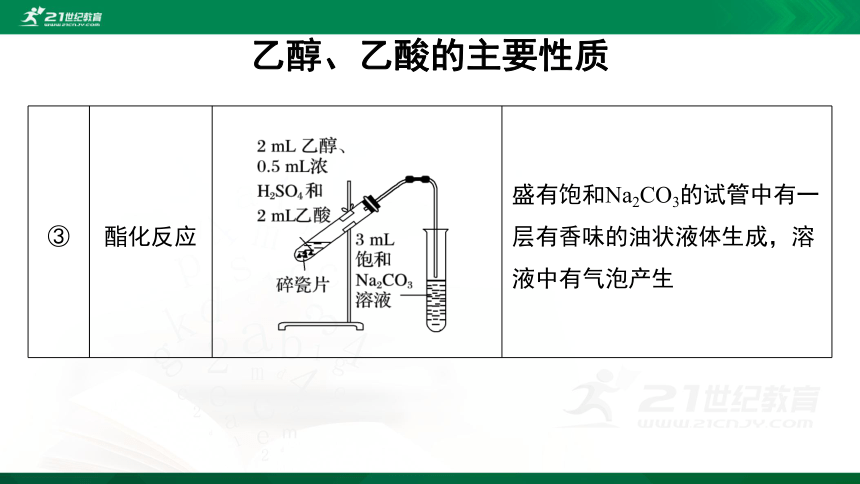
③
酯化反应
?
盛有饱和Na2CO3的试管中有一层有香味的油状液体生成,溶液中有气泡产生
乙醇、乙酸的主要性质
写出实验②、③反应过程中相关的反应方程式:
②
、
、
;
③
。
2CH3COOH+CaCO3===(CH3COO)2Ca+CO2↑+H2O
Zn+2CH3COOH===(CH3COO)2Zn+H2↑
CH3COOH+NaOH===CH3COONa+H2O
乙醇、乙酸的主要性质
乙醇、乙酸的主要性质
插入资源
“【教学实验】乙醇、乙酸的主要性质”。
1.在乙醇氧化生成乙醛的实验中,加热铜丝及将它插入乙醇里的操作为什么反复几次?
【问题讨论】
提示 反复的目的是使生成的乙醛更多,更易感知实验现象。
乙醇、乙酸的主要性质
2.在制乙酸乙酯的实验中,浓H2SO4和饱和Na2CO3溶液各是什么作用?盛有饱和Na2CO3溶液的试管内发生哪些变化?
提示 浓H2SO4在反应中作催化剂和吸水剂,饱和Na2CO3溶液的作用为吸收挥发出的乙酸,溶解挥发出来的乙醇,降低乙酸乙酯的溶解度,利于液体分层;饱和Na2CO3溶液分层,上层是无色油状液体,在溶液内,有无色气泡产生,因为挥发出的CH3COOH有酸性,能和饱和Na2CO3溶液反应生成二氧化碳,化学方程式为2CH3COOH+Na2CO3―→
2CH3COONa+CO2↑+H2O。
乙醇、乙酸的主要性质
3.已知含示踪原子18O的乙醇催化氧化的产物中只有乙醛分子中含18O(
),和乙酸酯化反应的产物中只有乙酸乙酯中含有18O,
试从化学键的角度分析乙醇的催化氧化和酯化反应的机理?
乙醇、乙酸的主要性质
提示 ①根据乙醇的结构
和信息,如18O只存在乙醛分子
中(
),则催化氧化反应中,乙醇分子中断裂的化学键只能是O—H
键和羟基相邻的C—H键,即:
,化学方程式为
+2H2O。
乙醇、乙酸的主要性质
②因为18O只存在乙酸乙酯中,根据乙醇和乙酸的结构,在酯化反应中,只能是乙醇分子中断裂O—H键,乙酸分子中断裂C—O键,归纳为羧酸脱羟基醇
脱氢原子,即:
CH3—CH2—18O—H+
+H2O。
乙醇、乙酸的主要性质
1.下列说法正确的是
A.检测乙醇中是否含有水可加入钠,若有氢气生成则含水
B.除去乙醇中微量水,可加入金属钠,使其完全反应
C.乙醇和钠反应时,钠沉在乙醇的底部,缓慢地放气泡
D.乙醇和水的沸点不同,可直接蒸馏获得无水乙醇
√
解析 乙醇和水都和钠反应生成氢气,故A、B项错误;
直接蒸馏所获得的乙醇中仍含有水,不能得到纯净的无水乙醇,故D项错误;
钠的密度大于乙醇,而且反应比较缓慢,故C项正确。
强化训练
2.如图为实验室制取少量乙酸乙酯的装置图,下列关于该实验的叙述中,不正确的是
A.向a试管中先加入乙醇,然后边摇动试管边慢慢加入
浓硫酸,再加冰醋酸
B.试管b中导气管下端管口不能浸入液面下的原因是防
止实验过程中发生倒吸现象
C.实验时为加快反应速率,可大火加热
D.实验中,饱和Na2CO3溶液作用为吸收乙酸、溶解乙醇,并降低乙酸乙酯的
溶解度
√
强化训练
解析 浓硫酸的密度大于水,稀释过程放热,则加入
试剂的顺序为向a试管中先加入乙醇,然后边摇动试管
边慢慢加入浓硫酸,冷却后再加入冰醋酸,A项正确;
乙醇和乙酸均与水互溶,则试管b中导气管下端管口不
能浸入液面下的原因是防止实验过程中产生倒吸现象,B项正确;
实验时加热试管a的目的之一是及时将乙酸乙酯蒸出,使平衡向生成乙酸乙酯的方向移动,且加热能加快反应速度,但大火加热,会使乙醇、乙酸大量挥发,从而降低了乙酸乙酯的产率,故应小火加热,故C项不正确;
试管b中饱和Na2CO3溶液的作用是吸收随乙酸乙酯蒸出的少量乙酸和乙醇,同时降低乙酸乙酯的溶解度,D项正确。
强化训练
3.下面是甲、乙、丙三位同学制取乙酸乙酯的过程,请你参与并协助他们完成相关实验任务。
[实验目的] 制取乙酸乙酯。
[实验原理] 甲、乙、丙三位同学均采取乙醇、乙酸与浓硫酸混合共热的方
法制取乙酸乙酯,该反应的化学方程式为______________________________
______________________。
CH3COOCH2CH3+H2O
解析 反应过程产生的蒸气中含有乙酸、乙醇、乙酸乙酯和水,其中乙酸、乙醇都易溶于水,所以应该做到防止倒吸。蒸气进入到饱和碳酸钠溶液中,上层即是乙酸乙酯,下层是水层,溶解了乙酸钠、乙醇、碳酸钠等物质。
强化训练
[装置设计] 甲、乙、丙三位同学分别设计了如下图所示三套实验装置:
若从甲、乙两位同学设计的装置中选择一套作为实验室制取乙酸乙酯的装置,选择的装置应是________(填“甲”或“乙”)。丙同学将甲装置中的玻璃管改成了球形的干燥管,除了起冷凝作用外,另一重要作用是__________。
乙
防止倒吸
强化训练
[实验步骤] A.按所选择的装置组装仪器,在试管①中先加入3
mL体积分数为95%的乙醇,并在摇动下缓缓加入2
mL浓硫酸充分摇匀,冷却后再加入2
mL冰醋酸。
B.将试管固定在铁架台上。
C.在试管②中加入5
mL饱和Na2CO3溶液。
D.用酒精灯对试管①加热。
E.当观察到试管②中有明显现象时停止实验。
强化训练
[问题讨论]
(1)步骤A组装好实验装置,加入样品前还应检查___________。
(2)试管②中观察到的现象是______________。
(3)试管②中饱和Na2CO3溶液的作用是___________________________________
_______,饱和Na2CO3溶液________(填“能”或“不能”)用NaOH溶液代替,其原因是__________________________________________。
装置气密性
液体分为两层
溶解乙醇、中和乙酸、降低乙酸乙酯的
溶解度
不能
NaOH和乙酸乙酯反应,促进乙酸乙酯的水解
强化训练
再
见
谢谢
21世纪教育网(www.21cnjy.com)
中小学教育资源网站
有大把高质量资料?一线教师?一线教研员?
欢迎加入21世纪教育网教师合作团队!!月薪过万不是梦!!
详情请看:
https://www.21cnjy.com/help/help_extract.php
实验活动9
乙醇、乙酸的主要性质
第七章
有机化合物
第四节
基本营养物质
1.通过实验加深对乙醇、乙酸的主要性质的认识。
2.初步了解有机化合物的制备方法。
3.提高实验设计能力,体会实验设计在实验探究中的应用。
【实验目的】
乙醇、乙酸的主要性质
试管、试管夹、量筒、胶头滴管、玻璃导管、乳胶管、橡胶塞、铁架台、试管架、酒精灯、碎瓷片、火柴、乙醇、乙酸、饱和Na2CO3溶液、浓H2SO4、铜丝,实验还需用品有澄清石灰水、石蕊溶液、酚酞溶液、锌粒、NaOH溶液、蒸发皿。
【实验用品】
乙醇、乙酸的主要性质
1.乙醇的性质
【实验步骤】
序号
实验内容
操作
现象
①
感知乙醇的物理性质
向试管中加入少量乙醇观察,闻气味
液体,有__________
②
乙醇的燃烧
在蒸发皿中滴入少量乙醇点燃,用干燥烧杯罩在火焰上方,然后迅速正立,滴入适量澄清石灰水,振荡
安静燃烧,火焰呈淡蓝色,烧杯内壁有水珠凝结,滴入石灰水,石灰水变浑浊
无色
特殊香味
乙醇、乙酸的主要性质
③
乙醇的催化氧化
向试管中滴入少量乙醇,将铜丝燃烧片刻,立即伸入试管中,反复操作几次
铜丝灼烧后变黑,伸入乙醇中,又变红,有刺激性气味的物质生成
乙醇、乙酸的主要性质
试写出实验②、③过程中有关的化学方程式:
①
;
②
、
;
总方程式:
。
乙醇、乙酸的主要性质
序号
实验内容
操作
现象
①
感知乙酸的物理性质
向试管中加入少量乙酸,观察其状态,闻气味
液体,有
气味
②
乙酸的酸性
分别向盛有CaCO3固体,石蕊溶液,锌粒和含酚酞的NaOH溶液中加入适量乙酸
盛有CaCO3固体的试管中有___
,石蕊溶液
,锌粒
,有
生成,含酚酞的NaOH溶液_________
2.乙酸的性质
无色
强烈刺激性
气
泡生成
变红
溶解
气泡
红色褪去
乙醇、乙酸的主要性质
③
酯化反应
?
盛有饱和Na2CO3的试管中有一层有香味的油状液体生成,溶液中有气泡产生
乙醇、乙酸的主要性质
写出实验②、③反应过程中相关的反应方程式:
②
、
、
;
③
。
2CH3COOH+CaCO3===(CH3COO)2Ca+CO2↑+H2O
Zn+2CH3COOH===(CH3COO)2Zn+H2↑
CH3COOH+NaOH===CH3COONa+H2O
乙醇、乙酸的主要性质
乙醇、乙酸的主要性质
插入资源
“【教学实验】乙醇、乙酸的主要性质”。
1.在乙醇氧化生成乙醛的实验中,加热铜丝及将它插入乙醇里的操作为什么反复几次?
【问题讨论】
提示 反复的目的是使生成的乙醛更多,更易感知实验现象。
乙醇、乙酸的主要性质
2.在制乙酸乙酯的实验中,浓H2SO4和饱和Na2CO3溶液各是什么作用?盛有饱和Na2CO3溶液的试管内发生哪些变化?
提示 浓H2SO4在反应中作催化剂和吸水剂,饱和Na2CO3溶液的作用为吸收挥发出的乙酸,溶解挥发出来的乙醇,降低乙酸乙酯的溶解度,利于液体分层;饱和Na2CO3溶液分层,上层是无色油状液体,在溶液内,有无色气泡产生,因为挥发出的CH3COOH有酸性,能和饱和Na2CO3溶液反应生成二氧化碳,化学方程式为2CH3COOH+Na2CO3―→
2CH3COONa+CO2↑+H2O。
乙醇、乙酸的主要性质
3.已知含示踪原子18O的乙醇催化氧化的产物中只有乙醛分子中含18O(
),和乙酸酯化反应的产物中只有乙酸乙酯中含有18O,
试从化学键的角度分析乙醇的催化氧化和酯化反应的机理?
乙醇、乙酸的主要性质
提示 ①根据乙醇的结构
和信息,如18O只存在乙醛分子
中(
),则催化氧化反应中,乙醇分子中断裂的化学键只能是O—H
键和羟基相邻的C—H键,即:
,化学方程式为
+2H2O。
乙醇、乙酸的主要性质
②因为18O只存在乙酸乙酯中,根据乙醇和乙酸的结构,在酯化反应中,只能是乙醇分子中断裂O—H键,乙酸分子中断裂C—O键,归纳为羧酸脱羟基醇
脱氢原子,即:
CH3—CH2—18O—H+
+H2O。
乙醇、乙酸的主要性质
1.下列说法正确的是
A.检测乙醇中是否含有水可加入钠,若有氢气生成则含水
B.除去乙醇中微量水,可加入金属钠,使其完全反应
C.乙醇和钠反应时,钠沉在乙醇的底部,缓慢地放气泡
D.乙醇和水的沸点不同,可直接蒸馏获得无水乙醇
√
解析 乙醇和水都和钠反应生成氢气,故A、B项错误;
直接蒸馏所获得的乙醇中仍含有水,不能得到纯净的无水乙醇,故D项错误;
钠的密度大于乙醇,而且反应比较缓慢,故C项正确。
强化训练
2.如图为实验室制取少量乙酸乙酯的装置图,下列关于该实验的叙述中,不正确的是
A.向a试管中先加入乙醇,然后边摇动试管边慢慢加入
浓硫酸,再加冰醋酸
B.试管b中导气管下端管口不能浸入液面下的原因是防
止实验过程中发生倒吸现象
C.实验时为加快反应速率,可大火加热
D.实验中,饱和Na2CO3溶液作用为吸收乙酸、溶解乙醇,并降低乙酸乙酯的
溶解度
√
强化训练
解析 浓硫酸的密度大于水,稀释过程放热,则加入
试剂的顺序为向a试管中先加入乙醇,然后边摇动试管
边慢慢加入浓硫酸,冷却后再加入冰醋酸,A项正确;
乙醇和乙酸均与水互溶,则试管b中导气管下端管口不
能浸入液面下的原因是防止实验过程中产生倒吸现象,B项正确;
实验时加热试管a的目的之一是及时将乙酸乙酯蒸出,使平衡向生成乙酸乙酯的方向移动,且加热能加快反应速度,但大火加热,会使乙醇、乙酸大量挥发,从而降低了乙酸乙酯的产率,故应小火加热,故C项不正确;
试管b中饱和Na2CO3溶液的作用是吸收随乙酸乙酯蒸出的少量乙酸和乙醇,同时降低乙酸乙酯的溶解度,D项正确。
强化训练
3.下面是甲、乙、丙三位同学制取乙酸乙酯的过程,请你参与并协助他们完成相关实验任务。
[实验目的] 制取乙酸乙酯。
[实验原理] 甲、乙、丙三位同学均采取乙醇、乙酸与浓硫酸混合共热的方
法制取乙酸乙酯,该反应的化学方程式为______________________________
______________________。
CH3COOCH2CH3+H2O
解析 反应过程产生的蒸气中含有乙酸、乙醇、乙酸乙酯和水,其中乙酸、乙醇都易溶于水,所以应该做到防止倒吸。蒸气进入到饱和碳酸钠溶液中,上层即是乙酸乙酯,下层是水层,溶解了乙酸钠、乙醇、碳酸钠等物质。
强化训练
[装置设计] 甲、乙、丙三位同学分别设计了如下图所示三套实验装置:
若从甲、乙两位同学设计的装置中选择一套作为实验室制取乙酸乙酯的装置,选择的装置应是________(填“甲”或“乙”)。丙同学将甲装置中的玻璃管改成了球形的干燥管,除了起冷凝作用外,另一重要作用是__________。
乙
防止倒吸
强化训练
[实验步骤] A.按所选择的装置组装仪器,在试管①中先加入3
mL体积分数为95%的乙醇,并在摇动下缓缓加入2
mL浓硫酸充分摇匀,冷却后再加入2
mL冰醋酸。
B.将试管固定在铁架台上。
C.在试管②中加入5
mL饱和Na2CO3溶液。
D.用酒精灯对试管①加热。
E.当观察到试管②中有明显现象时停止实验。
强化训练
[问题讨论]
(1)步骤A组装好实验装置,加入样品前还应检查___________。
(2)试管②中观察到的现象是______________。
(3)试管②中饱和Na2CO3溶液的作用是___________________________________
_______,饱和Na2CO3溶液________(填“能”或“不能”)用NaOH溶液代替,其原因是__________________________________________。
装置气密性
液体分为两层
溶解乙醇、中和乙酸、降低乙酸乙酯的
溶解度
不能
NaOH和乙酸乙酯反应,促进乙酸乙酯的水解
强化训练
再
见
谢谢
21世纪教育网(www.21cnjy.com)
中小学教育资源网站
有大把高质量资料?一线教师?一线教研员?
欢迎加入21世纪教育网教师合作团队!!月薪过万不是梦!!
详情请看:
https://www.21cnjy.com/help/help_extract.php
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
