鲁教版化学九年级下册第八单元《海水中的化学》测试题(含答案)
文档属性
| 名称 | 鲁教版化学九年级下册第八单元《海水中的化学》测试题(含答案) |  | |
| 格式 | zip | ||
| 文件大小 | 319.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-05-29 17:12:35 | ||
图片预览


文档简介
第八单元《海水中的化学》测试题
一、单选题(每小题只有一个正确答案)
1.下列物质在使用过程中与化学性质无关的是( )
A.用小苏打治疗胃酸过多
B.生石灰做干燥剂
C.用干冰进行人工降雨
D.用熟石灰改良酸性土壤
2.某温度下把15克物质A溶于50克水中,恰好形成饱和溶液,该温度下A物质的溶解度为(
)
A.30克/100克水
B.15克/100克水
C.70克/100克水
D.35克/100克水
3.下列各组物质混合后,溶液质量不发生变化的是( )
A.二氧化碳与石灰水
B.碳酸钙与稀盐酸
C.氢氧化钾溶液和稀盐酸
D.铁和硝酸铜溶液
4.甲乙两种固体的溶解度曲线如图所示,下列说法正确的是( )
A.50℃时,100g水中加入20g乙并降温至20℃,溶液中溶质的质量分数不变
B.20℃时,可配制溶质质量分数为30%的乙溶液
C.20℃时,50g水中加入20g乙可得到饱和溶液70g
D.20℃时,甲的某一溶液中的溶质质量分数一定小于乙的某一溶液的质量分数
5.下列各组固体物质不能用水鉴别的是(
)
A.NaOH和NH4NO3
B.CuSO4和Na2CO3
C.CaO和Ca(OH)2
D.Mg(OH)2和CaCO3
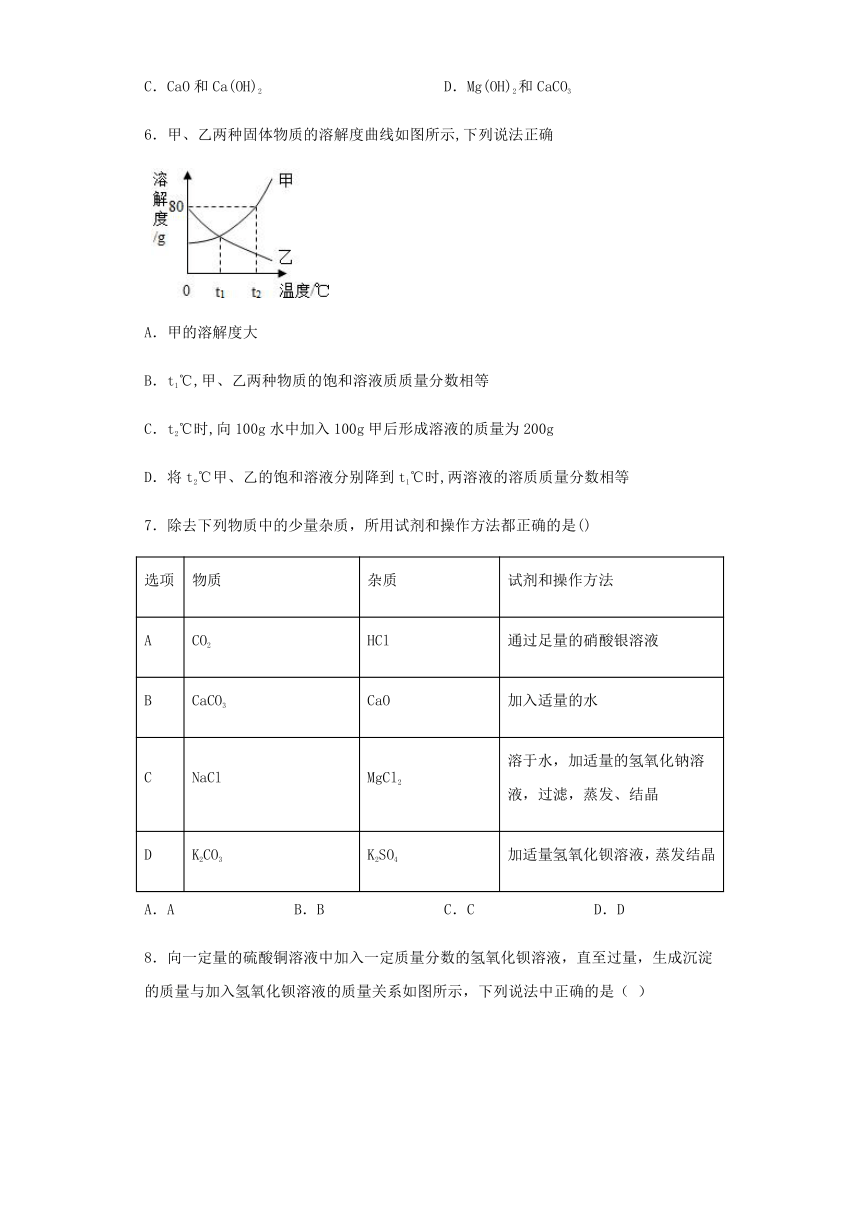
6.甲、乙两种固体物质的溶解度曲线如图所示,下列说法正确
A.甲的溶解度大
B.t1℃,甲、乙两种物质的饱和溶液质质量分数相等
C.t2℃时,向100g水中加入100g甲后形成溶液的质量为200g
D.将t2℃甲、乙的饱和溶液分别降到t1℃时,两溶液的溶质质量分数相等
7.除去下列物质中的少量杂质,所用试剂和操作方法都正确的是()
选项
物质
杂质
试剂和操作方法
A
CO2
HCl
通过足量的硝酸银溶液
B
CaCO3
CaO
加入适量的水
C
NaCl
MgCl2
溶于水,加适量的氢氧化钠溶液,过滤,蒸发、结晶
D
K2CO3
K2SO4
加适量氢氧化钡溶液,蒸发结晶
A.A
B.B
C.C
D.D
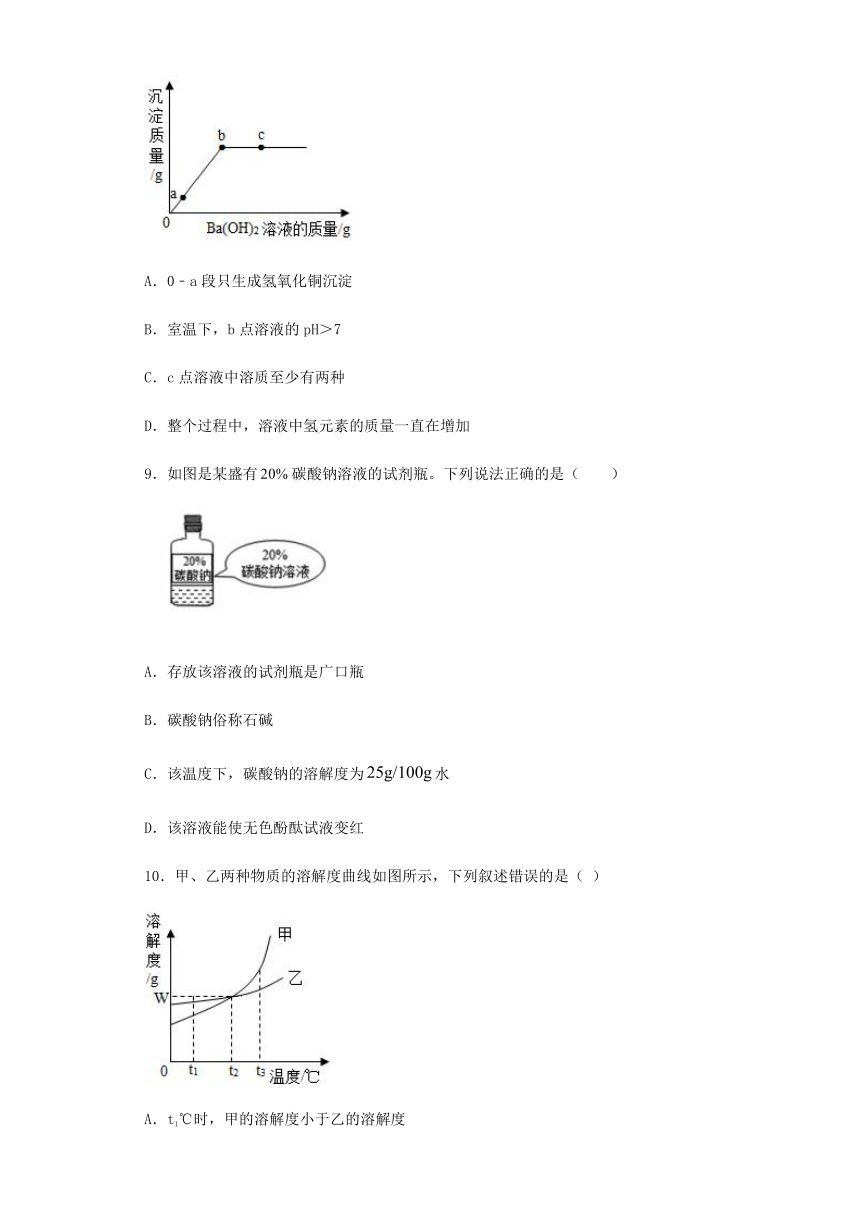
8.向一定量的硫酸铜溶液中加入一定质量分数的氢氧化钡溶液,直至过量,生成沉淀的质量与加入氢氧化钡溶液的质量关系如图所示,下列说法中正确的是(
)
A.0﹣a段只生成氢氧化铜沉淀
B.室温下,b点溶液的pH>7
C.c点溶液中溶质至少有两种
D.整个过程中,溶液中氢元素的质量一直在增加
9.如图是某盛有碳酸钠溶液的试剂瓶。下列说法正确的是(
)
A.存放该溶液的试剂瓶是广口瓶
B.碳酸钠俗称石碱
C.该温度下,碳酸钠的溶解度为水
D.该溶液能使无色酚酞试液变红
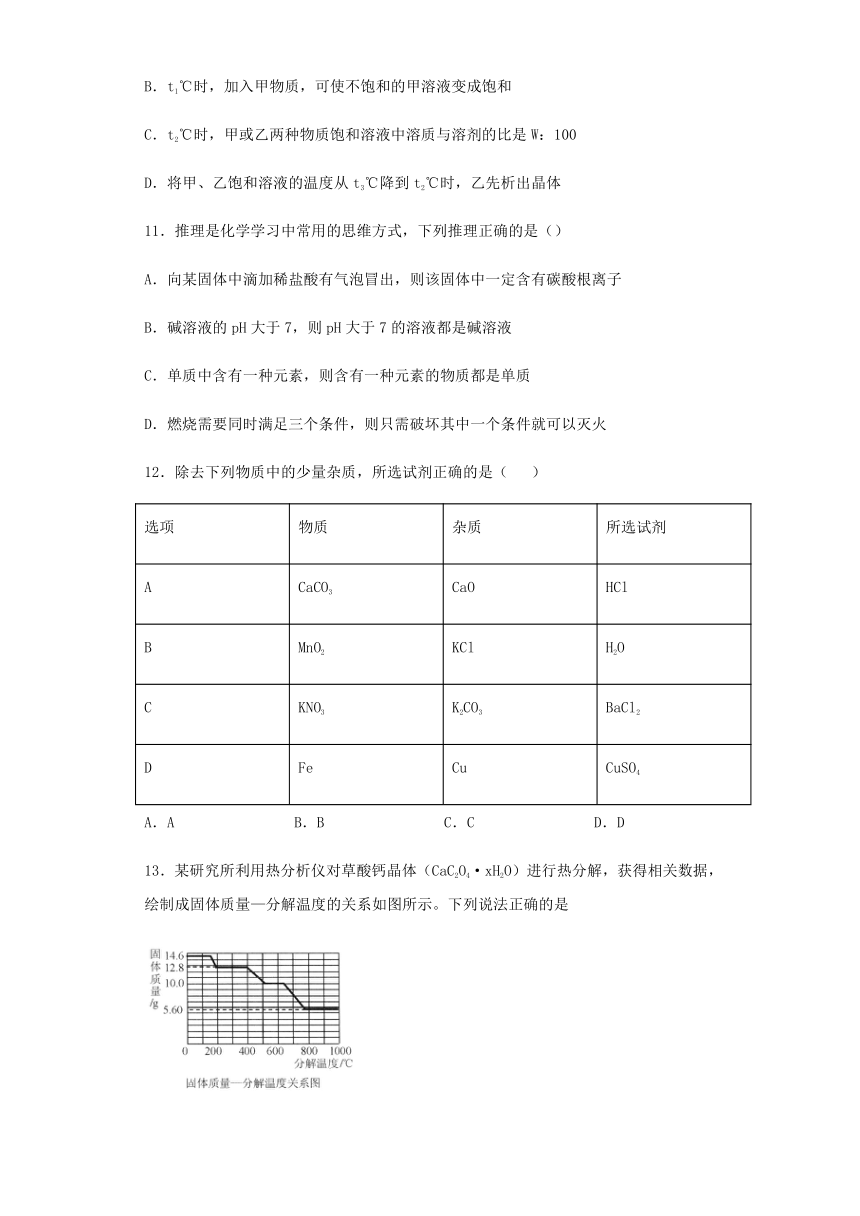
10.甲、乙两种物质的溶解度曲线如图所示,下列叙述错误的是(
)
A.t1℃时,甲的溶解度小于乙的溶解度
B.t1℃时,加入甲物质,可使不饱和的甲溶液变成饱和
C.t2℃时,甲或乙两种物质饱和溶液中溶质与溶剂的比是W:100
D.将甲、乙饱和溶液的温度从t3℃降到t2℃时,乙先析出晶体
11.推理是化学学习中常用的思维方式,下列推理正确的是()
A.向某固体中滴加稀盐酸有气泡冒出,则该固体中一定含有碳酸根离子
B.碱溶液的pH大于7,则pH大于7的溶液都是碱溶液
C.单质中含有一种元素,则含有一种元素的物质都是单质
D.燃烧需要同时满足三个条件,则只需破坏其中一个条件就可以灭火
12.除去下列物质中的少量杂质,所选试剂正确的是(
)
选项
物质
杂质
所选试剂
A
CaCO3
CaO
HCl
B
MnO2
KCl
H2O
C
KNO3
K2CO3
BaCl2
D
Fe
Cu
CuSO4
A.A
B.B
C.C
D.D
13.某研究所利用热分析仪对草酸钙晶体(CaC2O4·xH2O)进行热分解,获得相关数据,绘制成固体质量—分解温度的关系如图所示。下列说法正确的是
A.CaC2O4·xH2O中x=2
B.500~650℃范围内的残留固体为CaC2O4
C.固体质量由12.8g变为10.0g时发生的反应为CaC2O4CaCO3
+
CO↑
D.8000C以上时,固体成分的化学式为CaCO3
14.下列化学方程式中符合题意且书写正确的是( )
A.正常雨水偏弱酸性原因:SO2+H2O=H2SO3
B.除去氯化钠中的氯化镁:2NaOH+MgCl2=Mg(OH)2↓+2NaCl
C.用稀硫酸除去铁锈:Fe2O3+2H2SO4=2FeSO4+2H2O
D.工业上用熟石灰制烧碱:Ca(OH)2+2NaNO3=Ca(NO3)2+2NaOH
15.下列实验过程中与图象描述相符的一组是( )
A.两份等质量、等溶质质量分数的双氧水溶液在有无MnO2的情况下反应产生氧气
B.某温度下将一定量饱和的KNO3溶液恒温蒸发水分
C.向等质量的镁、锌中分别加入足量的等质量等溶质质量分数的稀硫酸
D.一定质量的红磷在密闭容器中燃烧
二、填空题
16.化学与生活息息相关,请用所学化学知识回答下列问题。
(1)端午节“粽子香,香厨房”。这说明分子具有的性质是_____。
(2)喝汽水会打嗝,这是因为气体的溶解度与_____有关。
(3)焙制糕点所用的发酵粉的主要成分之一是一种常见的盐。写出其化学式_____。
(4)常见的化石燃料包括_____、石油和天然气,它们是不可再生能源。化石燃料燃烧后产生的_____、二氧化氮等会导致酸雨,人类迫切需要开发新能源,你知道的一种新能源是_____。
17.用下列物质的序号填空:
①甲烷
②烧碱
③氧气
④碳酸氢钠
⑤熟石灰
(1)可用于气割、气焊的是______;
(2)天然气的主要成分是______;
(3)发酵粉的主要成分是______;
(4)可用于改良酸性土壤的是______。
18.用①盐酸②浓硫酸③烧碱④氮气⑤甲烷⑥熟石灰,选择符合要求的物质用序号填空
(1)可用于干燥CO2的是______;
(2)可用于改良酸性土壤的是______;
(3)可用作食品保护气的是______;
(4)常用于铁制品表面除锈的是______;
(5)可用作汽车燃料的是______。
19.KNO3、NaCl、HNO3、Ba(OH)2四种物质中一般不参与复分解反应的是:______,理由是______。
20.根据下列装置,结合所学化学知识,回答下列问题
(1)写出图1中标号为①的仪器名称
。
(2)实验室用高锰酸钾制取氧气的发生装置选用
,化学方程式为
收集O2的装置最好选用
(填字母编号),用该装置验满O2的方法是
。
(3)用块状石灰石和稀盐酸反应,观察到气泡逸出不明显后,测得B中锥形瓶内残留液,逐渐滴入碳酸钠溶液,并用pH计连续监测测得曲线如图2,[pH值为纵坐标,时间(秒)为横坐标],请写出曲线中bc段的化学方程式
,cd上升的原因是
.
三、推断题
21.某溶液可能含有HCl、H2SO4、NaNO3、CuCl2中的一种或几种,为了探究其组成,向一定质量的该溶液中逐滴加入Ba(OH)2溶液,生成沉淀的质量与所加Ba(OH)2溶液的质量之间的关系如图所示。
(1)O至P段发生反应的化学方程式为_________。
(2)P至Q段产生的沉淀物是__________。
(3)Q点时,所得溶液的pH___7(填“>”“<”或“=”)。
(4)N点时,溶液中一定含有的溶质是_______,可能含有的溶质是_______。
22.图中
A~J
是初中化学常见的物质,且分别是由
H、O、C、S、Cl、Na、Fe、Cu中的一种或几种元素组成,它们之间的关系如图所示。A、B、C、D
均为单质,在通常
情况下,A与其他物质的状态不同;E和F;G和H;I和J物质类别相同,且I俗称苛性钠,H常用于灭火。(“—”表示两端物质间能发生反应,“→”表示物质间存在转化关系;部分反应物、生成物或反应条件已略去)。请回答下列问题:
(1)写出I的化学式:______。
(2)写出B→C反应的化学方程式_____。
(3)F和I反应的基本反应类型为_____。
(4)写出F→E反应的化学方程式_____。
四、实验题
23.重庆一中化学兴趣小组的同学们在实验室进行粗盐提出实验,并用所得精盐配置50g、5%的NaCl溶液。
(1)粗盐提纯实验的操作顺序为_____(填图中字母),称量精盐并计算产率;A操作中玻璃棒作用为_____。
(2)关于粗盐提纯实验下列说法正确的是_____(填序号)
①将粗盐直接放在天平左盘上进行称量
②将蒸发皿放在石棉网上加热
③蒸发时待水分全部蒸干后停止加热
④过滤后滤液仍浑浊应重新过滤
(3)配制NaCl溶液时,称量精盐发现天平指针偏左,应_____(填序号)
A
增加适量砝码
B
减少适量砝码
C
增加适量精盐
D
减少适量精盐
(4)配制NaCl溶液溶质质量分数偏小,其原因可能有_____(填序号)
①粗盐溶解时不充分
②过滤时滤纸破损
③蒸发时溶液飞溅
④配溶液时称量的精盐仍潮湿
24.碳酸钠广泛用于造纸、纺织、洗涤剂等工业。是一种重要的化工原料,工业制碱法的原理是:,然后加热分解固体得到,兴趣小组采用下列装置模拟工业制碱法制备碳或氢钠,进而制得碳酸钠。
(查阅资料)氨气易溶于水,通常状况下1体积水约溶解700体积的氮气;二氧化碳能溶于水,通常状况下1体积水约溶解1体积的二氧化碳。
(实验过程)
(1)关闭,打开通入并调节气流速率,然后打开通入。
(2)当三颈烧瓶内出现较多固体时,先后停止通入两种气体。
(3)将三颈烧瓶内反应后的混合物过滤、洗涤,并将所得固体加热充分加热。
(问题讨论)
(1)停止通气后三颈烧瓶内的溶液是否是的饱和溶液?________,洗气瓶中饱和溶液的作用是__________________(用化学方程式表示)。
(2)实验中长颈漏斗的作用是____________________。有同学认为应在长颈漏斗内放置蘸有酸液的棉花,理由是_________________。
(3)依据“查阅资料”所得信息,实验结束时应先停止通还是?________,已知氯化铵、氯化钠和碳酸氢钠的溶解度如右图所示,从反应后的滤液里得到氯化铵固体可采用的方法是________________。
(4)实验过程中先通入,能充分吸收的原因是_______________。实验中用生石灰能更好地产生氨气,理由是__________________、____________________。
(5)加热分解固体得到,判断得到的固体中是否有剩余的方法是_________________________。
五、计算题
25.晴晴同学为测定某石灰石中碳酸钙的质量分数(杂质不与酸反应),向6.0g石灰石样品中逐滴加人稀盐酸至不再产生气泡为止,共生成二氧化碳气体2.2g。试计算:
(1)碳酸钙中钙元素的质量分数是多少?
(2)该石灰石样品中碳酸钙的质量分数为多少?(写出计算过程,结果精确至0.1%)
(3)若要计算上述反应所消耗盐酸溶液的质量,题中还缺少的一个数据是。
____________________________________________。
26.实验室用碳酸钠溶液与氯化钙溶液反应制取高纯度碳酸钙粉末,烧杯中现有80g碳酸钠溶液。将90g氯化钙溶液分四次加入,充分反应,四次测量所得数据如下表所示:
次数
一
二
三
四
加入氯化钙溶液的质量/g
20
20
20
30
烧杯中溶液的总质量/g
97
114
131
160
(1)恰好完全反应时,生成沉淀的总质量为_____g。
(2)第三次测量时,所得溶液中的溶质有_____(填化学式)。
(3)计算氯化钙溶液的溶质质量分数_____(写出计算过程)。
参考答案
1.C
2.A
3.C
4.A
5.D
6.B
7.C
8.D
9.D
10.D
11.D
12.B
13.C
14.B
15.C
16.分子不断运动
温度
NaHCO3
煤
二氧化硫
太阳能
17.③
①
④
⑤
18.②
⑥
④
①
⑤
19.KNO3
它与其它物质不会产生沉淀、气体或水
20.(1)长颈漏斗
(2)A;2KMnO4==K2MnO4+MnO2+O2↑;E;将带火星的木条平放在集气瓶口,木条复燃,证明氧气满了
(3)Na2CO3+CaCl2=CaCO3↓+2NaCl;碳酸钠溶液显碱性
21.2HCl
+
Ba(OH)2
=
BaCl2
+
2H2O
Cu(OH)2
=
BaCl2和Ba(OH)2
NaNO3
22.NaOH;
Fe+CuSO4=FeSO4+Cu
复分解反应
BaCl2+H2SO4=BaSO4↓+2HCl
23.CBA
搅拌,防止液滴飞溅
④
D
②④
24.是
平衡气压(或调解气压、防装置内气压过大)
吸收(或酸能和反应、或是碱性气体、或处理尾气)
先停止通
降温结晶法
氨气溶于水溶液显碱性,二氧化碳的水溶液显酸性
氧化钙和水反应生成氢氧化钙
反应放热(或放热)
取固体样品,加热,观察试管口是否有水珠生成
25.(1)
40%
(2)83.3%
(3)盐酸的溶质质量分数
26.10
NaCl、Na2CO3
16.65%
一、单选题(每小题只有一个正确答案)
1.下列物质在使用过程中与化学性质无关的是( )
A.用小苏打治疗胃酸过多
B.生石灰做干燥剂
C.用干冰进行人工降雨
D.用熟石灰改良酸性土壤
2.某温度下把15克物质A溶于50克水中,恰好形成饱和溶液,该温度下A物质的溶解度为(
)
A.30克/100克水
B.15克/100克水
C.70克/100克水
D.35克/100克水
3.下列各组物质混合后,溶液质量不发生变化的是( )
A.二氧化碳与石灰水
B.碳酸钙与稀盐酸
C.氢氧化钾溶液和稀盐酸
D.铁和硝酸铜溶液
4.甲乙两种固体的溶解度曲线如图所示,下列说法正确的是( )
A.50℃时,100g水中加入20g乙并降温至20℃,溶液中溶质的质量分数不变
B.20℃时,可配制溶质质量分数为30%的乙溶液
C.20℃时,50g水中加入20g乙可得到饱和溶液70g
D.20℃时,甲的某一溶液中的溶质质量分数一定小于乙的某一溶液的质量分数
5.下列各组固体物质不能用水鉴别的是(
)
A.NaOH和NH4NO3
B.CuSO4和Na2CO3
C.CaO和Ca(OH)2
D.Mg(OH)2和CaCO3
6.甲、乙两种固体物质的溶解度曲线如图所示,下列说法正确
A.甲的溶解度大
B.t1℃,甲、乙两种物质的饱和溶液质质量分数相等
C.t2℃时,向100g水中加入100g甲后形成溶液的质量为200g
D.将t2℃甲、乙的饱和溶液分别降到t1℃时,两溶液的溶质质量分数相等
7.除去下列物质中的少量杂质,所用试剂和操作方法都正确的是()
选项
物质
杂质
试剂和操作方法
A
CO2
HCl
通过足量的硝酸银溶液
B
CaCO3
CaO
加入适量的水
C
NaCl
MgCl2
溶于水,加适量的氢氧化钠溶液,过滤,蒸发、结晶
D
K2CO3
K2SO4
加适量氢氧化钡溶液,蒸发结晶
A.A
B.B
C.C
D.D
8.向一定量的硫酸铜溶液中加入一定质量分数的氢氧化钡溶液,直至过量,生成沉淀的质量与加入氢氧化钡溶液的质量关系如图所示,下列说法中正确的是(
)
A.0﹣a段只生成氢氧化铜沉淀
B.室温下,b点溶液的pH>7
C.c点溶液中溶质至少有两种
D.整个过程中,溶液中氢元素的质量一直在增加
9.如图是某盛有碳酸钠溶液的试剂瓶。下列说法正确的是(
)
A.存放该溶液的试剂瓶是广口瓶
B.碳酸钠俗称石碱
C.该温度下,碳酸钠的溶解度为水
D.该溶液能使无色酚酞试液变红
10.甲、乙两种物质的溶解度曲线如图所示,下列叙述错误的是(
)
A.t1℃时,甲的溶解度小于乙的溶解度
B.t1℃时,加入甲物质,可使不饱和的甲溶液变成饱和
C.t2℃时,甲或乙两种物质饱和溶液中溶质与溶剂的比是W:100
D.将甲、乙饱和溶液的温度从t3℃降到t2℃时,乙先析出晶体
11.推理是化学学习中常用的思维方式,下列推理正确的是()
A.向某固体中滴加稀盐酸有气泡冒出,则该固体中一定含有碳酸根离子
B.碱溶液的pH大于7,则pH大于7的溶液都是碱溶液
C.单质中含有一种元素,则含有一种元素的物质都是单质
D.燃烧需要同时满足三个条件,则只需破坏其中一个条件就可以灭火
12.除去下列物质中的少量杂质,所选试剂正确的是(
)
选项
物质
杂质
所选试剂
A
CaCO3
CaO
HCl
B
MnO2
KCl
H2O
C
KNO3
K2CO3
BaCl2
D
Fe
Cu
CuSO4
A.A
B.B
C.C
D.D
13.某研究所利用热分析仪对草酸钙晶体(CaC2O4·xH2O)进行热分解,获得相关数据,绘制成固体质量—分解温度的关系如图所示。下列说法正确的是
A.CaC2O4·xH2O中x=2
B.500~650℃范围内的残留固体为CaC2O4
C.固体质量由12.8g变为10.0g时发生的反应为CaC2O4CaCO3
+
CO↑
D.8000C以上时,固体成分的化学式为CaCO3
14.下列化学方程式中符合题意且书写正确的是( )
A.正常雨水偏弱酸性原因:SO2+H2O=H2SO3
B.除去氯化钠中的氯化镁:2NaOH+MgCl2=Mg(OH)2↓+2NaCl
C.用稀硫酸除去铁锈:Fe2O3+2H2SO4=2FeSO4+2H2O
D.工业上用熟石灰制烧碱:Ca(OH)2+2NaNO3=Ca(NO3)2+2NaOH
15.下列实验过程中与图象描述相符的一组是( )
A.两份等质量、等溶质质量分数的双氧水溶液在有无MnO2的情况下反应产生氧气
B.某温度下将一定量饱和的KNO3溶液恒温蒸发水分
C.向等质量的镁、锌中分别加入足量的等质量等溶质质量分数的稀硫酸
D.一定质量的红磷在密闭容器中燃烧
二、填空题
16.化学与生活息息相关,请用所学化学知识回答下列问题。
(1)端午节“粽子香,香厨房”。这说明分子具有的性质是_____。
(2)喝汽水会打嗝,这是因为气体的溶解度与_____有关。
(3)焙制糕点所用的发酵粉的主要成分之一是一种常见的盐。写出其化学式_____。
(4)常见的化石燃料包括_____、石油和天然气,它们是不可再生能源。化石燃料燃烧后产生的_____、二氧化氮等会导致酸雨,人类迫切需要开发新能源,你知道的一种新能源是_____。
17.用下列物质的序号填空:
①甲烷
②烧碱
③氧气
④碳酸氢钠
⑤熟石灰
(1)可用于气割、气焊的是______;
(2)天然气的主要成分是______;
(3)发酵粉的主要成分是______;
(4)可用于改良酸性土壤的是______。
18.用①盐酸②浓硫酸③烧碱④氮气⑤甲烷⑥熟石灰,选择符合要求的物质用序号填空
(1)可用于干燥CO2的是______;
(2)可用于改良酸性土壤的是______;
(3)可用作食品保护气的是______;
(4)常用于铁制品表面除锈的是______;
(5)可用作汽车燃料的是______。
19.KNO3、NaCl、HNO3、Ba(OH)2四种物质中一般不参与复分解反应的是:______,理由是______。
20.根据下列装置,结合所学化学知识,回答下列问题
(1)写出图1中标号为①的仪器名称
。
(2)实验室用高锰酸钾制取氧气的发生装置选用
,化学方程式为
收集O2的装置最好选用
(填字母编号),用该装置验满O2的方法是
。
(3)用块状石灰石和稀盐酸反应,观察到气泡逸出不明显后,测得B中锥形瓶内残留液,逐渐滴入碳酸钠溶液,并用pH计连续监测测得曲线如图2,[pH值为纵坐标,时间(秒)为横坐标],请写出曲线中bc段的化学方程式
,cd上升的原因是
.
三、推断题
21.某溶液可能含有HCl、H2SO4、NaNO3、CuCl2中的一种或几种,为了探究其组成,向一定质量的该溶液中逐滴加入Ba(OH)2溶液,生成沉淀的质量与所加Ba(OH)2溶液的质量之间的关系如图所示。
(1)O至P段发生反应的化学方程式为_________。
(2)P至Q段产生的沉淀物是__________。
(3)Q点时,所得溶液的pH___7(填“>”“<”或“=”)。
(4)N点时,溶液中一定含有的溶质是_______,可能含有的溶质是_______。
22.图中
A~J
是初中化学常见的物质,且分别是由
H、O、C、S、Cl、Na、Fe、Cu中的一种或几种元素组成,它们之间的关系如图所示。A、B、C、D
均为单质,在通常
情况下,A与其他物质的状态不同;E和F;G和H;I和J物质类别相同,且I俗称苛性钠,H常用于灭火。(“—”表示两端物质间能发生反应,“→”表示物质间存在转化关系;部分反应物、生成物或反应条件已略去)。请回答下列问题:
(1)写出I的化学式:______。
(2)写出B→C反应的化学方程式_____。
(3)F和I反应的基本反应类型为_____。
(4)写出F→E反应的化学方程式_____。
四、实验题
23.重庆一中化学兴趣小组的同学们在实验室进行粗盐提出实验,并用所得精盐配置50g、5%的NaCl溶液。
(1)粗盐提纯实验的操作顺序为_____(填图中字母),称量精盐并计算产率;A操作中玻璃棒作用为_____。
(2)关于粗盐提纯实验下列说法正确的是_____(填序号)
①将粗盐直接放在天平左盘上进行称量
②将蒸发皿放在石棉网上加热
③蒸发时待水分全部蒸干后停止加热
④过滤后滤液仍浑浊应重新过滤
(3)配制NaCl溶液时,称量精盐发现天平指针偏左,应_____(填序号)
A
增加适量砝码
B
减少适量砝码
C
增加适量精盐
D
减少适量精盐
(4)配制NaCl溶液溶质质量分数偏小,其原因可能有_____(填序号)
①粗盐溶解时不充分
②过滤时滤纸破损
③蒸发时溶液飞溅
④配溶液时称量的精盐仍潮湿
24.碳酸钠广泛用于造纸、纺织、洗涤剂等工业。是一种重要的化工原料,工业制碱法的原理是:,然后加热分解固体得到,兴趣小组采用下列装置模拟工业制碱法制备碳或氢钠,进而制得碳酸钠。
(查阅资料)氨气易溶于水,通常状况下1体积水约溶解700体积的氮气;二氧化碳能溶于水,通常状况下1体积水约溶解1体积的二氧化碳。
(实验过程)
(1)关闭,打开通入并调节气流速率,然后打开通入。
(2)当三颈烧瓶内出现较多固体时,先后停止通入两种气体。
(3)将三颈烧瓶内反应后的混合物过滤、洗涤,并将所得固体加热充分加热。
(问题讨论)
(1)停止通气后三颈烧瓶内的溶液是否是的饱和溶液?________,洗气瓶中饱和溶液的作用是__________________(用化学方程式表示)。
(2)实验中长颈漏斗的作用是____________________。有同学认为应在长颈漏斗内放置蘸有酸液的棉花,理由是_________________。
(3)依据“查阅资料”所得信息,实验结束时应先停止通还是?________,已知氯化铵、氯化钠和碳酸氢钠的溶解度如右图所示,从反应后的滤液里得到氯化铵固体可采用的方法是________________。
(4)实验过程中先通入,能充分吸收的原因是_______________。实验中用生石灰能更好地产生氨气,理由是__________________、____________________。
(5)加热分解固体得到,判断得到的固体中是否有剩余的方法是_________________________。
五、计算题
25.晴晴同学为测定某石灰石中碳酸钙的质量分数(杂质不与酸反应),向6.0g石灰石样品中逐滴加人稀盐酸至不再产生气泡为止,共生成二氧化碳气体2.2g。试计算:
(1)碳酸钙中钙元素的质量分数是多少?
(2)该石灰石样品中碳酸钙的质量分数为多少?(写出计算过程,结果精确至0.1%)
(3)若要计算上述反应所消耗盐酸溶液的质量,题中还缺少的一个数据是。
____________________________________________。
26.实验室用碳酸钠溶液与氯化钙溶液反应制取高纯度碳酸钙粉末,烧杯中现有80g碳酸钠溶液。将90g氯化钙溶液分四次加入,充分反应,四次测量所得数据如下表所示:
次数
一
二
三
四
加入氯化钙溶液的质量/g
20
20
20
30
烧杯中溶液的总质量/g
97
114
131
160
(1)恰好完全反应时,生成沉淀的总质量为_____g。
(2)第三次测量时,所得溶液中的溶质有_____(填化学式)。
(3)计算氯化钙溶液的溶质质量分数_____(写出计算过程)。
参考答案
1.C
2.A
3.C
4.A
5.D
6.B
7.C
8.D
9.D
10.D
11.D
12.B
13.C
14.B
15.C
16.分子不断运动
温度
NaHCO3
煤
二氧化硫
太阳能
17.③
①
④
⑤
18.②
⑥
④
①
⑤
19.KNO3
它与其它物质不会产生沉淀、气体或水
20.(1)长颈漏斗
(2)A;2KMnO4==K2MnO4+MnO2+O2↑;E;将带火星的木条平放在集气瓶口,木条复燃,证明氧气满了
(3)Na2CO3+CaCl2=CaCO3↓+2NaCl;碳酸钠溶液显碱性
21.2HCl
+
Ba(OH)2
=
BaCl2
+
2H2O
Cu(OH)2
=
BaCl2和Ba(OH)2
NaNO3
22.NaOH;
Fe+CuSO4=FeSO4+Cu
复分解反应
BaCl2+H2SO4=BaSO4↓+2HCl
23.CBA
搅拌,防止液滴飞溅
④
D
②④
24.是
平衡气压(或调解气压、防装置内气压过大)
吸收(或酸能和反应、或是碱性气体、或处理尾气)
先停止通
降温结晶法
氨气溶于水溶液显碱性,二氧化碳的水溶液显酸性
氧化钙和水反应生成氢氧化钙
反应放热(或放热)
取固体样品,加热,观察试管口是否有水珠生成
25.(1)
40%
(2)83.3%
(3)盐酸的溶质质量分数
26.10
NaCl、Na2CO3
16.65%
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
