高三二轮复习---能力提升 离子交换膜在电化学中的应用(共16张PPT)
文档属性
| 名称 | 高三二轮复习---能力提升 离子交换膜在电化学中的应用(共16张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-05-30 00:00:00 | ||
图片预览




文档简介
(共16张PPT)
高三二轮复习---能力提升
离子交换膜在电化学中的应用
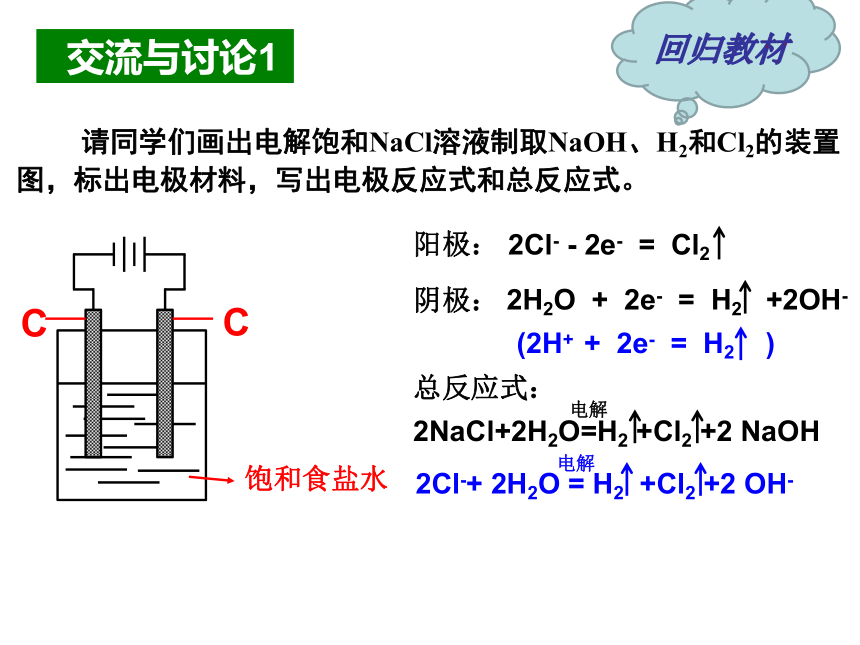
交流与讨论1
请同学们画出电解饱和NaCl溶液制取NaOH、H2和Cl2的装置
图,标出电极材料,写出电极反应式和总反应式。
阳极:
2Cl-
-
2e-
=
Cl2
阴极:
2H2O
+
2e-
=
H2
+2OH-
(2H+
+
2e-
=
H2
)
总反应式:
2Cl-+
2H2O
=
H2
+Cl2
+2
OH-
电解
2NaCl+2H2O=H2
+Cl2
+2
NaOH
电解
C
C
饱和食盐水
回归教材
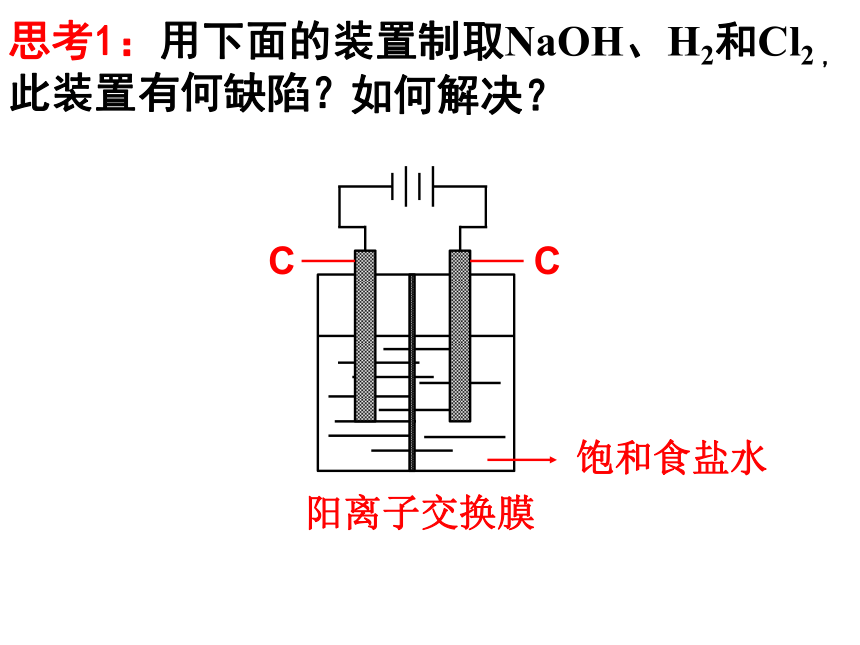
思考1:用下面的装置制取NaOH、H2和Cl2
,此装置有何缺陷?(收集除外)
如何解决?
阳离子交换膜
C
C
饱和食盐水
思考2:如右图所示,在没有离子交换膜的情况下,用惰性电极电解饱和氯化钠溶液,可以制取环保性消毒液,请写出电池总反应式。
NaCl+H2O
NaClO+H2↑
电解
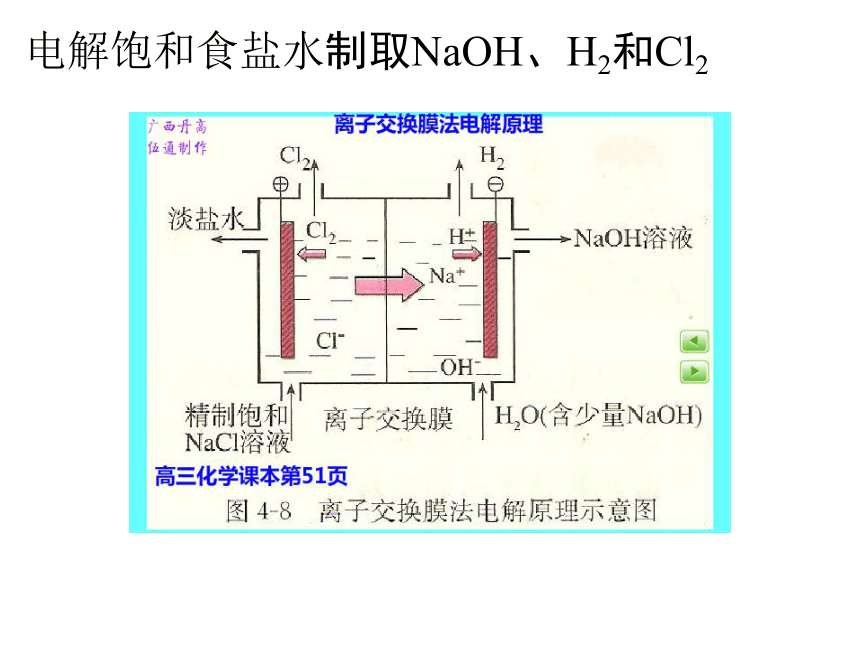
电解饱和食盐水制取NaOH、H2和Cl2
离子交换膜
离子交换膜是一种对溶液里的离子具有选择透过能力的高分子膜。因在应用时主要是利用它对离子选择透过性,又称为离子选择透过性膜。离子交换膜法在电化学工业中应用十分广泛。
教材中并未专门介绍,一般是在讲解氯碱工业时介绍阳离子交换膜的应用,但在近年考试中涉及离子交换膜原理的考题屡见不鲜.
一、离子交换膜的功能:
使离子选择性定向迁移(目的是平衡整个溶液的离子浓度或电荷)
二、离子交换膜在中学电化学中的作用:
1.防止副反应的发生,避免影响所制取产品的质量;防止引发不安全因素。
2.用于物质的制备、分离、提纯等。
三、离子交换膜的类型:
常见的离子交换膜为:阳离子交换膜、阴离子交换膜、特殊离子(质子)交换膜等。
KI+3H2O
KIO3+3H2↑
将饱和食盐水换成KI及淀粉溶液制备KIO3(如下图所示),通电发现右侧溶液变蓝色,一段时间后,蓝色逐渐变浅。已知:3I2+6OH-=IO3-+5I-+3H2O。
(1)阴极电极反应式_______________________
总反应方程式___________________________。
变式练习
(2)A为___离子交换膜(填“阳”或“阴”)
2H+
+
2e﹣=
H2↑
阴
(3)假如使用阳离子交换膜,会发生怎样的变化?
变式练习
阳极
2I﹣﹣2e﹣=I2
阴极
2H++2e﹣=H2↑
电解
总反应
2KI+2H2O
2KOH+I2+H2↑
一种以肼(N2H4)为燃料的电池装置如下图所示。该电池用空气中的氧气作为氧化剂,KOH作为电解质。
请写出负极发生的电极反应式_________________.
该燃料电池持续放电时,图中选_____离子交换膜。
交流与讨论2
阴
N2H4-4e-+4OH-=N2
+4H2O
小结:
离子交换膜选择的一般依据
离子移动方向
电池总反应式(目的)
电极反应式
巩固提高
如图装置进行海水淡化,其中电极A接直流电源的负极,电极B接直流电源的正极,则:
①隔膜A是
______
(填“阳”、“阴”)离子交换膜。
②若用电解K2SO4溶液制取KOH和H2SO4,A、B、C三室依次盛放的物质是:
阳
H2SO4
KOH
K2SO4
阳极
阴极
【2015全国I卷11】微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示。下列有关微生物电池的说法错误的是(
)
A.正极反应中有CO2生成
B.微生物促进了反应中电子的转移
C.质子通过交换膜从负极区移向正极区
D.电池总反应为C6H12O6+6O2=6CO2+6H2O
A
直击高考
【2016全国I卷5】三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。
下列叙述正确的是(
)
A.通电后中间隔室的SO42-离子向正极迁移,正极区溶液pH增大
B.该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
C.负极反应为2
H2O–4e–=O2
+4H+,负极区溶液pH降低
D.当电路中通过1mol电子的电量时,会有0.5mol的O2生成
B
直击高考
【2018全国I卷13】最近我国科学家设计了一种CO2+H2S协同转化装置,实现对天然气中CO2和H2S的高效去除。示意图如图所示,其中电极分别为ZnO@石墨烯(石墨烯包裹的ZnO)和石墨烯,石墨烯电极区发生反应为:
①EDTA-Fe2+
-
e-
=
EDTA-Fe3+
②2EDTA-Fe3+
+
H2S
=
2H+
+
S
+
2EDTA-Fe2+
直击高考
该装置工作时,下列叙述错误的是(
)
A.阴极的电极反应:CO2+2H++2e-=CO+H2O
B.协同转化总反应:CO2+H2S=CO+H2O+S
C.石墨烯上的电势比ZnO@石墨烯上的低
D.若采用Fe3+/Fe2+取代EDTA-Fe3+/EDTA-Fe2+,溶液需为酸性
C
谢谢大家!
祝同学们2019高考成功!
高三二轮复习---能力提升
离子交换膜在电化学中的应用
交流与讨论1
请同学们画出电解饱和NaCl溶液制取NaOH、H2和Cl2的装置
图,标出电极材料,写出电极反应式和总反应式。
阳极:
2Cl-
-
2e-
=
Cl2
阴极:
2H2O
+
2e-
=
H2
+2OH-
(2H+
+
2e-
=
H2
)
总反应式:
2Cl-+
2H2O
=
H2
+Cl2
+2
OH-
电解
2NaCl+2H2O=H2
+Cl2
+2
NaOH
电解
C
C
饱和食盐水
回归教材
思考1:用下面的装置制取NaOH、H2和Cl2
,此装置有何缺陷?(收集除外)
如何解决?
阳离子交换膜
C
C
饱和食盐水
思考2:如右图所示,在没有离子交换膜的情况下,用惰性电极电解饱和氯化钠溶液,可以制取环保性消毒液,请写出电池总反应式。
NaCl+H2O
NaClO+H2↑
电解
电解饱和食盐水制取NaOH、H2和Cl2
离子交换膜
离子交换膜是一种对溶液里的离子具有选择透过能力的高分子膜。因在应用时主要是利用它对离子选择透过性,又称为离子选择透过性膜。离子交换膜法在电化学工业中应用十分广泛。
教材中并未专门介绍,一般是在讲解氯碱工业时介绍阳离子交换膜的应用,但在近年考试中涉及离子交换膜原理的考题屡见不鲜.
一、离子交换膜的功能:
使离子选择性定向迁移(目的是平衡整个溶液的离子浓度或电荷)
二、离子交换膜在中学电化学中的作用:
1.防止副反应的发生,避免影响所制取产品的质量;防止引发不安全因素。
2.用于物质的制备、分离、提纯等。
三、离子交换膜的类型:
常见的离子交换膜为:阳离子交换膜、阴离子交换膜、特殊离子(质子)交换膜等。
KI+3H2O
KIO3+3H2↑
将饱和食盐水换成KI及淀粉溶液制备KIO3(如下图所示),通电发现右侧溶液变蓝色,一段时间后,蓝色逐渐变浅。已知:3I2+6OH-=IO3-+5I-+3H2O。
(1)阴极电极反应式_______________________
总反应方程式___________________________。
变式练习
(2)A为___离子交换膜(填“阳”或“阴”)
2H+
+
2e﹣=
H2↑
阴
(3)假如使用阳离子交换膜,会发生怎样的变化?
变式练习
阳极
2I﹣﹣2e﹣=I2
阴极
2H++2e﹣=H2↑
电解
总反应
2KI+2H2O
2KOH+I2+H2↑
一种以肼(N2H4)为燃料的电池装置如下图所示。该电池用空气中的氧气作为氧化剂,KOH作为电解质。
请写出负极发生的电极反应式_________________.
该燃料电池持续放电时,图中选_____离子交换膜。
交流与讨论2
阴
N2H4-4e-+4OH-=N2
+4H2O
小结:
离子交换膜选择的一般依据
离子移动方向
电池总反应式(目的)
电极反应式
巩固提高
如图装置进行海水淡化,其中电极A接直流电源的负极,电极B接直流电源的正极,则:
①隔膜A是
______
(填“阳”、“阴”)离子交换膜。
②若用电解K2SO4溶液制取KOH和H2SO4,A、B、C三室依次盛放的物质是:
阳
H2SO4
KOH
K2SO4
阳极
阴极
【2015全国I卷11】微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示。下列有关微生物电池的说法错误的是(
)
A.正极反应中有CO2生成
B.微生物促进了反应中电子的转移
C.质子通过交换膜从负极区移向正极区
D.电池总反应为C6H12O6+6O2=6CO2+6H2O
A
直击高考
【2016全国I卷5】三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。
下列叙述正确的是(
)
A.通电后中间隔室的SO42-离子向正极迁移,正极区溶液pH增大
B.该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
C.负极反应为2
H2O–4e–=O2
+4H+,负极区溶液pH降低
D.当电路中通过1mol电子的电量时,会有0.5mol的O2生成
B
直击高考
【2018全国I卷13】最近我国科学家设计了一种CO2+H2S协同转化装置,实现对天然气中CO2和H2S的高效去除。示意图如图所示,其中电极分别为ZnO@石墨烯(石墨烯包裹的ZnO)和石墨烯,石墨烯电极区发生反应为:
①EDTA-Fe2+
-
e-
=
EDTA-Fe3+
②2EDTA-Fe3+
+
H2S
=
2H+
+
S
+
2EDTA-Fe2+
直击高考
该装置工作时,下列叙述错误的是(
)
A.阴极的电极反应:CO2+2H++2e-=CO+H2O
B.协同转化总反应:CO2+H2S=CO+H2O+S
C.石墨烯上的电势比ZnO@石墨烯上的低
D.若采用Fe3+/Fe2+取代EDTA-Fe3+/EDTA-Fe2+,溶液需为酸性
C
谢谢大家!
祝同学们2019高考成功!
