人教版高中化学必修二 2.3化学反应的速率和限度(第2课时) 课件(共27张PPT)
文档属性
| 名称 | 人教版高中化学必修二 2.3化学反应的速率和限度(第2课时) 课件(共27张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 700.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-06-01 10:46:11 | ||
图片预览







文档简介
(共27张PPT)
第二章
化学反应与能量
第三节
化学反应的速率和限度
(第2课时)
CO
2、又发现从炉顶排出没利用的CO浓度很高,但增加了高炉的高度,排出的一氧化碳浓度还是一样,没有降低?不知为什么?
科学史话
1、生产中发现:炼制一定量的生铁,实际投料远高于理论的计算值。为什么?
科学研究表明:很多化学反应在进行时都具有可逆性。
勒夏特列研究发现:
1、C+O2=CO2
2、
3、Fe2O3+3CO==2Fe+3CO2
可逆反应
启示:化学反应是有限度的,有些能进行地较彻底,有些反应是不彻底的,甚至是可逆的。
H2
+
I2
2HI
正反应
逆反应
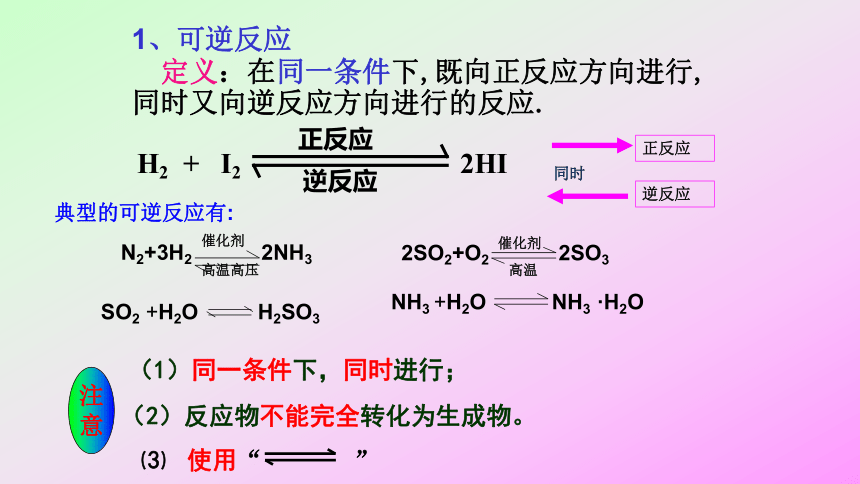
1、可逆反应
定义:在同一条件下,既向正反应方向进行,同时又向逆反应方向进行的反应.
典型的可逆反应有:
N2+3H2
2NH3
催化剂
高温高压
2SO2+O2
2SO3
催化剂
高温
SO2
+H2O
H2SO3
NH3
+H2O
NH3
·H2O
正反应
逆反应
同时
注
意
(1)同一条件下,同时进行;
(2)反应物不能完全转化为生成物。
⑶
使用“
”
可逆反应
思考与交流:
1、水的生成与电解
2、二次电池的放电与充电
3、CO2和H2O在植物体中通过光合作用合成糖与糖在人体内氧化生成CO2和H2O
它们是否属于“可逆反应”?
在一固定容积的密闭容器里,加1molN2和
3mol
H2
(合适催化剂),能发生什么反应?
c(N2)
、c(H2)最大,
c(NH3)
=0
1、开始阶段:
催化剂
N2
+
3
H2
2NH3
高温
瞬间后c(N2)
、c(H2
)变小
,
c(NH3)
变大
3、反应到一定时间后:
c(N2)
、c(H2)、c(NH3)不再改变,
反应表面“停止”,三种物质浓度达到特定值.
2、瞬间过后:
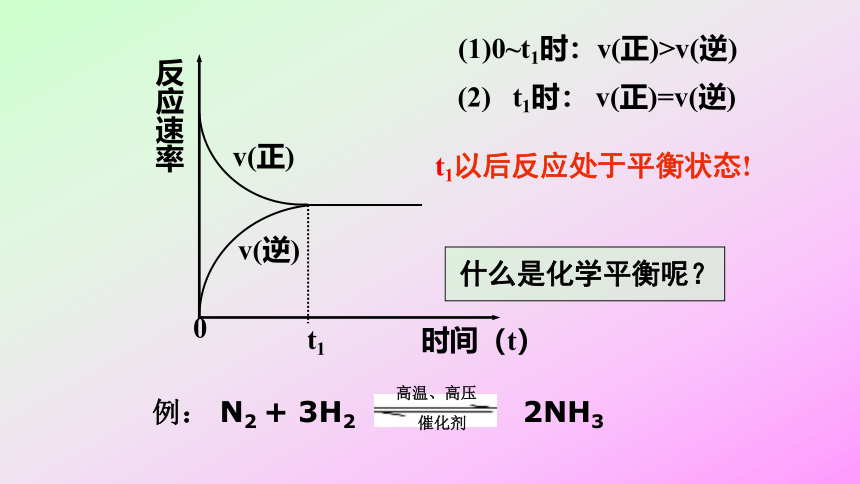
反应速率
v(正)
v(逆)
t1
时间(t)
0
(1)0~t1时:v(正)>v(逆)
(2)
t1时:
v(正)=v(逆)
t1以后反应处于平衡状态!
什么是化学平衡呢?
例:
N2
+
3H2
2NH3
高温、高压
催化剂
2、化学平衡状态
定义:
在一定条件下的可逆反应里,正反应和逆反应的速率相等,反应物和生成物各组分浓度保持不变的状态。
特征:
(1)逆:可逆反应(研究对象)
(2)动:动态平衡
(3)等:
v(正)=
v(逆)
≠0(本质特征-标志)
(4)定:各组分的浓度保持不变。
(5)变:条件改变,平衡被破坏,发生移动。
其中,“等”和“定”判断化学反应是否处于平衡状态的依据。
3、反应达到化学平衡的标志
1)正逆反应速率相等
2)反应物与生成物浓度不再改变
或各组分的含量不再发生变化
(同一物质的生成速率或消耗速率相等)
注意:①体现出正逆两个方向.
②速率符合系数之比.
注意:①浓度相等,不一定平衡.
②浓度符合系数之比不一定平衡.
3)体系的温度、颜色等保持不变。
如何理解V(正)=V(逆)?
例如,一定条件下,可逆反应N2+3H2
2NH3,对该可逆反应,表示正、逆反应速率可以用N2或H2或NH3来表示:
(1)单位时间内,有1molN2消耗,同时有1molN2生成
(2)单位时间内,有3molH2消耗,同时有2molNH3消耗
(3)单位时间内,有1molN2生成,同时有2molNH3生成
以上均表示V(正)=V(逆)(必须有正、逆反应)
练习:1、在一定温度下,
2NO2(g)
N2O4
(g)
(红棕色)
(无色)
的可逆反应中,下列情况属于平衡状态的是:
(
)
A.
N2O4不再分解
B.
v(N2O4)
:
v(NO2)
=
1:2
体系的颜色不再改变
NO2的浓度与N2O4的浓度之比2:1
C
2、对于反应
,下列说法处于化学平衡状态的是:(
)
①V(N2生成)=V(N2消耗),
②N2、H2、NH3的分子数之比为1∶3∶2,
③单位时间内生成2molNH3,同时生成1molN2,
④N2、H2、NH3的物质的量不再发生变化。
A、①④②
B、①②③
C、②③④
D、①③④
D
3、在恒温恒容的密闭容器中,可逆反应:2SO2(g)+O2(g)
2SO3(g)
达到平衡后.下列不是平衡的标志的是(
)
A.混合气体的密度不再发生变化
B.容器中三种物质的质量分数相等
C.密闭容器中的压强不再发生变化
D.气体的总的物质的量不再发生变化
E.混合气体的平均分子量不再发生变化。
AB
思考:下图是建筑物的定向爆破,你从中得到什么启示?
定向爆破显神威!
化学反应条件的控制
在生产和生活中,人们希望促进有
利的化学反应,抑制有害的化学反应,
这就涉及到反应条件的控制。
抑制有害的化学反应
促进有利的化学反应
增大反应速率
提高反应限度
降低反应速率
消除有害物质的产生、
控制副反应的发生
控制化学反应条件的意义
化学反应条件的控制
——如何提高煤的燃烧效率(课本P52)
思考1:煤的状态与煤燃烧的速率有何关系?与煤的充分燃烧有何关系?
煤被研得越细,粉末越小,与空气中O2的接触面积越大,燃烧越充分,反应速率越快。
思考2:空气用量对煤的充分燃烧有什么影响?原因是什么?
空气充足,煤燃烧得充分,产物主要为CO2,放热量大;
空气不足,则煤燃烧不充分,部分生成CO,CO排放到空气中造成污染,且生成CO时,放出的热量大大减小。
思考3:应选择什么样的炉(灶)膛材料?理由是什么?
1、应选择保温隔热且耐热的炉(灶)膛材料。
2、选用保温隔热材料的目的,防止热量散失。
思考4:如何充分利用煤燃烧后的废气中的热量?
可将燃烧后的废气通过热交换装置,供其他方面使用。
思考5:燃料不充分燃烧有何危害?
1、产生热量少,浪费资源。
2、产生污染物,危害人体健康。
1、化学平衡状态定义:
在一定条件下的可逆反应中,当正反应速率和逆反应速率相等,反应混合物中各组分的浓度保持不变的状态。
前提(适用范围):可逆反应
内在本质:v(正)=
v(逆)
≠0
外在标志:反应混合物中各组分
的浓度保持不变
小结、
2、化学平衡状态的特征:
(3)动:动态平衡(v(正)=
v(逆)
≠0)
(2)等:v(正)=
v(逆)
(4)定:反应混合物中各组分的浓度保持 定,各组分的含量保持不变。
(5)变:条件改变,原平衡被破坏,在新
的条件下建立新的平衡。
(1)逆
反应速率
v(正)
v(逆)
t1
时间(t)
0
(1)0~t1:v(正)>v(逆)
(2)t1:v(正)=v(逆)
平衡状态
1)正逆反应速率相等
2)反应物与生成物浓度不再改变
或各组分的含量不再发生变化
3)体系的温度、颜色等保持不变。
3、化学平衡状态的判断:
谢谢大家
作业:
1、复习资料书P54~55中的知识内容
2、完成资料书P56~58的习题
3、没选化学的同学对于P57~58的能力题不做
第二章
化学反应与能量
第三节
化学反应的速率和限度
(第2课时)
CO
2、又发现从炉顶排出没利用的CO浓度很高,但增加了高炉的高度,排出的一氧化碳浓度还是一样,没有降低?不知为什么?
科学史话
1、生产中发现:炼制一定量的生铁,实际投料远高于理论的计算值。为什么?
科学研究表明:很多化学反应在进行时都具有可逆性。
勒夏特列研究发现:
1、C+O2=CO2
2、
3、Fe2O3+3CO==2Fe+3CO2
可逆反应
启示:化学反应是有限度的,有些能进行地较彻底,有些反应是不彻底的,甚至是可逆的。
H2
+
I2
2HI
正反应
逆反应
1、可逆反应
定义:在同一条件下,既向正反应方向进行,同时又向逆反应方向进行的反应.
典型的可逆反应有:
N2+3H2
2NH3
催化剂
高温高压
2SO2+O2
2SO3
催化剂
高温
SO2
+H2O
H2SO3
NH3
+H2O
NH3
·H2O
正反应
逆反应
同时
注
意
(1)同一条件下,同时进行;
(2)反应物不能完全转化为生成物。
⑶
使用“
”
可逆反应
思考与交流:
1、水的生成与电解
2、二次电池的放电与充电
3、CO2和H2O在植物体中通过光合作用合成糖与糖在人体内氧化生成CO2和H2O
它们是否属于“可逆反应”?
在一固定容积的密闭容器里,加1molN2和
3mol
H2
(合适催化剂),能发生什么反应?
c(N2)
、c(H2)最大,
c(NH3)
=0
1、开始阶段:
催化剂
N2
+
3
H2
2NH3
高温
瞬间后c(N2)
、c(H2
)变小
,
c(NH3)
变大
3、反应到一定时间后:
c(N2)
、c(H2)、c(NH3)不再改变,
反应表面“停止”,三种物质浓度达到特定值.
2、瞬间过后:
反应速率
v(正)
v(逆)
t1
时间(t)
0
(1)0~t1时:v(正)>v(逆)
(2)
t1时:
v(正)=v(逆)
t1以后反应处于平衡状态!
什么是化学平衡呢?
例:
N2
+
3H2
2NH3
高温、高压
催化剂
2、化学平衡状态
定义:
在一定条件下的可逆反应里,正反应和逆反应的速率相等,反应物和生成物各组分浓度保持不变的状态。
特征:
(1)逆:可逆反应(研究对象)
(2)动:动态平衡
(3)等:
v(正)=
v(逆)
≠0(本质特征-标志)
(4)定:各组分的浓度保持不变。
(5)变:条件改变,平衡被破坏,发生移动。
其中,“等”和“定”判断化学反应是否处于平衡状态的依据。
3、反应达到化学平衡的标志
1)正逆反应速率相等
2)反应物与生成物浓度不再改变
或各组分的含量不再发生变化
(同一物质的生成速率或消耗速率相等)
注意:①体现出正逆两个方向.
②速率符合系数之比.
注意:①浓度相等,不一定平衡.
②浓度符合系数之比不一定平衡.
3)体系的温度、颜色等保持不变。
如何理解V(正)=V(逆)?
例如,一定条件下,可逆反应N2+3H2
2NH3,对该可逆反应,表示正、逆反应速率可以用N2或H2或NH3来表示:
(1)单位时间内,有1molN2消耗,同时有1molN2生成
(2)单位时间内,有3molH2消耗,同时有2molNH3消耗
(3)单位时间内,有1molN2生成,同时有2molNH3生成
以上均表示V(正)=V(逆)(必须有正、逆反应)
练习:1、在一定温度下,
2NO2(g)
N2O4
(g)
(红棕色)
(无色)
的可逆反应中,下列情况属于平衡状态的是:
(
)
A.
N2O4不再分解
B.
v(N2O4)
:
v(NO2)
=
1:2
体系的颜色不再改变
NO2的浓度与N2O4的浓度之比2:1
C
2、对于反应
,下列说法处于化学平衡状态的是:(
)
①V(N2生成)=V(N2消耗),
②N2、H2、NH3的分子数之比为1∶3∶2,
③单位时间内生成2molNH3,同时生成1molN2,
④N2、H2、NH3的物质的量不再发生变化。
A、①④②
B、①②③
C、②③④
D、①③④
D
3、在恒温恒容的密闭容器中,可逆反应:2SO2(g)+O2(g)
2SO3(g)
达到平衡后.下列不是平衡的标志的是(
)
A.混合气体的密度不再发生变化
B.容器中三种物质的质量分数相等
C.密闭容器中的压强不再发生变化
D.气体的总的物质的量不再发生变化
E.混合气体的平均分子量不再发生变化。
AB
思考:下图是建筑物的定向爆破,你从中得到什么启示?
定向爆破显神威!
化学反应条件的控制
在生产和生活中,人们希望促进有
利的化学反应,抑制有害的化学反应,
这就涉及到反应条件的控制。
抑制有害的化学反应
促进有利的化学反应
增大反应速率
提高反应限度
降低反应速率
消除有害物质的产生、
控制副反应的发生
控制化学反应条件的意义
化学反应条件的控制
——如何提高煤的燃烧效率(课本P52)
思考1:煤的状态与煤燃烧的速率有何关系?与煤的充分燃烧有何关系?
煤被研得越细,粉末越小,与空气中O2的接触面积越大,燃烧越充分,反应速率越快。
思考2:空气用量对煤的充分燃烧有什么影响?原因是什么?
空气充足,煤燃烧得充分,产物主要为CO2,放热量大;
空气不足,则煤燃烧不充分,部分生成CO,CO排放到空气中造成污染,且生成CO时,放出的热量大大减小。
思考3:应选择什么样的炉(灶)膛材料?理由是什么?
1、应选择保温隔热且耐热的炉(灶)膛材料。
2、选用保温隔热材料的目的,防止热量散失。
思考4:如何充分利用煤燃烧后的废气中的热量?
可将燃烧后的废气通过热交换装置,供其他方面使用。
思考5:燃料不充分燃烧有何危害?
1、产生热量少,浪费资源。
2、产生污染物,危害人体健康。
1、化学平衡状态定义:
在一定条件下的可逆反应中,当正反应速率和逆反应速率相等,反应混合物中各组分的浓度保持不变的状态。
前提(适用范围):可逆反应
内在本质:v(正)=
v(逆)
≠0
外在标志:反应混合物中各组分
的浓度保持不变
小结、
2、化学平衡状态的特征:
(3)动:动态平衡(v(正)=
v(逆)
≠0)
(2)等:v(正)=
v(逆)
(4)定:反应混合物中各组分的浓度保持 定,各组分的含量保持不变。
(5)变:条件改变,原平衡被破坏,在新
的条件下建立新的平衡。
(1)逆
反应速率
v(正)
v(逆)
t1
时间(t)
0
(1)0~t1:v(正)>v(逆)
(2)t1:v(正)=v(逆)
平衡状态
1)正逆反应速率相等
2)反应物与生成物浓度不再改变
或各组分的含量不再发生变化
3)体系的温度、颜色等保持不变。
3、化学平衡状态的判断:
谢谢大家
作业:
1、复习资料书P54~55中的知识内容
2、完成资料书P56~58的习题
3、没选化学的同学对于P57~58的能力题不做
