2.4 酸碱中和反应 课件 (共18张PPT)
文档属性
| 名称 | 2.4 酸碱中和反应 课件 (共18张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 351.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-06-01 16:20:24 | ||
图片预览





文档简介
(共18张PPT)
第二单元
鲁教版
化学(初中)
(九年级)
酸碱中和反应
第四节
一
课堂导入
在以前的学习中,我们都学习了酸的化学性质都有哪些?
①酸可以使紫色石蕊试液变为红色;
②酸可以与活泼金属发生置换反应,生成盐和氢气;
③酸可以与金属氧化物相互交换成分发生复分解反应,生成盐和;
④酸可以与部分盐相互交换成分发生复分解反应,生成新的盐和新的酸。
在以前的学习中,我们都学习了碱的化学性质都有哪些?
①碱溶液可以是紫色石蕊试液变为蓝色,使无色酚酞变为红色;
②碱溶液可以与部分非金属氧化物反应生成盐和水;
③碱溶液可以与部分可溶性的盐相互交换成分发生复分解反应,生成新的碱和新的盐。
请思考:酸和碱之间可以发生反应吗?
二
师生互动,共学新知
实验探究2---5
如图所示,用滴管向盛约有2mL、溶质质量分数为0.4g的氢氧化钠溶液的
试管中滴加0.4%的盐酸,观察现象。
试管中没有明显现象,无法判断盐酸与氢氧化钠溶液是否发生反应。
1、用pH试纸分别测定水、0.4%的氢氧化钠溶液和0.4%的盐酸的pH,将测定结果记录在下表中。
2、分别量取2mL水和2mL0.4%的氢氧化钠溶液与2支试管中,然后分别加入2mL
04%的盐酸,充分振荡后,测定所得溶液的pH,将测定结果记录在下表中。
水
0.4%的氢氧化钠溶液
0.4%的盐酸的pH
加酸前的pH
加酸后的pH
7
5
13
7
3
二
师生互动,共学新知
扩展实验:
如图所示,向盛有氢氧化钠溶液的烧杯中滴加几滴无色酚酞试剂,发现烧杯内
溶液的颜色会变为红色。在逐滴加稀盐酸,观察并记录现象
烧杯内溶液的颜色
加入稀盐酸前
加入稀盐酸后
红色
无色
通过实验探究2---5中pH的变化、扩展实验中的颜色变化,可以发现:
稀盐酸与氢氧化钠可以发生反应。
二
师生互动,共学新知
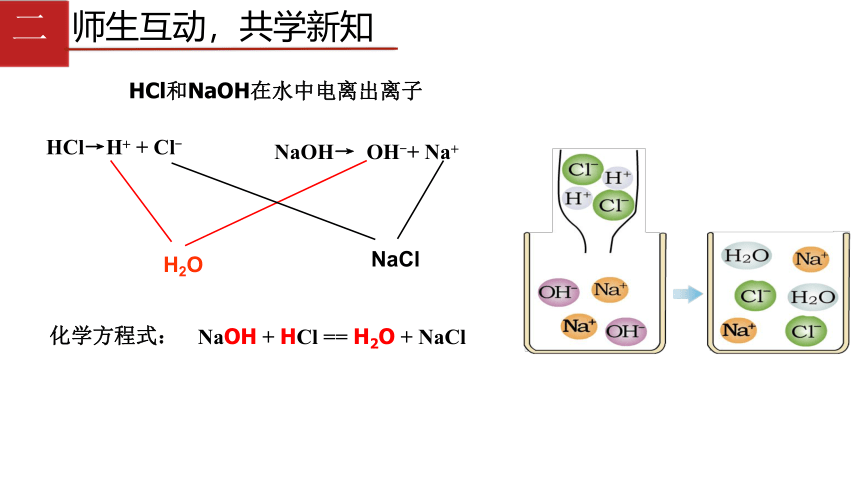
HCl和NaOH在水中电离出离子
HCl→H+
+
Cl-
NaOH→
OH-+
Na+
H2O
NaCl
化学方程式:
NaOH
+
HCl
==
H2O
+
NaCl
二
师生互动,共学新知
活动天地2---4
寻找酸和碱反应的规律
完成下列化学方程式:
盐酸与氢氧化钾:
HCl
+
KOH=KCl
+
H2O
盐酸与氢氧化钡:
2HCl
+
Ba(OH)2=BaCl2
+
2H2O
硫酸与氢氧化钠:
H2SO4
+
2NaOH=Na2SO4
+
2H2O
硫酸与氢氧化钡:
H2SO4
+
Ba(OH)2=BaSO4
↓+
2H2O
二
师生互动,共学新知
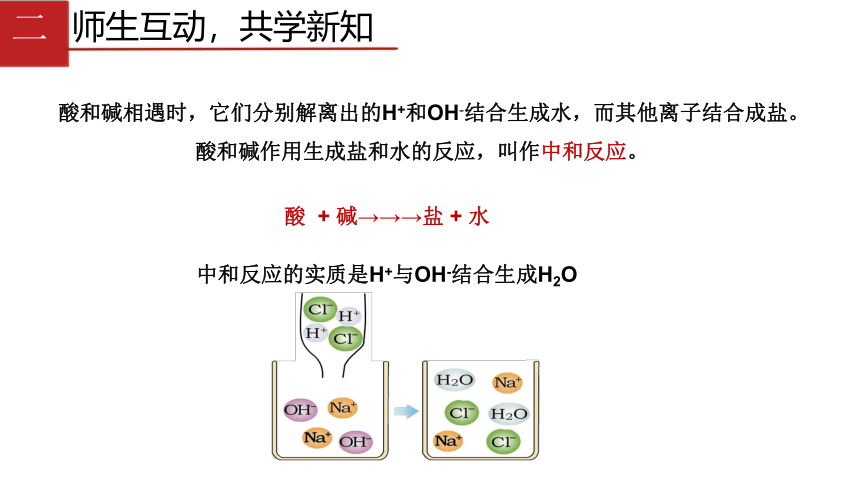
酸和碱相遇时,它们分别解离出的H+和OH-结合生成水,而其他离子结合成盐。
酸和碱作用生成盐和水的反应,叫作中和反应。
酸
+
碱→→→盐
+
水
中和反应的实质是H+与OH-结合生成H2O
二
师生互动,共学新知
中和反应
定义:酸
+
碱
=
盐
+
水
实质:H+
+
OH-
=
H2O
基本反应类型:复分解反应
能量变化:属于放热反应
二
师生互动,共学新知
活动天地2---5
酸碱中和反应过程中溶液的pH的变化(向NaOH溶液中滴入稀盐酸)
A点时,还没有滴加稀盐酸,
溶液中的溶质为NaOH;
B点时,滴入的稀盐酸过少,
溶液中的溶质为NaOH、NaCl;
C点时,稀盐酸与NaOH恰好完全反应,
溶液中的溶质为NaCl;
D点时,滴入稀盐酸过量,
溶液中的溶质为NaCl、HCl。
二
师生互动,共学新知
中和反应的应用
1、应用于医药卫生
人的胃液呈酸性,当胃液的pH为0.9--1.5时,有助于消化食物,胃液过多会导致
胃部不适或疼痛,这时应该服用碱性药物,使药物与胃酸发生中和反应,以降低
胃液中的胃酸的含量,同时生成无毒的中性物质
服用含有Al(OH)3的药物可以治疗胃酸过多:
Al(OH)3
+
3HCl
=AlCl3
+
3H2O
二
师生互动,共学新知
中和反应的应用
2、改变土壤的酸碱性
根据土壤的酸碱性和植物生长的需要,可以利用中和反应原理,向土壤
中加入酸性或碱性物质,将土壤的pH控制在最适宜作物生长的范围之内。
酸性土壤
熟石灰
Ca(OH)2
中性土壤
二
师生互动,共学新知
中和反应的应用
3、处理工业废水
工业生产过程中产生的污水,如果酸性或碱性超出环保部门的规定,必要需
进行处理,达标后才能排放。例如,当污水含酸量超标时,可以利用熟石灰
进行中和反应处理。
处理硫酸厂生产中形成的含硫酸的污水的方法:
向污水中加入适量的熟石灰进行中和处理
H2SO4+?Ca(OH)2?=?CaSO4?+?2
H2O
二
师生互动,共学新知
4、调节溶液的酸碱性
中和反应的应用
在科学实验中,经常需要将溶液的pH控制在
一定的范围内,如果溶液的酸碱性太强或者
太弱,都可以利用适当的碱或者酸根据中和
反应的原理来调节溶液的pH。
三
课堂检测
1、向盛有NaOH溶液的烧杯中滴入几滴酚酞试液,试液
变为______色,此时溶液的pH______________,向此溶
液中逐渐滴加稀盐酸,并不断振荡,直至试液刚好无色
时,溶液呈______________性,pH______________;继
续滴入稀HCl,溶液呈______________色,pH________,
在整个实验过程中,溶液发生了____________反应,
化学方程式为_______________________
_____。
红
>7
中
=7
无
<7
中和反应
HCl
+
NaOH
===
NaCl
+
H2O
三
课堂检测
2、在用稀盐酸和氢氧化钠溶液进行中和反应实验时,反应过程中溶液的酸碱度变化如图所示
?????????????????
(1)该反应的化学方程式为:???????????????????????????。
(2)该实验操作是将
?
????????????滴加到另一种溶液中。
(3)当加入溶液的质量为a
g时,所得溶液中的溶
质为(写化学式)??????????????????。
(4)当加入溶液的质量为b
g时,向所得溶液中滴加酚酞溶液,溶液呈????
色。
NaOH+HCl=NaCl+H2O
氢氧化钠溶液
HCl、NaCl?
红
三
课堂检测
3.下列反应,属于中和反应的是(
)
A
Zn
+2HCl
==
ZnCl2
+
H2↑
B
CuO
+
2HCl
==
CuCl2
+
H2O
C
Cu(OH)2
+
H2SO4
==
CuSO4
+
2H2O
D
AgNO3
+
HCl
==
AgCl
↓
+
HNO3
C
4、下列各组物质通常借助指示剂才能证明是否反应的是(
)
A、氢氧化铜和稀盐酸
B、石灰石和稀盐酸
C、氢氧化钙与碳酸钠反应
D、烧碱溶液和稀硫酸
D
三
课堂检测
5、实验室有部分变质的氢氧化钠固体。现取该固体样品10g,加入100g稀盐酸中,恰好完全反应,反应后溶液的质量为107.8g。求:
⑴生成气体的质量。⑵该样品中氢氧化钠的质量。
解:(1)生成CO2的质量为10g+100g-107.8g=2.2g
(2)设样品中有碳酸钠的质量为x
Na2CO3+2HCl==2NaCl+H2O+CO2↑
106
44
x
2.2g
106
x
44
——
=
——
2.2g
得:X=5.3g。
氢氧化钠的质量为10g—5.3g=4.7g
答:⑴生成气体的质量为2.2g。⑵该样品中氢氧化钠的质量为4.7g
四
课堂小结
1、酸碱中和反应
2、酸碱中和反应的实质
3、酸碱中和反应的应用
第二单元
鲁教版
化学(初中)
(九年级)
酸碱中和反应
第四节
一
课堂导入
在以前的学习中,我们都学习了酸的化学性质都有哪些?
①酸可以使紫色石蕊试液变为红色;
②酸可以与活泼金属发生置换反应,生成盐和氢气;
③酸可以与金属氧化物相互交换成分发生复分解反应,生成盐和;
④酸可以与部分盐相互交换成分发生复分解反应,生成新的盐和新的酸。
在以前的学习中,我们都学习了碱的化学性质都有哪些?
①碱溶液可以是紫色石蕊试液变为蓝色,使无色酚酞变为红色;
②碱溶液可以与部分非金属氧化物反应生成盐和水;
③碱溶液可以与部分可溶性的盐相互交换成分发生复分解反应,生成新的碱和新的盐。
请思考:酸和碱之间可以发生反应吗?
二
师生互动,共学新知
实验探究2---5
如图所示,用滴管向盛约有2mL、溶质质量分数为0.4g的氢氧化钠溶液的
试管中滴加0.4%的盐酸,观察现象。
试管中没有明显现象,无法判断盐酸与氢氧化钠溶液是否发生反应。
1、用pH试纸分别测定水、0.4%的氢氧化钠溶液和0.4%的盐酸的pH,将测定结果记录在下表中。
2、分别量取2mL水和2mL0.4%的氢氧化钠溶液与2支试管中,然后分别加入2mL
04%的盐酸,充分振荡后,测定所得溶液的pH,将测定结果记录在下表中。
水
0.4%的氢氧化钠溶液
0.4%的盐酸的pH
加酸前的pH
加酸后的pH
7
5
13
7
3
二
师生互动,共学新知
扩展实验:
如图所示,向盛有氢氧化钠溶液的烧杯中滴加几滴无色酚酞试剂,发现烧杯内
溶液的颜色会变为红色。在逐滴加稀盐酸,观察并记录现象
烧杯内溶液的颜色
加入稀盐酸前
加入稀盐酸后
红色
无色
通过实验探究2---5中pH的变化、扩展实验中的颜色变化,可以发现:
稀盐酸与氢氧化钠可以发生反应。
二
师生互动,共学新知
HCl和NaOH在水中电离出离子
HCl→H+
+
Cl-
NaOH→
OH-+
Na+
H2O
NaCl
化学方程式:
NaOH
+
HCl
==
H2O
+
NaCl
二
师生互动,共学新知
活动天地2---4
寻找酸和碱反应的规律
完成下列化学方程式:
盐酸与氢氧化钾:
HCl
+
KOH=KCl
+
H2O
盐酸与氢氧化钡:
2HCl
+
Ba(OH)2=BaCl2
+
2H2O
硫酸与氢氧化钠:
H2SO4
+
2NaOH=Na2SO4
+
2H2O
硫酸与氢氧化钡:
H2SO4
+
Ba(OH)2=BaSO4
↓+
2H2O
二
师生互动,共学新知
酸和碱相遇时,它们分别解离出的H+和OH-结合生成水,而其他离子结合成盐。
酸和碱作用生成盐和水的反应,叫作中和反应。
酸
+
碱→→→盐
+
水
中和反应的实质是H+与OH-结合生成H2O
二
师生互动,共学新知
中和反应
定义:酸
+
碱
=
盐
+
水
实质:H+
+
OH-
=
H2O
基本反应类型:复分解反应
能量变化:属于放热反应
二
师生互动,共学新知
活动天地2---5
酸碱中和反应过程中溶液的pH的变化(向NaOH溶液中滴入稀盐酸)
A点时,还没有滴加稀盐酸,
溶液中的溶质为NaOH;
B点时,滴入的稀盐酸过少,
溶液中的溶质为NaOH、NaCl;
C点时,稀盐酸与NaOH恰好完全反应,
溶液中的溶质为NaCl;
D点时,滴入稀盐酸过量,
溶液中的溶质为NaCl、HCl。
二
师生互动,共学新知
中和反应的应用
1、应用于医药卫生
人的胃液呈酸性,当胃液的pH为0.9--1.5时,有助于消化食物,胃液过多会导致
胃部不适或疼痛,这时应该服用碱性药物,使药物与胃酸发生中和反应,以降低
胃液中的胃酸的含量,同时生成无毒的中性物质
服用含有Al(OH)3的药物可以治疗胃酸过多:
Al(OH)3
+
3HCl
=AlCl3
+
3H2O
二
师生互动,共学新知
中和反应的应用
2、改变土壤的酸碱性
根据土壤的酸碱性和植物生长的需要,可以利用中和反应原理,向土壤
中加入酸性或碱性物质,将土壤的pH控制在最适宜作物生长的范围之内。
酸性土壤
熟石灰
Ca(OH)2
中性土壤
二
师生互动,共学新知
中和反应的应用
3、处理工业废水
工业生产过程中产生的污水,如果酸性或碱性超出环保部门的规定,必要需
进行处理,达标后才能排放。例如,当污水含酸量超标时,可以利用熟石灰
进行中和反应处理。
处理硫酸厂生产中形成的含硫酸的污水的方法:
向污水中加入适量的熟石灰进行中和处理
H2SO4+?Ca(OH)2?=?CaSO4?+?2
H2O
二
师生互动,共学新知
4、调节溶液的酸碱性
中和反应的应用
在科学实验中,经常需要将溶液的pH控制在
一定的范围内,如果溶液的酸碱性太强或者
太弱,都可以利用适当的碱或者酸根据中和
反应的原理来调节溶液的pH。
三
课堂检测
1、向盛有NaOH溶液的烧杯中滴入几滴酚酞试液,试液
变为______色,此时溶液的pH______________,向此溶
液中逐渐滴加稀盐酸,并不断振荡,直至试液刚好无色
时,溶液呈______________性,pH______________;继
续滴入稀HCl,溶液呈______________色,pH________,
在整个实验过程中,溶液发生了____________反应,
化学方程式为_______________________
_____。
红
>7
中
=7
无
<7
中和反应
HCl
+
NaOH
===
NaCl
+
H2O
三
课堂检测
2、在用稀盐酸和氢氧化钠溶液进行中和反应实验时,反应过程中溶液的酸碱度变化如图所示
?????????????????
(1)该反应的化学方程式为:???????????????????????????。
(2)该实验操作是将
?
????????????滴加到另一种溶液中。
(3)当加入溶液的质量为a
g时,所得溶液中的溶
质为(写化学式)??????????????????。
(4)当加入溶液的质量为b
g时,向所得溶液中滴加酚酞溶液,溶液呈????
色。
NaOH+HCl=NaCl+H2O
氢氧化钠溶液
HCl、NaCl?
红
三
课堂检测
3.下列反应,属于中和反应的是(
)
A
Zn
+2HCl
==
ZnCl2
+
H2↑
B
CuO
+
2HCl
==
CuCl2
+
H2O
C
Cu(OH)2
+
H2SO4
==
CuSO4
+
2H2O
D
AgNO3
+
HCl
==
AgCl
↓
+
HNO3
C
4、下列各组物质通常借助指示剂才能证明是否反应的是(
)
A、氢氧化铜和稀盐酸
B、石灰石和稀盐酸
C、氢氧化钙与碳酸钠反应
D、烧碱溶液和稀硫酸
D
三
课堂检测
5、实验室有部分变质的氢氧化钠固体。现取该固体样品10g,加入100g稀盐酸中,恰好完全反应,反应后溶液的质量为107.8g。求:
⑴生成气体的质量。⑵该样品中氢氧化钠的质量。
解:(1)生成CO2的质量为10g+100g-107.8g=2.2g
(2)设样品中有碳酸钠的质量为x
Na2CO3+2HCl==2NaCl+H2O+CO2↑
106
44
x
2.2g
106
x
44
——
=
——
2.2g
得:X=5.3g。
氢氧化钠的质量为10g—5.3g=4.7g
答:⑴生成气体的质量为2.2g。⑵该样品中氢氧化钠的质量为4.7g
四
课堂小结
1、酸碱中和反应
2、酸碱中和反应的实质
3、酸碱中和反应的应用
同课章节目录
- 第一单元 溶液
- 1 溶液的形成
- 2 溶液组成的定量表示
- 3物质的溶解性
- 到实验室去:配制一定溶质质量分数的溶液
- 第二单元 常见的酸和碱
- 1 酸及其性质
- 2 碱及其性质
- 3 溶液的酸碱性
- 4 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 到图书馆去:分子变成离子
- 第三单元 海水中的化学
- 1 海洋化学资源
- 2 海水“晒盐”
- 3 海水“制碱”
- 到实验室去:粗盐中难溶性杂质的去除
- 第四单元 金属
- 1 常见的金属材料
- 2 金属的化学性质
- 3 钢铁的锈蚀与防护
- 到实验室去:探究金属的性质
- 第五单元 化学与健康
- 1 食物中的有机物
- 2 化学元素与人体健康
- 3 远离有毒物质
- 第六单元 化学与社会发展
- 1 化学与能源开发
- 2 化学与材料研制
- 3 化学与农业生产
- 4 化学与环境保护
