九年级化学2.1酸及其性质课件 (共34张PPT)
文档属性
| 名称 | 九年级化学2.1酸及其性质课件 (共34张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 620.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-06-01 17:01:17 | ||
图片预览








文档简介
(共34张PPT)
课题名称:酸及其性质(第2课时)
执教人:
知
识
回
顾
3.浓盐酸和浓硫酸的物理性质
1.酸的概念
2.稀释浓硫酸的方法
溶于水后,解离出的阳离子全部是氢离子(H+)的化合物。
酸入水
第一节
酸及其性质
第二单元
常见的酸和碱
(第二课时)
1、通过实验探究稀盐酸的化学性质;
2、熟练掌握有关化学方程式的书写。
学习目标
1、盐酸能与哪些物质发生化学反应?
2、浓盐酸和浓硫酸的物理性质?
3、怎样正确稀释浓硫酸?
问题清单
探究三:稀盐酸的化学性质
盐酸与哪些物质发生化学反应
1、在2支试管中分别加入少量稀盐酸,然后分别滴入几滴紫色石蕊试液和无色酚酞试液,观察并记录现象。
操作
滴入石蕊试液
滴入酚酞试液
现象
紫色石蕊变红
无色酚酞不变色
实验结论:
稀盐酸能使紫色石蕊试液变红
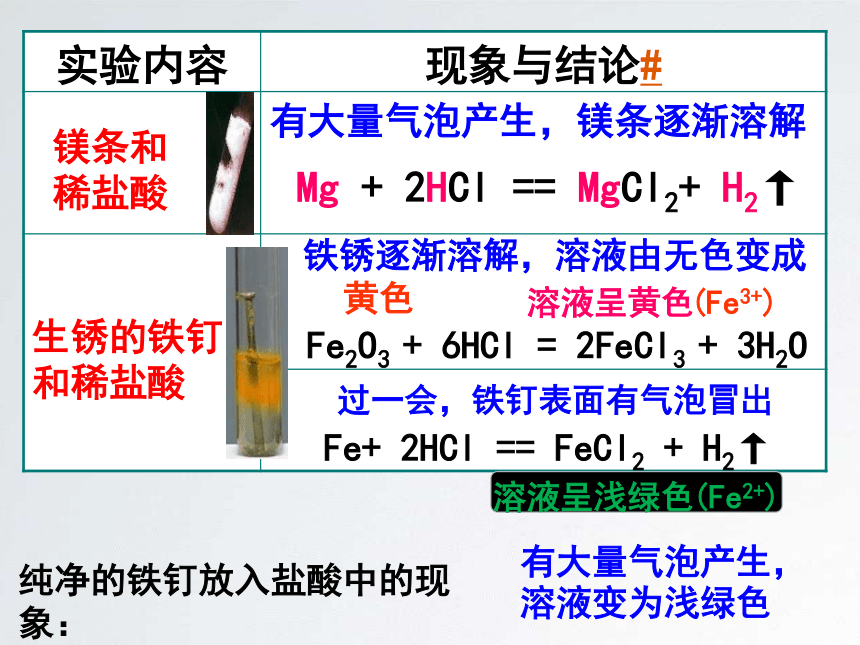
实验内容
现象与结论#
有大量气泡产生,镁条逐渐溶解
铁锈逐渐溶解,溶液由无色变成
黄色
Mg
+
2HCl
==
MgCl2+
H2↑
Fe2O3
+
6HCl
=
2FeCl3
+
3H2O
过一会,铁钉表面有气泡冒出
Fe+
2HCl
==
FeCl2
+
H2↑
(Fe3+)
纯净的铁钉放入盐酸中的现象:
镁条和
稀盐酸
生锈的铁钉和稀盐酸
溶液呈黄色
(Fe2+)
溶液呈浅绿色
有大量气泡产生,
溶液变为浅绿色
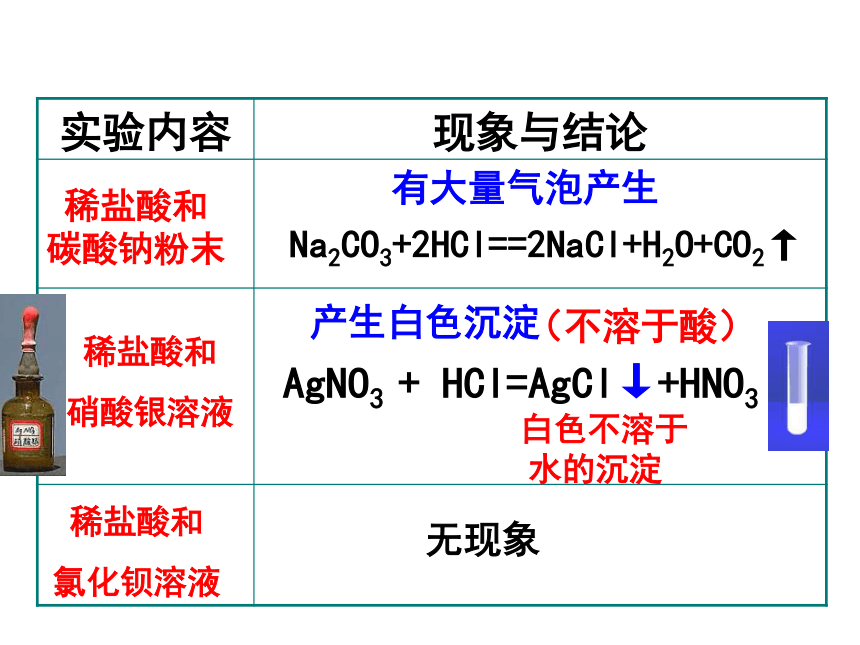
实验内容
现象与结论
产生白色沉淀
无现象
有大量气泡产生
Na2CO3+2HCl==2NaCl+H2O+CO2↑
AgNO3
+
HCl=AgCl↓+HNO3
稀盐酸和
碳酸钠粉末
稀盐酸和
硝酸银溶液
稀盐酸和
氯化钡溶液
(不溶于酸)
白色不溶于
水的沉淀
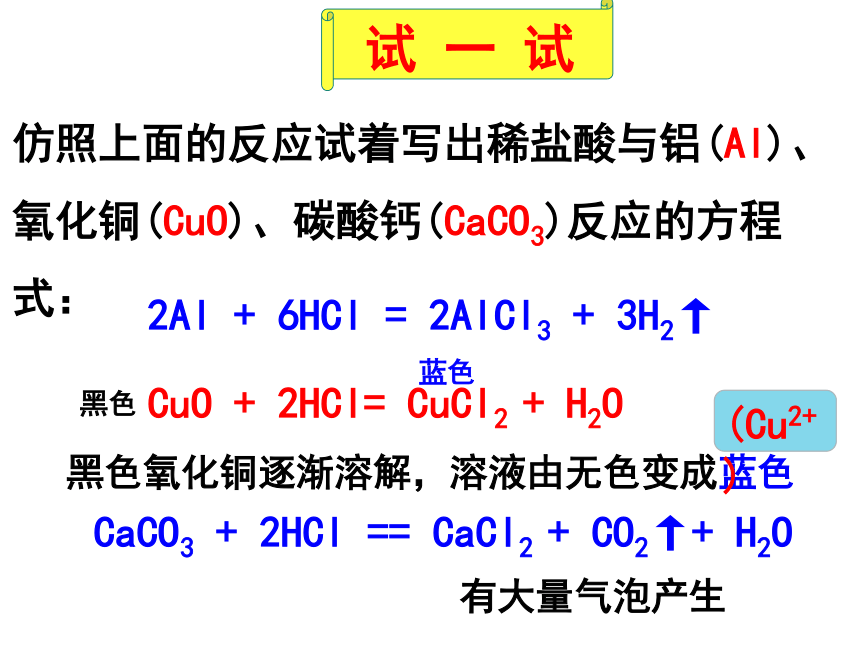
2Al
+
6HCl
=
2AlCl3
+
3H2↑
CuO
+
2HCl=
CuCl2
+
H2O
黑色氧化铜逐渐溶解,溶液由无色变成蓝色
CaCO3
+
2HCl
==
CaCl2
+
CO2↑+
H2O
仿照上面的反应试着写出稀盐酸与铝(Al)、氧化铜(CuO)、碳酸钙(CaCO3)反应的方程式:
有大量气泡产生
试
一
试
(Cu2+)
黑色
蓝色
稀盐酸的化学性质
(2)稀盐酸与金属反应
Na2CO3+
2HCl
=
2NaCl
+
H2O
+
CO2↑
Mg
+
2HCl
=
MgCl2
+
H2↑
Fe
+
2HCl
=
FeCl2
+
H2↑
Fe2O3+
6HCl
==
2FeCl3
+3H2O
(3)稀盐酸与金属氧化物反应
(4)稀盐酸与碳酸钠、碳酸钙等类似化合物反应
氯化亚铁
氯化铁
(1)稀盐酸与酸碱
指示剂反应
+2
+3
使紫色石蕊试液变红,
使无色酚酞试液不变色
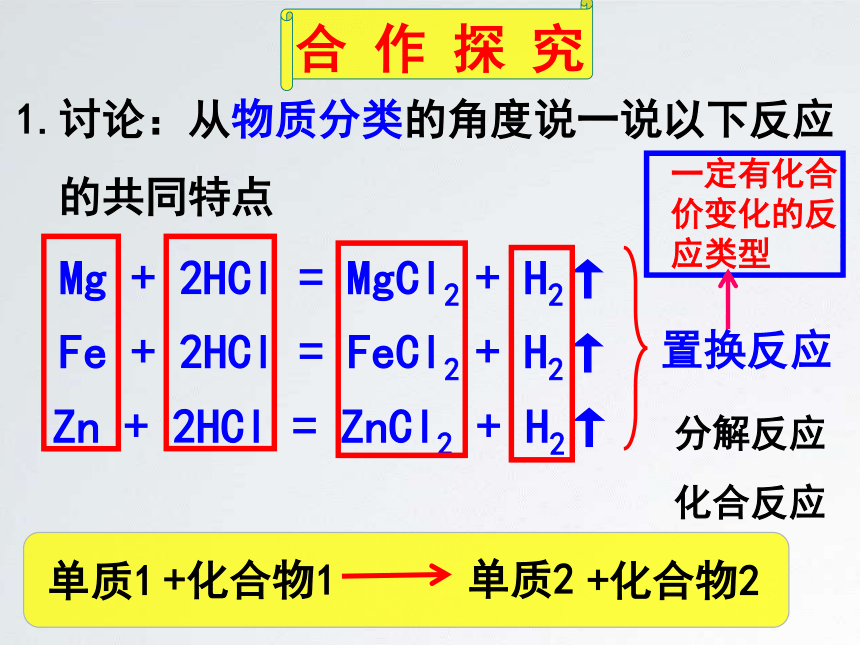
Mg
+
2HCl
=
MgCl2
+
H2↑
Fe
+
2HCl
=
FeCl2
+
H2↑
Zn
+
2HCl
=
ZnCl2
+
H2↑
置换反应
1.讨论:从物质分类的角度说一说以下反应
的共同特点
分解反应
化合反应
合
作
探
究
一定有化合价变化的反应类型
单质1
+化合物1
单质2
+化合物2
Fe2O3
+
6HCl
=
2FeCl3
+
3H2O
Na2CO3+2HCl=
2NaCl+H2O+CO2↑
HCl
+
AgNO3
=
AgCl↓
+
HNO3
CaCO3
+
2HCl
=
CaCl2
+
H2O
+
CO2↑
2.从物质分类角度说一说以下反应物和生成物的共同
点?
从物质组成的角度分析上述反应的生成物是怎样形成的?
反应物和生成物都是两种化合物
反应物交换成分后变成生成物
双交换
价不变
合
作
探
究
两种化合物
交换
成分
两种新化合物
复分解反应:
H2CO3
Fe2O3
+
6HCl
=
2FeCl3
+
3H2O
Na2CO3+2HCl=
2NaCl+H2O+CO2↑
HCl+
AgNO3
=
AgCl↓+
HNO3
盐:
CaCO3+2HCl
=
CaCl2+
H2O
+
CO2↑
CuO
+
2HCl
=
CuCl2
+
H2O
金属离子
+
酸根离子
合
作
探
究
从物质组成的角度分析以下方框内的物质有什么共同点?
由金属阳离子
和酸根阴离子构成的的化合物。
盐
NaCl
CaCO3
CuSO4
NH4Cl
NaHCO3
Cu2(OH)2CO3
MgCl2
NH4+——金属阳离子
NH4Cl
NH4NO3
(铵根离子)
碱式碳酸铜
深入认识物质分类
物质
纯净物
混合物
单质
化合物
金属单质
非金属单质
氧化物
酸
碱
盐
溶液
空气
金属氧化物
非金属氧化物
不同的酸溶液具有的共同点是什么?
酸溶液中都含有氢离子
酸溶液具有相似的化学性质
请试着写出硫酸与镁、生锈的铁钉、碳酸钠反应的方程式
思
考
Mg
+
H2SO4
=
MgSO4
+
H2↑
Fe2O3
+
3H2SO4
=
Fe2(SO4)3
+
3H2O
Na2CO3
+
H2SO4
=
Na2SO4
+
H2O
+
CO2↑
BaCl2
稀硫酸的化学性质
白色沉淀
Fe
CuO
Zn
+
H2SO4
=
FeSO4
+
H2↑
+
H2SO4
=
ZnSO4
+
H2↑
+
H2SO4
=
CuSO4
+
H2O
+
H2SO4
=
BaSO4↓+
2HCl
置换反应
复分解反应
(不溶于酸)
+2
+3
酸溶液能使紫色石蕊试液变红色;无色酚酞试液不变色
Mg
+
H2SO4
=
MgSO4
+
H2↑
Fe2O3
+
3H2SO4
=
Fe2(SO4)3
+
3H2O
Na2CO3
+
H2SO4
=
Na2SO4
+
H2O
+
CO2↑
BaCl2
稀硫酸的化学性质
白色沉淀
Fe
CuO
Zn
+
H2SO4
=
FeSO4
+
H2↑
+
H2SO4
=
ZnSO4
+
H2↑
+
H2SO4
=
CuSO4
+
H2O
+
H2SO4
=
BaSO4↓+
2HCl
置换反应
复分解反应
(不溶于酸)
+3
1、酸与指示剂作用
2、酸+某些金属→
Fe+2HCl=FeCl2+H2↑
3、酸+某些金属氧化物→
Fe2O3+6HCl=2FeCl3+3H2O
4、酸+部分盐→
盐+氢气
盐+水
新盐+新酸
酸溶液能使紫色石蕊试液变红色;无色酚酞试液不变色
Fe
+
H2SO4
=
FeSO4
+
H2↑
Fe2O3
+
3H2SO4
=
Fe2(SO4)3
+
3H2O
AgNO3
+
HCl
=
AgCl↓+
HNO3
Na2CO3
+
2HCl
=
2NaCl
+
H2O
+
CO2↑
BaCl2
+
H2SO4
=
BaSO4↓+
2HCl
Na2CO3
+
H2SO4
=
Na2SO4
+
H2O
+
CO2↑
酸的通性
置换反应
复分解反应
BaCl2
+
H2SO4
=
BaSO4↓+
2HCl
不同的酸溶液含有的酸根离子不同,
所以它们的化学性质不完全相同。
盐酸和硫酸的化学性质是否完全相同?为什么?
BaCl2溶液和盐酸HCl不反应
物质的组成或结构决定物质的性质
不完全相同
思
考
酸的应用
浓硫酸
农药
炸药
纺织
冶金
染料
浓盐酸:制药
除锈剂
浓硝酸:化肥、炸药、染料、医药、
橡胶等
2.置换反应和复分解反应
我
总
结
1.盐酸的化学性质
4.酸的用途
3.酸的通性
拓展探究
写出以下反应的方程式,指明反应类型并分析反应前后各元素的化合价是否发生了变化?
氢气燃烧
二氧化碳溶于水
碳酸分解
过氧化氢制取氧气
镁和盐酸反应
铁和盐酸反应
硝酸银和盐酸反应
氧化铁与盐酸反应
2H2
+O2
=
2H2O
点燃
2H2O2
MnO2
2H2O
+
O2↑
H2CO3=H2O+CO2↑
H2O+CO2=H2CO3
Mg+2HCl=
MgCl2+H2↑
Fe+
2HCl=
FeCl2
+H2↑
HCl+AgNO3
=
AgCl↓+HNO3
Fe2O3+6HCl
=
2FeCl3
+3H2O
一定有化合价变化的反应类型是
,一定不变的是
,有可能变的是
。
置换
复分解
化合、分解
化合反应
分解反应
置换反应
复分解反应
△
1、稀释浓硫酸时,一定要把
沿器壁慢慢注入
里,并不断搅拌。
浓硫酸
水
A
课堂检测
3、下列物质能和盐酸反应生成浅绿色溶液的是(
)
A、
Fe
B、
Fe2O3
C、
Mg
D、
CaCO3
A
2、下列物质
暴露在空气中,质量会增加的是(
)
A、
浓硫酸
B、
酒精
C、
浓盐酸
4、下列说法错误的是(
)
A、浓盐酸敞口放置一段时间后,溶液的质量会减少,溶质的质量分数增大
B、浓盐酸在空气中会冒白烟
C、浓硫酸敞口一段时间后,溶液的质量会增加,溶质的质量分数变小
D、浓硫酸溶于水时会放出大量的热
课堂检测
AB
课堂检测
5、
现有失去标签的浓盐酸、浓硫酸各一瓶,请用三种不同方法进行区分。
1、打开瓶塞观察现象。有白雾生成的是浓盐酸,无
明显现象的是浓硫酸。
2、闻气味。有刺激性气味的是浓盐酸,另一瓶是浓
硫酸。
3、用玻璃棒分别蘸取少量两种液体,在白纸上写字。
无明显变化的是浓盐酸,明显变黄变黑的是浓硫酸。
脱水性
铁锈的主要成分是
它的颜色是
,将一枚生锈的铁钉放入足量的盐酸中,首先观察到的现象是
,
。过一段时间,还能观察到的现象是
,
请写出有关反应的化学方程式:
氧化铁
红色
铁锈逐渐溶解
溶液由无色变为黄色
铁钉表面有气泡冒出
Fe2O3
+
6HCl
=
2FeCl3+
3H2O
Fe+
2HCl
=
FeCl2
+
H2↑
我会填
在线测试
1.在实验室制备氢气可以用(
)
2.盐酸和稀硫酸常用作金属表面的清洁剂,是利用了它们化学性质中的(
)
A.
能与金属反应
B.能与金属氧化物反应
C
.能使指示剂变色
D.能溶于水
B
B
A.碳粒与水
B.锌粒与稀盐酸
C.铁屑与浓盐酸
D.铜片与稀硫酸
3、下列物质能和盐酸反应生成浅绿色溶液的是(
)
A、
Fe
B、
Fe2O3
C、
Mg
D、
CaCO3
A
4.下列关于盐酸的描述,错误的是( )
A.盐酸中的溶质是HCl
B.盐酸能使石蕊试液变红
C.盐酸与硫酸的化学性质完全相同
D.打开装有浓盐酸的试剂瓶瓶塞,瓶口处有白雾出现
5.下列关于硫酸的说法错误的是( )
A.浓硫酸具有吸水性
B.稀硫酸能用来除铁锈
C.稀硫酸与氯化钡溶液混合得白色沉淀
D.浓硫酸倒入水中,溶液温度会降低
6.物质X可发生下列所示的两个反应,则X可能是( )
①X+金属→盐+H2 ②X+金属氧化物→盐+H2O
A.CaO ??B.CO2 ?? C.CO ?? D.H2SO4
C
D
D
7.写出下列化学方程式:
(1)Fe2O3+
H2SO4==
;
(2)CuO+H2SO4==
;
(4)
HCl+Na2CO3==
。
Fe2(SO4)3
+
3H2O
3
CuSO4
+
H2O
2
2NaCl
+
H2O+CO2↑
8.请举出两种不同制备氯化镁的方法,用化学方程式表示
MgO+2HCl=MgCl2+H2O
Mg+2HCl=MgCl2+H2↑
9.下列物质中,能除去铁制品表面铁锈的是(
)
A.稀硫酸
B.水
C.氢氧化钠溶液
D.硫酸铜溶液
A
10.除去稀盐酸中的少量稀硫酸可用———————。
除去氯化钠溶液中的少量碳酸钠可用—————。
氯化钡溶液
稀盐酸
11、稀盐酸中有H2O、H+、Cl-三种微粒,是哪种微粒使紫色的石蕊试液变成红色的?你能设计一个实验进行证明吗?
1.取少量水于试管中,滴加几滴紫色的石蕊,溶液不变色,说明水分子不能使紫色石蕊变红。
2.取少量NaCl溶液于试管中,滴加几滴紫色石蕊,溶液不变色,说明Cl-不能使紫色石蕊变红。
3.取少量稀盐酸于试管中,滴加几滴紫色的石蕊,溶液变成红色,说明是H+使紫色石蕊变红。
课外作业
拓展性作业
巩固性作业
练测考
11和12页
练测考
11页
综合提升
课题名称:酸及其性质(第2课时)
执教人:
知
识
回
顾
3.浓盐酸和浓硫酸的物理性质
1.酸的概念
2.稀释浓硫酸的方法
溶于水后,解离出的阳离子全部是氢离子(H+)的化合物。
酸入水
第一节
酸及其性质
第二单元
常见的酸和碱
(第二课时)
1、通过实验探究稀盐酸的化学性质;
2、熟练掌握有关化学方程式的书写。
学习目标
1、盐酸能与哪些物质发生化学反应?
2、浓盐酸和浓硫酸的物理性质?
3、怎样正确稀释浓硫酸?
问题清单
探究三:稀盐酸的化学性质
盐酸与哪些物质发生化学反应
1、在2支试管中分别加入少量稀盐酸,然后分别滴入几滴紫色石蕊试液和无色酚酞试液,观察并记录现象。
操作
滴入石蕊试液
滴入酚酞试液
现象
紫色石蕊变红
无色酚酞不变色
实验结论:
稀盐酸能使紫色石蕊试液变红
实验内容
现象与结论#
有大量气泡产生,镁条逐渐溶解
铁锈逐渐溶解,溶液由无色变成
黄色
Mg
+
2HCl
==
MgCl2+
H2↑
Fe2O3
+
6HCl
=
2FeCl3
+
3H2O
过一会,铁钉表面有气泡冒出
Fe+
2HCl
==
FeCl2
+
H2↑
(Fe3+)
纯净的铁钉放入盐酸中的现象:
镁条和
稀盐酸
生锈的铁钉和稀盐酸
溶液呈黄色
(Fe2+)
溶液呈浅绿色
有大量气泡产生,
溶液变为浅绿色
实验内容
现象与结论
产生白色沉淀
无现象
有大量气泡产生
Na2CO3+2HCl==2NaCl+H2O+CO2↑
AgNO3
+
HCl=AgCl↓+HNO3
稀盐酸和
碳酸钠粉末
稀盐酸和
硝酸银溶液
稀盐酸和
氯化钡溶液
(不溶于酸)
白色不溶于
水的沉淀
2Al
+
6HCl
=
2AlCl3
+
3H2↑
CuO
+
2HCl=
CuCl2
+
H2O
黑色氧化铜逐渐溶解,溶液由无色变成蓝色
CaCO3
+
2HCl
==
CaCl2
+
CO2↑+
H2O
仿照上面的反应试着写出稀盐酸与铝(Al)、氧化铜(CuO)、碳酸钙(CaCO3)反应的方程式:
有大量气泡产生
试
一
试
(Cu2+)
黑色
蓝色
稀盐酸的化学性质
(2)稀盐酸与金属反应
Na2CO3+
2HCl
=
2NaCl
+
H2O
+
CO2↑
Mg
+
2HCl
=
MgCl2
+
H2↑
Fe
+
2HCl
=
FeCl2
+
H2↑
Fe2O3+
6HCl
==
2FeCl3
+3H2O
(3)稀盐酸与金属氧化物反应
(4)稀盐酸与碳酸钠、碳酸钙等类似化合物反应
氯化亚铁
氯化铁
(1)稀盐酸与酸碱
指示剂反应
+2
+3
使紫色石蕊试液变红,
使无色酚酞试液不变色
Mg
+
2HCl
=
MgCl2
+
H2↑
Fe
+
2HCl
=
FeCl2
+
H2↑
Zn
+
2HCl
=
ZnCl2
+
H2↑
置换反应
1.讨论:从物质分类的角度说一说以下反应
的共同特点
分解反应
化合反应
合
作
探
究
一定有化合价变化的反应类型
单质1
+化合物1
单质2
+化合物2
Fe2O3
+
6HCl
=
2FeCl3
+
3H2O
Na2CO3+2HCl=
2NaCl+H2O+CO2↑
HCl
+
AgNO3
=
AgCl↓
+
HNO3
CaCO3
+
2HCl
=
CaCl2
+
H2O
+
CO2↑
2.从物质分类角度说一说以下反应物和生成物的共同
点?
从物质组成的角度分析上述反应的生成物是怎样形成的?
反应物和生成物都是两种化合物
反应物交换成分后变成生成物
双交换
价不变
合
作
探
究
两种化合物
交换
成分
两种新化合物
复分解反应:
H2CO3
Fe2O3
+
6HCl
=
2FeCl3
+
3H2O
Na2CO3+2HCl=
2NaCl+H2O+CO2↑
HCl+
AgNO3
=
AgCl↓+
HNO3
盐:
CaCO3+2HCl
=
CaCl2+
H2O
+
CO2↑
CuO
+
2HCl
=
CuCl2
+
H2O
金属离子
+
酸根离子
合
作
探
究
从物质组成的角度分析以下方框内的物质有什么共同点?
由金属阳离子
和酸根阴离子构成的的化合物。
盐
NaCl
CaCO3
CuSO4
NH4Cl
NaHCO3
Cu2(OH)2CO3
MgCl2
NH4+——金属阳离子
NH4Cl
NH4NO3
(铵根离子)
碱式碳酸铜
深入认识物质分类
物质
纯净物
混合物
单质
化合物
金属单质
非金属单质
氧化物
酸
碱
盐
溶液
空气
金属氧化物
非金属氧化物
不同的酸溶液具有的共同点是什么?
酸溶液中都含有氢离子
酸溶液具有相似的化学性质
请试着写出硫酸与镁、生锈的铁钉、碳酸钠反应的方程式
思
考
Mg
+
H2SO4
=
MgSO4
+
H2↑
Fe2O3
+
3H2SO4
=
Fe2(SO4)3
+
3H2O
Na2CO3
+
H2SO4
=
Na2SO4
+
H2O
+
CO2↑
BaCl2
稀硫酸的化学性质
白色沉淀
Fe
CuO
Zn
+
H2SO4
=
FeSO4
+
H2↑
+
H2SO4
=
ZnSO4
+
H2↑
+
H2SO4
=
CuSO4
+
H2O
+
H2SO4
=
BaSO4↓+
2HCl
置换反应
复分解反应
(不溶于酸)
+2
+3
酸溶液能使紫色石蕊试液变红色;无色酚酞试液不变色
Mg
+
H2SO4
=
MgSO4
+
H2↑
Fe2O3
+
3H2SO4
=
Fe2(SO4)3
+
3H2O
Na2CO3
+
H2SO4
=
Na2SO4
+
H2O
+
CO2↑
BaCl2
稀硫酸的化学性质
白色沉淀
Fe
CuO
Zn
+
H2SO4
=
FeSO4
+
H2↑
+
H2SO4
=
ZnSO4
+
H2↑
+
H2SO4
=
CuSO4
+
H2O
+
H2SO4
=
BaSO4↓+
2HCl
置换反应
复分解反应
(不溶于酸)
+3
1、酸与指示剂作用
2、酸+某些金属→
Fe+2HCl=FeCl2+H2↑
3、酸+某些金属氧化物→
Fe2O3+6HCl=2FeCl3+3H2O
4、酸+部分盐→
盐+氢气
盐+水
新盐+新酸
酸溶液能使紫色石蕊试液变红色;无色酚酞试液不变色
Fe
+
H2SO4
=
FeSO4
+
H2↑
Fe2O3
+
3H2SO4
=
Fe2(SO4)3
+
3H2O
AgNO3
+
HCl
=
AgCl↓+
HNO3
Na2CO3
+
2HCl
=
2NaCl
+
H2O
+
CO2↑
BaCl2
+
H2SO4
=
BaSO4↓+
2HCl
Na2CO3
+
H2SO4
=
Na2SO4
+
H2O
+
CO2↑
酸的通性
置换反应
复分解反应
BaCl2
+
H2SO4
=
BaSO4↓+
2HCl
不同的酸溶液含有的酸根离子不同,
所以它们的化学性质不完全相同。
盐酸和硫酸的化学性质是否完全相同?为什么?
BaCl2溶液和盐酸HCl不反应
物质的组成或结构决定物质的性质
不完全相同
思
考
酸的应用
浓硫酸
农药
炸药
纺织
冶金
染料
浓盐酸:制药
除锈剂
浓硝酸:化肥、炸药、染料、医药、
橡胶等
2.置换反应和复分解反应
我
总
结
1.盐酸的化学性质
4.酸的用途
3.酸的通性
拓展探究
写出以下反应的方程式,指明反应类型并分析反应前后各元素的化合价是否发生了变化?
氢气燃烧
二氧化碳溶于水
碳酸分解
过氧化氢制取氧气
镁和盐酸反应
铁和盐酸反应
硝酸银和盐酸反应
氧化铁与盐酸反应
2H2
+O2
=
2H2O
点燃
2H2O2
MnO2
2H2O
+
O2↑
H2CO3=H2O+CO2↑
H2O+CO2=H2CO3
Mg+2HCl=
MgCl2+H2↑
Fe+
2HCl=
FeCl2
+H2↑
HCl+AgNO3
=
AgCl↓+HNO3
Fe2O3+6HCl
=
2FeCl3
+3H2O
一定有化合价变化的反应类型是
,一定不变的是
,有可能变的是
。
置换
复分解
化合、分解
化合反应
分解反应
置换反应
复分解反应
△
1、稀释浓硫酸时,一定要把
沿器壁慢慢注入
里,并不断搅拌。
浓硫酸
水
A
课堂检测
3、下列物质能和盐酸反应生成浅绿色溶液的是(
)
A、
Fe
B、
Fe2O3
C、
Mg
D、
CaCO3
A
2、下列物质
暴露在空气中,质量会增加的是(
)
A、
浓硫酸
B、
酒精
C、
浓盐酸
4、下列说法错误的是(
)
A、浓盐酸敞口放置一段时间后,溶液的质量会减少,溶质的质量分数增大
B、浓盐酸在空气中会冒白烟
C、浓硫酸敞口一段时间后,溶液的质量会增加,溶质的质量分数变小
D、浓硫酸溶于水时会放出大量的热
课堂检测
AB
课堂检测
5、
现有失去标签的浓盐酸、浓硫酸各一瓶,请用三种不同方法进行区分。
1、打开瓶塞观察现象。有白雾生成的是浓盐酸,无
明显现象的是浓硫酸。
2、闻气味。有刺激性气味的是浓盐酸,另一瓶是浓
硫酸。
3、用玻璃棒分别蘸取少量两种液体,在白纸上写字。
无明显变化的是浓盐酸,明显变黄变黑的是浓硫酸。
脱水性
铁锈的主要成分是
它的颜色是
,将一枚生锈的铁钉放入足量的盐酸中,首先观察到的现象是
,
。过一段时间,还能观察到的现象是
,
请写出有关反应的化学方程式:
氧化铁
红色
铁锈逐渐溶解
溶液由无色变为黄色
铁钉表面有气泡冒出
Fe2O3
+
6HCl
=
2FeCl3+
3H2O
Fe+
2HCl
=
FeCl2
+
H2↑
我会填
在线测试
1.在实验室制备氢气可以用(
)
2.盐酸和稀硫酸常用作金属表面的清洁剂,是利用了它们化学性质中的(
)
A.
能与金属反应
B.能与金属氧化物反应
C
.能使指示剂变色
D.能溶于水
B
B
A.碳粒与水
B.锌粒与稀盐酸
C.铁屑与浓盐酸
D.铜片与稀硫酸
3、下列物质能和盐酸反应生成浅绿色溶液的是(
)
A、
Fe
B、
Fe2O3
C、
Mg
D、
CaCO3
A
4.下列关于盐酸的描述,错误的是( )
A.盐酸中的溶质是HCl
B.盐酸能使石蕊试液变红
C.盐酸与硫酸的化学性质完全相同
D.打开装有浓盐酸的试剂瓶瓶塞,瓶口处有白雾出现
5.下列关于硫酸的说法错误的是( )
A.浓硫酸具有吸水性
B.稀硫酸能用来除铁锈
C.稀硫酸与氯化钡溶液混合得白色沉淀
D.浓硫酸倒入水中,溶液温度会降低
6.物质X可发生下列所示的两个反应,则X可能是( )
①X+金属→盐+H2 ②X+金属氧化物→盐+H2O
A.CaO ??B.CO2 ?? C.CO ?? D.H2SO4
C
D
D
7.写出下列化学方程式:
(1)Fe2O3+
H2SO4==
;
(2)CuO+H2SO4==
;
(4)
HCl+Na2CO3==
。
Fe2(SO4)3
+
3H2O
3
CuSO4
+
H2O
2
2NaCl
+
H2O+CO2↑
8.请举出两种不同制备氯化镁的方法,用化学方程式表示
MgO+2HCl=MgCl2+H2O
Mg+2HCl=MgCl2+H2↑
9.下列物质中,能除去铁制品表面铁锈的是(
)
A.稀硫酸
B.水
C.氢氧化钠溶液
D.硫酸铜溶液
A
10.除去稀盐酸中的少量稀硫酸可用———————。
除去氯化钠溶液中的少量碳酸钠可用—————。
氯化钡溶液
稀盐酸
11、稀盐酸中有H2O、H+、Cl-三种微粒,是哪种微粒使紫色的石蕊试液变成红色的?你能设计一个实验进行证明吗?
1.取少量水于试管中,滴加几滴紫色的石蕊,溶液不变色,说明水分子不能使紫色石蕊变红。
2.取少量NaCl溶液于试管中,滴加几滴紫色石蕊,溶液不变色,说明Cl-不能使紫色石蕊变红。
3.取少量稀盐酸于试管中,滴加几滴紫色的石蕊,溶液变成红色,说明是H+使紫色石蕊变红。
课外作业
拓展性作业
巩固性作业
练测考
11和12页
练测考
11页
综合提升
同课章节目录
- 第一单元 溶液
- 1 溶液的形成
- 2 溶液组成的定量表示
- 3物质的溶解性
- 到实验室去:配制一定溶质质量分数的溶液
- 第二单元 常见的酸和碱
- 1 酸及其性质
- 2 碱及其性质
- 3 溶液的酸碱性
- 4 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 到图书馆去:分子变成离子
- 第三单元 海水中的化学
- 1 海洋化学资源
- 2 海水“晒盐”
- 3 海水“制碱”
- 到实验室去:粗盐中难溶性杂质的去除
- 第四单元 金属
- 1 常见的金属材料
- 2 金属的化学性质
- 3 钢铁的锈蚀与防护
- 到实验室去:探究金属的性质
- 第五单元 化学与健康
- 1 食物中的有机物
- 2 化学元素与人体健康
- 3 远离有毒物质
- 第六单元 化学与社会发展
- 1 化学与能源开发
- 2 化学与材料研制
- 3 化学与农业生产
- 4 化学与环境保护
