鲁教版(五四学制)九年级化学3.2海水晒盐课件 (共36张PPT)
文档属性
| 名称 | 鲁教版(五四学制)九年级化学3.2海水晒盐课件 (共36张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-06-01 17:14:07 | ||
图片预览










文档简介
(共36张PPT)
海水“晒
盐”
饱和溶液:
在一定温度下,一定量的溶剂里,不能再继续溶解某种溶质的溶液,就是该溶质的饱和溶液。
在一定温度下,一定量的溶剂里,还能继续溶解某种溶质的溶液,就是该溶质的不饱和溶液。
不饱和溶液:
知
识
回
顾
饱和溶液与不饱和溶液的相互转化
饱和
溶液
①增加溶质
③降低温度(大多数)
②蒸发溶剂
②增加溶剂
③升高温度(大多数)
不饱和
溶液
①减少溶质
我们每日吃的食盐是怎样从海水中提取的?其过程是怎样的
?
第二节
海水“晒盐”
第三单元
海水中的化学
第1课时
1、掌握海水晒盐的过程;
2、理解海水晒盐的基本原理——蒸发结晶;
3、学会用提纯粗盐的方法。
学习目标
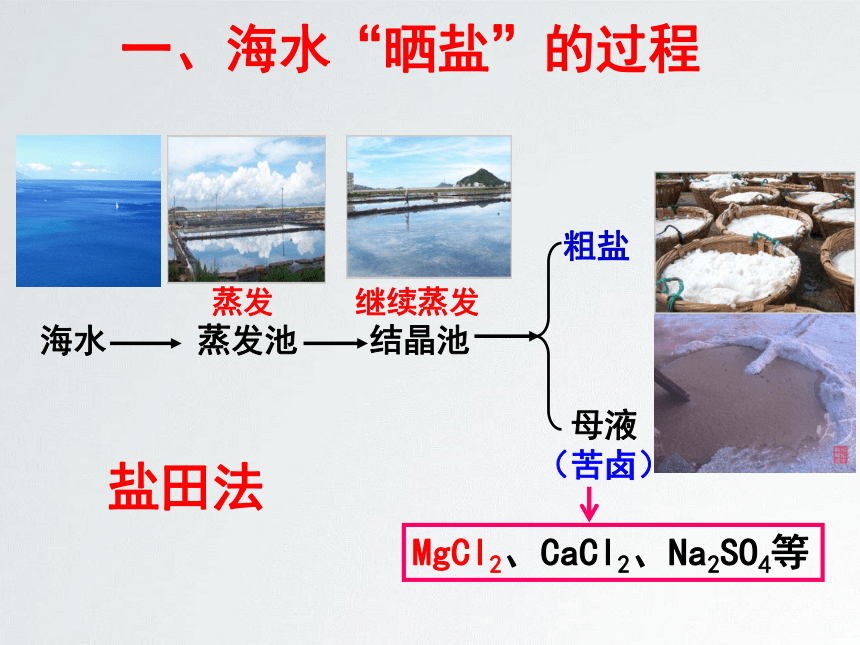
一、海水“晒盐”的过程
海水
蒸发池
结晶池
粗盐
母液
(苦卤)
MgCl2、CaCl2、Na2SO4等
蒸发
继续蒸发
盐田法
蒸发结晶
结晶的途径之一
海水
食盐
饱和溶液
析出
食盐晶体
蒸发水分
继续蒸发
固体物质从它的饱和溶液中以晶体的形式析出的过程。
晶体:具有规则几何外形的固体。
海水“晒盐”的原理
食盐的不饱和溶液
结晶:
硫酸铜晶体
硝酸钾晶体
1、氯化钠溶液从不饱和变为饱和的途径是什么?如何从现象上判断溶液饱和?
2、哪些自然条件有利于海水“晒盐”?为什么?
思考:
蒸发溶剂
当液滴的周围出现少量白色物质时说明溶液已经饱和
这些条件有利于加速水分的蒸发
活动天地
3-1
气候温和、光照充足、大片平坦的海边滩涂
蒸发结晶:像海水“晒盐”这样,经日晒、风吹等,使溶剂不断减少,溶质的质量分数逐渐增大,直至形成饱和溶液,继而析出晶体的方法。
蒸发结晶
海水是食盐的________溶液,在晒盐过程中,_____不断减少,食盐的质量分数
,直至溶液成为________
溶液,继续蒸发就会___________,这一过程叫
________,此后得到的溶液叫_____,它是食盐在该温度下的_______溶液。
跟踪练习
不饱和
水分
逐渐增大
食盐的饱和
逐渐析出食盐
蒸发结晶
饱和
母液
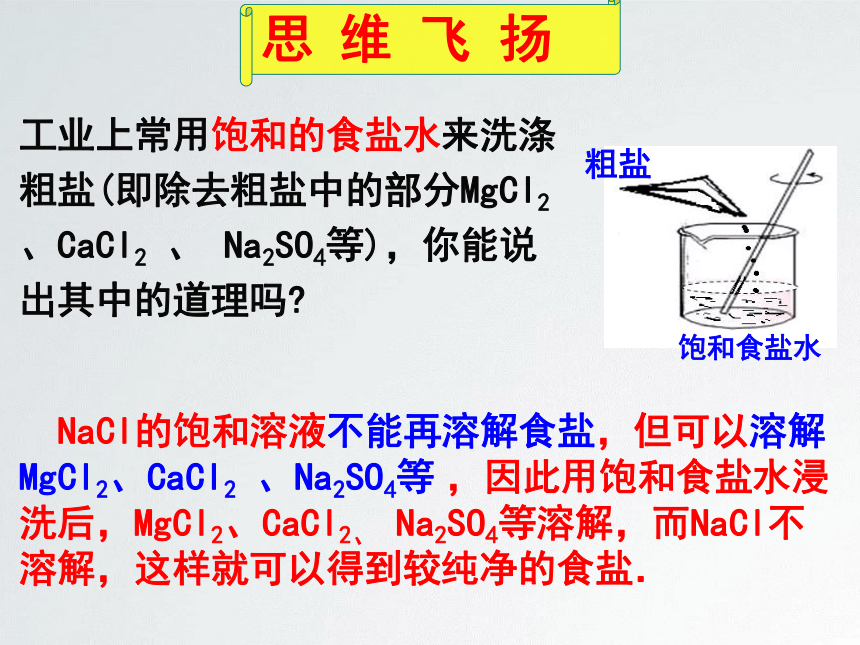
工业上常用饱和的食盐水来洗涤粗盐(即除去粗盐中的部分MgCl2、CaCl2
、
Na2SO4等),你能说出其中的道理吗?
粗盐
饱和食盐水
NaCl的饱和溶液不能再溶解食盐,但可以溶解MgCl2、CaCl2
、Na2SO4等?,因此用饱和食盐水浸洗后,MgCl2、CaCl2、
Na2SO4等溶解,而NaCl不溶解,这样就可以得到较纯净的食盐.
思
维
飞
扬
可溶性杂质
粗
盐
氯化钠
不溶性杂质
Na2SO4、CaCl2、MgCl2
等
泥沙等
二、粗盐的提纯
用什么方法可将粗盐中的泥沙除去?
除去泥沙后,再怎样操作才能得到食盐晶体?
除去粗盐中的不溶性杂质
溶解
蒸发结晶
过滤
使氯化钠溶于水
除去泥沙等不溶性物质
使氯化钠从水中结晶析出
物理方法
步骤:
称量一定质量粗盐
称量精盐
计算产率
溶解、过滤、蒸发结晶
1、三步中都用到的一种仪器是?作用是什么?
2、蒸发结晶时什么时候停止加热?
当蒸发皿中出现较多晶体时,停止加热,靠余热将剩余液体蒸干。
玻璃棒
溶解:搅拌,加速食盐溶解
过滤:引流
蒸发结晶:搅拌,防止局部温度过高,
造成液滴飞溅。
防止固体颗粒迸溅
小
组
讨
论
3.若食盐的产率偏低可能的原因有哪些?
小
组
讨
论
(1)
蒸发过程中液体有飞溅
(2)
溶解搅拌、过滤时液滴溅出
(3)溶解时加入的粗盐过多,未完全溶解
畅
谈
收
获
1、海水“晒盐”的过程及其原理
蒸发结晶
2、除去粗盐中不可溶性杂质的方法和过程
溶解、过滤、蒸发结晶
物理方法
课堂检测
1、目前从海水中提取食盐的方法主要是利用海水晒
盐,它所利用的物质分离方法是(
)
A.溶解法
B.过滤法
C.结晶法
D.蒸馏法
2、我国有辽阔的海岸线,有充足的海水资源。人们常把海水引入盐田,经过风吹日晒使海水中的水分蒸发获得粗盐。在此过程中(
?)
A:
溶剂的质量不变
B:
氯化钠的质量不变
C:
氯化钠的质量分数始终不变
D:
氯化钠的质量分数变小
C
B
如图所示是“粗盐中难溶性杂质的去除”的部分实验操作示意图:
(1)上图所示操作中,有错误的是
(填字母)
(2)粗盐提纯的正确操作顺序为
(填字母)
(3)操作B中,玻璃棒的作用是
。
C
DACB
搅拌,防止局部温度过高,造成液滴飞溅。
(4)步骤D中称取5.0g粗盐,将该粗盐逐渐加入盛有10ml水的烧杯中,边加边用玻璃棒搅拌,直到粗盐不再溶解为止,称得剩余粗盐为0.5g,最终得到NaCl晶体3.6g,该实验精盐的产率是
。
(5)若制得的精盐的产率偏高,
则可能的原因是
(填字母)
A、过滤时滤纸有破损
B、蒸发时有固体溅出
C、最终所得精盐比较潮湿
80%
AC
3、除去KCl固体中混有的少量泥沙,所进行的实验操作次序为:_________、_________、___________,每步操作都要用到的玻璃仪器是_______________。
4、下列物质可按溶解、过滤、蒸发的操作顺序,将它
们分离开的是(
)
A、酒精和水
B、氯化钾和二氧化锰
C、氯化钠和硝酸钾
D、铁粉和铜粉
溶解
过滤
蒸发结晶
玻璃棒
B
海水“晒
盐”
第
2
课
时
1、掌握工业上精制食盐的方法;
2、了解食盐的用途;
3、能熟练正确的书写出相关反应的
化学方程式。
学习目标
除去可溶性杂质的流程
NaCl
MgCl2
CaCl2
Na2SO4
溶液
过量BaCl2溶液
BaSO4↓
NaCl、MgCl2
CaCl2
、剩余BaCl2
过量
Na2CO3溶液
NaCl、
剩余NaOH、Na2CO3
溶液:
沉淀:
溶液:
沉淀:
CaCO3
↓
BaCO3
↓
过量
NaOH溶液
溶液:
沉淀:
NaCl、CaCl2
剩余
NaOH、BaCl2
Mg(OH)2
过滤后加适量稀HCl
NaCl
溶液
NaCl晶体
除去可溶性杂质的流程
蒸发结晶
粗盐中的可溶性杂质:
MgCl2、CaCl2、Na2SO4等
大于原氯化钠的质量
BaCl2
+
Na2SO4
=
BaSO4↓
+
2NaCl
2NaOH+
MgCl2
=Mg(OH)2↓
+
2NaCl
Na2CO3
+
CaCl2
=
CaCO3↓
+
2NaCl
Na2CO3
+
BaCl2
=
BaCO3↓
+
2NaCl
NaOH
+
HCl=
NaCl+H2O
Na2CO3+2HCl=2NaCl+CO2↑+H2O
②NaOH
、
BaCl2
、
Na2CO3、
稀HCl
①BaCl2
、
Na2CO3、
NaOH
、
稀HCl
其他除杂流程顺序:
(1)过量BaCl2溶液
(2)过量NaOH溶液
(3)过量Na2CO3溶液
(4)过滤后加适量稀HCl
同时除去剩余的BaCl2:
除去剩余的NaOH
和Na2CO3
Na2CO3必须放在BaCl2之后,以除去过量的Ba2+
除去可溶性杂质,要考虑:
1.加入合适的试剂,转化为沉淀、气体或水
2.试剂的用量
3.过量试剂的处理
4.不能引入新的杂质
除去下列物质中的杂质(写出所需物质的化学式)
(1)
NaCl
(CaCl2)
________
(2)
NaCl
(MgCl2)
_________
(3)
NaCl
(Na2SO4)
________
(4)
NaCl
(Na2CO3)
_________
Na2CO3
NaOH
BaCl2
HCl
跟踪练习
物理方法
过滤
蒸发
蒸馏
气体
水
化学方法
沉淀
混合物分离提纯的一般思路
纯净物
混合物
结晶
食盐的用途
1、生活:用作调味品和食品添加剂
2、工业:制造烧碱、氯气、盐酸、纯碱化
学肥料、塑料、合成橡胶、染料等
3、医疗:配制生理盐水
4、农业:用一定浓度的氯化钠溶液进行选种
通过海水晾晒可得粗盐,粗盐除NaCl外,还含有MgCl2、CaCl2、Na2SO4以及泥沙等杂质。以下是制备精盐的实验方案,各步操作流程如下:
(1)在第①步粗盐溶解操作中要用_________搅拌,作用是__________。
(2)第②步操作的目的是除去粗盐中的______(填化学式,下同),第⑥步操作的目的是除去滤液中的_______。
(3)第⑤步“过滤”操作中得到沉淀的成分有:泥沙、BaSO4、Mg(OH)2、
(填化学式)。
(4)在第③步操作中,选择的除杂试剂不能用KOH代替NaOH,理由是___________。
Na2SO4
搅拌,加速溶解
玻璃棒
过量的氧氧化钠和碳酸钠
CaCO3、BaCO3
会引入新的杂质KCl
课堂检测
1、下列是某小组在实验室模拟从海水制备精盐的流程
图:此过程中没有涉及到的实验方法是(
)
D
A:
蒸发
B:
结晶
C:
过滤
D:
蒸馏
2、关于食盐的叙述错误的是(
)
A.氯化钠是人的正常生理活动所必不可少的
B.人们每天摄人食盐来补充因出汗、排尿等排出的
氯化钠
C.人们每天要消耗氯化钠,因此氯化钠摄入越多越
有利于健康
D.氯化钠解离的氯离子是胃液的主要成分,有促生
盐酸、助消化、增食欲作用
C
3、为了除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,可将粗盐溶于水,然后进行下列五项操作.不正确的操作顺序是(????)
(1)过滤,(2)加过量的NaOH溶液,(3)加适量盐酸,
(4)加过量Na2CO3溶液,
(5)加过量BaCl2溶液。
A.?(4)(2)(5)(1)(3)
B.?(5)(4)(2)(1)(3)
C.?(2)(5)(4)(1)(3)
D.?(5)(2)(4)(1)(3)
A
4、下列关于海水晒盐原理的分析正确的是(
?)。
A:
利用阳光照射,使海水升温得到食盐
B:
利用海风降温析出食盐晶体
C:
利用海水在阳光下发生分解反应制得食盐
D:
利用阳光和风力使水分蒸发得到食盐
D
5、海水晒盐的原理是利用日晒风吹蒸发海水中的水分,使氯化钠晶体析出.下图能正确表示海水晒盐过程中,海水中NaCl的质量分数(A%)与蒸发时间(t)的关系是(????)
C
6、如图所示,将密闭的相互连通的装置放在天平上,调节天平使之平衡。经过一段时间后,下列有关叙述正确的是(
)
A.指针偏左,食盐溶液一定变稀,烧碱潮解
B.指针偏右,食盐溶液一定饱和,烧碱潮解
C.指针偏左,食盐溶液一定变浓,烧碱潮解
D.指针偏右,食盐溶液一定变浓,烧碱潮解
D
海水“晒
盐”
饱和溶液:
在一定温度下,一定量的溶剂里,不能再继续溶解某种溶质的溶液,就是该溶质的饱和溶液。
在一定温度下,一定量的溶剂里,还能继续溶解某种溶质的溶液,就是该溶质的不饱和溶液。
不饱和溶液:
知
识
回
顾
饱和溶液与不饱和溶液的相互转化
饱和
溶液
①增加溶质
③降低温度(大多数)
②蒸发溶剂
②增加溶剂
③升高温度(大多数)
不饱和
溶液
①减少溶质
我们每日吃的食盐是怎样从海水中提取的?其过程是怎样的
?
第二节
海水“晒盐”
第三单元
海水中的化学
第1课时
1、掌握海水晒盐的过程;
2、理解海水晒盐的基本原理——蒸发结晶;
3、学会用提纯粗盐的方法。
学习目标
一、海水“晒盐”的过程
海水
蒸发池
结晶池
粗盐
母液
(苦卤)
MgCl2、CaCl2、Na2SO4等
蒸发
继续蒸发
盐田法
蒸发结晶
结晶的途径之一
海水
食盐
饱和溶液
析出
食盐晶体
蒸发水分
继续蒸发
固体物质从它的饱和溶液中以晶体的形式析出的过程。
晶体:具有规则几何外形的固体。
海水“晒盐”的原理
食盐的不饱和溶液
结晶:
硫酸铜晶体
硝酸钾晶体
1、氯化钠溶液从不饱和变为饱和的途径是什么?如何从现象上判断溶液饱和?
2、哪些自然条件有利于海水“晒盐”?为什么?
思考:
蒸发溶剂
当液滴的周围出现少量白色物质时说明溶液已经饱和
这些条件有利于加速水分的蒸发
活动天地
3-1
气候温和、光照充足、大片平坦的海边滩涂
蒸发结晶:像海水“晒盐”这样,经日晒、风吹等,使溶剂不断减少,溶质的质量分数逐渐增大,直至形成饱和溶液,继而析出晶体的方法。
蒸发结晶
海水是食盐的________溶液,在晒盐过程中,_____不断减少,食盐的质量分数
,直至溶液成为________
溶液,继续蒸发就会___________,这一过程叫
________,此后得到的溶液叫_____,它是食盐在该温度下的_______溶液。
跟踪练习
不饱和
水分
逐渐增大
食盐的饱和
逐渐析出食盐
蒸发结晶
饱和
母液
工业上常用饱和的食盐水来洗涤粗盐(即除去粗盐中的部分MgCl2、CaCl2
、
Na2SO4等),你能说出其中的道理吗?
粗盐
饱和食盐水
NaCl的饱和溶液不能再溶解食盐,但可以溶解MgCl2、CaCl2
、Na2SO4等?,因此用饱和食盐水浸洗后,MgCl2、CaCl2、
Na2SO4等溶解,而NaCl不溶解,这样就可以得到较纯净的食盐.
思
维
飞
扬
可溶性杂质
粗
盐
氯化钠
不溶性杂质
Na2SO4、CaCl2、MgCl2
等
泥沙等
二、粗盐的提纯
用什么方法可将粗盐中的泥沙除去?
除去泥沙后,再怎样操作才能得到食盐晶体?
除去粗盐中的不溶性杂质
溶解
蒸发结晶
过滤
使氯化钠溶于水
除去泥沙等不溶性物质
使氯化钠从水中结晶析出
物理方法
步骤:
称量一定质量粗盐
称量精盐
计算产率
溶解、过滤、蒸发结晶
1、三步中都用到的一种仪器是?作用是什么?
2、蒸发结晶时什么时候停止加热?
当蒸发皿中出现较多晶体时,停止加热,靠余热将剩余液体蒸干。
玻璃棒
溶解:搅拌,加速食盐溶解
过滤:引流
蒸发结晶:搅拌,防止局部温度过高,
造成液滴飞溅。
防止固体颗粒迸溅
小
组
讨
论
3.若食盐的产率偏低可能的原因有哪些?
小
组
讨
论
(1)
蒸发过程中液体有飞溅
(2)
溶解搅拌、过滤时液滴溅出
(3)溶解时加入的粗盐过多,未完全溶解
畅
谈
收
获
1、海水“晒盐”的过程及其原理
蒸发结晶
2、除去粗盐中不可溶性杂质的方法和过程
溶解、过滤、蒸发结晶
物理方法
课堂检测
1、目前从海水中提取食盐的方法主要是利用海水晒
盐,它所利用的物质分离方法是(
)
A.溶解法
B.过滤法
C.结晶法
D.蒸馏法
2、我国有辽阔的海岸线,有充足的海水资源。人们常把海水引入盐田,经过风吹日晒使海水中的水分蒸发获得粗盐。在此过程中(
?)
A:
溶剂的质量不变
B:
氯化钠的质量不变
C:
氯化钠的质量分数始终不变
D:
氯化钠的质量分数变小
C
B
如图所示是“粗盐中难溶性杂质的去除”的部分实验操作示意图:
(1)上图所示操作中,有错误的是
(填字母)
(2)粗盐提纯的正确操作顺序为
(填字母)
(3)操作B中,玻璃棒的作用是
。
C
DACB
搅拌,防止局部温度过高,造成液滴飞溅。
(4)步骤D中称取5.0g粗盐,将该粗盐逐渐加入盛有10ml水的烧杯中,边加边用玻璃棒搅拌,直到粗盐不再溶解为止,称得剩余粗盐为0.5g,最终得到NaCl晶体3.6g,该实验精盐的产率是
。
(5)若制得的精盐的产率偏高,
则可能的原因是
(填字母)
A、过滤时滤纸有破损
B、蒸发时有固体溅出
C、最终所得精盐比较潮湿
80%
AC
3、除去KCl固体中混有的少量泥沙,所进行的实验操作次序为:_________、_________、___________,每步操作都要用到的玻璃仪器是_______________。
4、下列物质可按溶解、过滤、蒸发的操作顺序,将它
们分离开的是(
)
A、酒精和水
B、氯化钾和二氧化锰
C、氯化钠和硝酸钾
D、铁粉和铜粉
溶解
过滤
蒸发结晶
玻璃棒
B
海水“晒
盐”
第
2
课
时
1、掌握工业上精制食盐的方法;
2、了解食盐的用途;
3、能熟练正确的书写出相关反应的
化学方程式。
学习目标
除去可溶性杂质的流程
NaCl
MgCl2
CaCl2
Na2SO4
溶液
过量BaCl2溶液
BaSO4↓
NaCl、MgCl2
CaCl2
、剩余BaCl2
过量
Na2CO3溶液
NaCl、
剩余NaOH、Na2CO3
溶液:
沉淀:
溶液:
沉淀:
CaCO3
↓
BaCO3
↓
过量
NaOH溶液
溶液:
沉淀:
NaCl、CaCl2
剩余
NaOH、BaCl2
Mg(OH)2
过滤后加适量稀HCl
NaCl
溶液
NaCl晶体
除去可溶性杂质的流程
蒸发结晶
粗盐中的可溶性杂质:
MgCl2、CaCl2、Na2SO4等
大于原氯化钠的质量
BaCl2
+
Na2SO4
=
BaSO4↓
+
2NaCl
2NaOH+
MgCl2
=Mg(OH)2↓
+
2NaCl
Na2CO3
+
CaCl2
=
CaCO3↓
+
2NaCl
Na2CO3
+
BaCl2
=
BaCO3↓
+
2NaCl
NaOH
+
HCl=
NaCl+H2O
Na2CO3+2HCl=2NaCl+CO2↑+H2O
②NaOH
、
BaCl2
、
Na2CO3、
稀HCl
①BaCl2
、
Na2CO3、
NaOH
、
稀HCl
其他除杂流程顺序:
(1)过量BaCl2溶液
(2)过量NaOH溶液
(3)过量Na2CO3溶液
(4)过滤后加适量稀HCl
同时除去剩余的BaCl2:
除去剩余的NaOH
和Na2CO3
Na2CO3必须放在BaCl2之后,以除去过量的Ba2+
除去可溶性杂质,要考虑:
1.加入合适的试剂,转化为沉淀、气体或水
2.试剂的用量
3.过量试剂的处理
4.不能引入新的杂质
除去下列物质中的杂质(写出所需物质的化学式)
(1)
NaCl
(CaCl2)
________
(2)
NaCl
(MgCl2)
_________
(3)
NaCl
(Na2SO4)
________
(4)
NaCl
(Na2CO3)
_________
Na2CO3
NaOH
BaCl2
HCl
跟踪练习
物理方法
过滤
蒸发
蒸馏
气体
水
化学方法
沉淀
混合物分离提纯的一般思路
纯净物
混合物
结晶
食盐的用途
1、生活:用作调味品和食品添加剂
2、工业:制造烧碱、氯气、盐酸、纯碱化
学肥料、塑料、合成橡胶、染料等
3、医疗:配制生理盐水
4、农业:用一定浓度的氯化钠溶液进行选种
通过海水晾晒可得粗盐,粗盐除NaCl外,还含有MgCl2、CaCl2、Na2SO4以及泥沙等杂质。以下是制备精盐的实验方案,各步操作流程如下:
(1)在第①步粗盐溶解操作中要用_________搅拌,作用是__________。
(2)第②步操作的目的是除去粗盐中的______(填化学式,下同),第⑥步操作的目的是除去滤液中的_______。
(3)第⑤步“过滤”操作中得到沉淀的成分有:泥沙、BaSO4、Mg(OH)2、
(填化学式)。
(4)在第③步操作中,选择的除杂试剂不能用KOH代替NaOH,理由是___________。
Na2SO4
搅拌,加速溶解
玻璃棒
过量的氧氧化钠和碳酸钠
CaCO3、BaCO3
会引入新的杂质KCl
课堂检测
1、下列是某小组在实验室模拟从海水制备精盐的流程
图:此过程中没有涉及到的实验方法是(
)
D
A:
蒸发
B:
结晶
C:
过滤
D:
蒸馏
2、关于食盐的叙述错误的是(
)
A.氯化钠是人的正常生理活动所必不可少的
B.人们每天摄人食盐来补充因出汗、排尿等排出的
氯化钠
C.人们每天要消耗氯化钠,因此氯化钠摄入越多越
有利于健康
D.氯化钠解离的氯离子是胃液的主要成分,有促生
盐酸、助消化、增食欲作用
C
3、为了除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,可将粗盐溶于水,然后进行下列五项操作.不正确的操作顺序是(????)
(1)过滤,(2)加过量的NaOH溶液,(3)加适量盐酸,
(4)加过量Na2CO3溶液,
(5)加过量BaCl2溶液。
A.?(4)(2)(5)(1)(3)
B.?(5)(4)(2)(1)(3)
C.?(2)(5)(4)(1)(3)
D.?(5)(2)(4)(1)(3)
A
4、下列关于海水晒盐原理的分析正确的是(
?)。
A:
利用阳光照射,使海水升温得到食盐
B:
利用海风降温析出食盐晶体
C:
利用海水在阳光下发生分解反应制得食盐
D:
利用阳光和风力使水分蒸发得到食盐
D
5、海水晒盐的原理是利用日晒风吹蒸发海水中的水分,使氯化钠晶体析出.下图能正确表示海水晒盐过程中,海水中NaCl的质量分数(A%)与蒸发时间(t)的关系是(????)
C
6、如图所示,将密闭的相互连通的装置放在天平上,调节天平使之平衡。经过一段时间后,下列有关叙述正确的是(
)
A.指针偏左,食盐溶液一定变稀,烧碱潮解
B.指针偏右,食盐溶液一定饱和,烧碱潮解
C.指针偏左,食盐溶液一定变浓,烧碱潮解
D.指针偏右,食盐溶液一定变浓,烧碱潮解
D
同课章节目录
- 第一单元 溶液
- 1 溶液的形成
- 2 溶液组成的定量表示
- 3物质的溶解性
- 到实验室去:配制一定溶质质量分数的溶液
- 第二单元 常见的酸和碱
- 1 酸及其性质
- 2 碱及其性质
- 3 溶液的酸碱性
- 4 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 到图书馆去:分子变成离子
- 第三单元 海水中的化学
- 1 海洋化学资源
- 2 海水“晒盐”
- 3 海水“制碱”
- 到实验室去:粗盐中难溶性杂质的去除
- 第四单元 金属
- 1 常见的金属材料
- 2 金属的化学性质
- 3 钢铁的锈蚀与防护
- 到实验室去:探究金属的性质
- 第五单元 化学与健康
- 1 食物中的有机物
- 2 化学元素与人体健康
- 3 远离有毒物质
- 第六单元 化学与社会发展
- 1 化学与能源开发
- 2 化学与材料研制
- 3 化学与农业生产
- 4 化学与环境保护
