沪教版(上海)初中化学九年级第二学期第5章《初识酸和碱》检测题(含答案)
文档属性
| 名称 | 沪教版(上海)初中化学九年级第二学期第5章《初识酸和碱》检测题(含答案) |  | |
| 格式 | zip | ||
| 文件大小 | 87.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版(试用本) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-06-02 11:52:14 | ||
图片预览


文档简介
本卷由系统自动生成,请仔细校对后使用,答案仅供参考。
《初识酸和碱》检测题
一、单选题
1.归纳总结是学习化学的常用方法,下列总结的规律正确的是(
)
A.含氧的化合物都是氧化物
B.化学反应伴随着能量变化
C.带电的粒子都是离子
D.酸、碱、盐中都含有金属元素
2.下列各组离子能在指定溶液中大量共存的是( )
A.在稀盐酸中:、、
B.在氢氧化钠溶液中:、、
C.在氯化钠溶液中:、、
D.在硫酸铵溶液中:、、
3.将含有硫酸的硫酸镁溶液转变为中性溶液,在没有任何指示剂的条件下,可选用:
A.NaOH
B.Mg
C.Ba(OH)2
D.BaCl2
4.下列设计方案可行,且化学方程式书写正确的是
(
)
A.用Al(OH)3治疗胃酸过多症:Al(OH)3+3HCl==AlCl3+3H2O
B.实验室用稀硫酸与铜片反应制取H2:Cu+H2SO4==CuSO4+H2↑
C.用铁粉从含硝酸银的废水中提取金属银:Fe+3AgNO3==Fe(NO3)3+3Ag
D.用点燃的方法除去二氧化碳气体中混有的少量一氧化碳:2CO+O2点燃2CO2
5.下列事实的结论或解释中不正确的是
A.水烧开后易把壶盖冲起
——说明温度升高分子会变大
B.公园的桂花开放时满园飘香——说明分子在不断运动
C.酸碱中和反应都能生成水
——
实质是H+
和OH—
结合生成了H2O
D.氢气燃烧后的生成物只有水——
说明氢气是一种清洁燃料
6.下列选项中物质的名称、俗名、化学式、类别完全一致的是
A.醋酸
甲酸
CH3COOH
酸
B.氢氧化钠
烧碱
NaOH
碱
C.乙醇
酒精
C2H5OH
氧化物
D.氢氧化钙
石灰石
Ca(OH)2
碱
7.下列关于氢氧化钠的说法中错误的是(
)
A.俗名苛性钠、火碱或烧碱
B.易溶于水,溶于水时吸收大量的热
C.氢氧化钠固体露置在空气中容易变质
D.是重要的化工原料广泛用于肥皂、纺织、印刷等工业
8.下列化学药品敞口放置,主要是由于发生化学变化而质量变大的是(
)
A.浓盐酸
B.浓硫酸
C.石灰水(只考虑溶液质量)
D.生石灰
9.常见食物的近似pH为:葡萄3.5-4.5,苹果2.9-3.3,牛奶6.3-6.6,鸡蛋清7.6-8.0,下列说法错误的是()
A.胃酸过多的人不应多食苹果
B.苹果汁的酸性比葡萄汁强
C.鸡蛋清呈碱性
D.葡萄汁能使紫色石蕊试液变蓝
10.如图表示向一定量稀盐酸中加入碳酸钙时有关质量的变化关系,则纵坐标不能表示
A.消耗盐酸的质量
B.氯化钙的质量
C.水的质量
D.二氧化碳的质量
11.下列对实验现象的描述中,错误的是(
)
A.打开盛有浓硫酸的试剂瓶,瓶口有白烟
B.硝酸铵溶于水吸收大量的热
C.硫在氧气中燃烧时生成有刺激性气味的气体
D.氢气在空气中燃烧,发出淡蓝色火焰
12.对下列实验现象的描述中,与实验事实不相符的是(
)
A.硝酸铵在水中溶解时溶液温度降低
B.盐酸与铁锈反应后溶液呈浅绿色
C.二氧化碳通入澄清石灰水中溶液变浑浊
D.硫磺在氧气中燃烧发出蓝紫色火焰
13.下列做法中,仅利用物理变化原理的是( )
A.用天然气作燃料煮饭
B.用食醋去除暖水瓶中的水垢
C.用活性炭去除冰箱中的异味
D.用稀盐酸去除铁片表面的铁锈
二、实验题
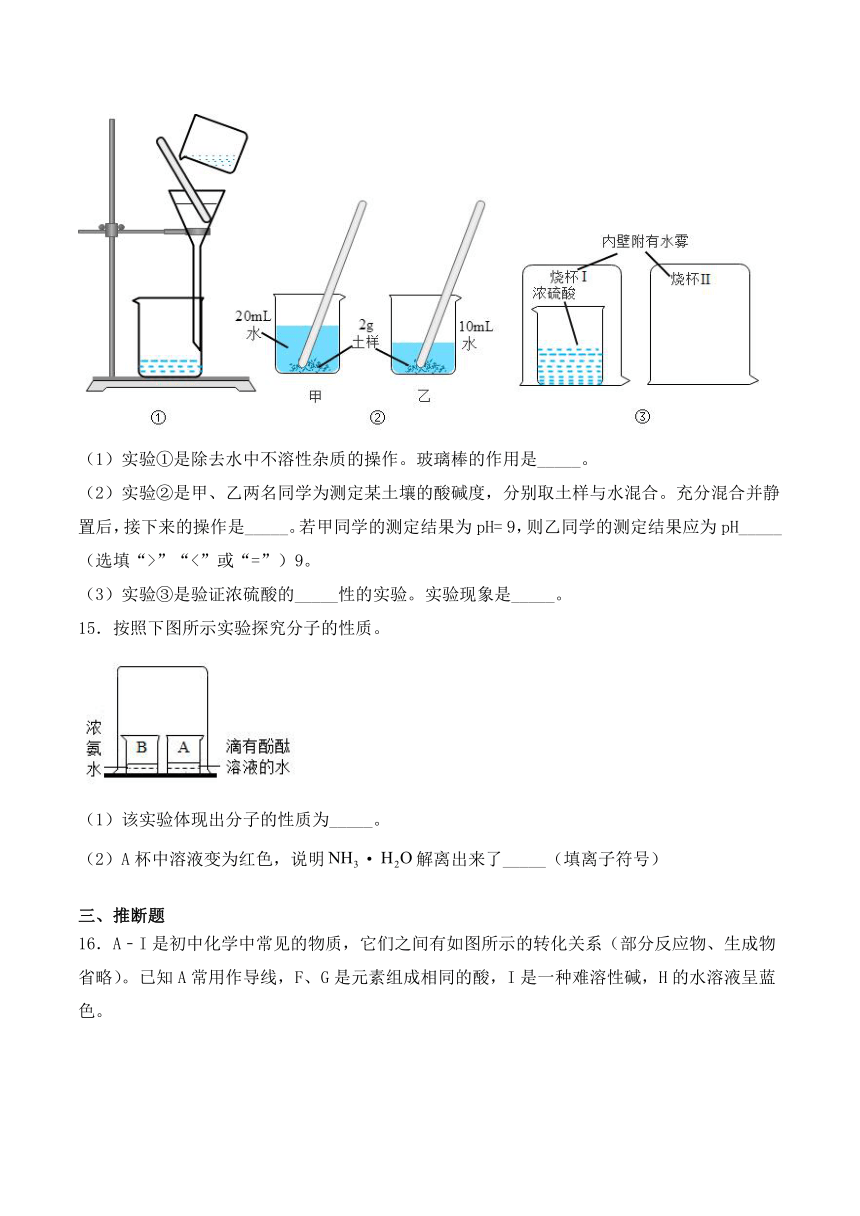
14.根据图所示实验回答问题。
(1)实验①是除去水中不溶性杂质的操作。玻璃棒的作用是_____。
(2)实验②是甲、乙两名同学为测定某土壤的酸碱度,分别取土样与水混合。充分混合并静置后,接下来的操作是_____。若甲同学的测定结果为pH=
9,则乙同学的测定结果应为pH_____(选填“>”“<”或“=”)9。
(3)实验③是验证浓硫酸的_____性的实验。实验现象是_____。
15.按照下图所示实验探究分子的性质。
(1)该实验体现出分子的性质为_____。
(2)A杯中溶液变为红色,说明·解离出来了_____(填离子符号)
三、推断题
16.A﹣I是初中化学中常见的物质,它们之间有如图所示的转化关系(部分反应物、生成物省略)。已知A常用作导线,F、G是元素组成相同的酸,I是一种难溶性碱,H的水溶液呈蓝色。
请回答如下问题:
(1)请写出物质B和G的化学式:B______、G______
(2)请写出下列物质的颜色:A_______、D______
(3)请写出下列转变的化学方程式:
①
E
→
F
:________
②
D
→
H
:________
17.化学就在我们身边,认识和探究身边的化学物质、了解化学的奥秘,是学习化学的重要内容。
(1)A、B、C是三种常见的含钙化合物。它们之间有如图所示的转化关系(部分产物略去):请写出下列物质的化学式:A__________;B_________;C______。
(2)反应①的化学方程式:__________。
(3)我们常用洗涤剂清洗餐具上的油污,这是因为洗涤剂具有
______的功能。
四、计算题
18.将氢氧化钠和氯化钠的混合物19.3g,放入80.7g水中使其完全溶解,再加入100g溶质质量分数为7.3%的稀盐酸,恰好完全反应。试计算:
(1)将上述浓度的稀盐酸100克稀释为溶质质量分数为4%的稀盐酸,需要加入水的质量;
(2)原混合物中氢氧化钠的质量;
(3)反应后所得溶液中溶质的质量。
19.在
200g4.0%的氢氧化钠溶液中加入
150
g
盐酸时溶液
pH=7.求:
(1)所得混合溶液中氯化钠的质量分数________;
(2)若所用盐酸由
36.5%(密度为
1.2
g/cm3)的浓盐酸来配制,需要浓盐酸的体积是多少________?
20.某混合溶液中含有硫酸和盐酸,取该混合溶液20g于烧杯中,不断滴加氢氧化钡溶液,反应过程中烧杯中产生沉淀的质量、溶液pH的变化如图所示(BaCl2溶液呈中性)。求:
(1)完全反应后生成沉淀的质量为_____g;
(2)与盐酸反应的氢氧化钡溶液质量为_______g;
(3)原混合溶液中硫酸的质量分数是多少_____?
参考答案
1.B
2.C
3.B
4.A
5.A
6.B
7.B
8.D
9.D
10.C
11.A
12.B
13.C
14.引流
取上层清液滴在pH试纸上,把试纸显示的颜色与标准比色卡比较,读出pH
>
吸水
烧杯1内壁的水雾较快消失
15.分子在不断运动
OH-
16.O2
H2SO4
紫红色
黑色
SO2+H2O═H2SO3
CuO+H2SO4═CuSO4+H2O
17.CaO
Ca(OH)2
CaCO3
CaO+H2O=Ca(OH)2
乳化
18.(1)82.5克
(2)8克
(3)23克
19.3.3%
16.7mL
20.4.66g
40
9.8%
答案第1页,总2页
《初识酸和碱》检测题
一、单选题
1.归纳总结是学习化学的常用方法,下列总结的规律正确的是(
)
A.含氧的化合物都是氧化物
B.化学反应伴随着能量变化
C.带电的粒子都是离子
D.酸、碱、盐中都含有金属元素
2.下列各组离子能在指定溶液中大量共存的是( )
A.在稀盐酸中:、、
B.在氢氧化钠溶液中:、、
C.在氯化钠溶液中:、、
D.在硫酸铵溶液中:、、
3.将含有硫酸的硫酸镁溶液转变为中性溶液,在没有任何指示剂的条件下,可选用:
A.NaOH
B.Mg
C.Ba(OH)2
D.BaCl2
4.下列设计方案可行,且化学方程式书写正确的是
(
)
A.用Al(OH)3治疗胃酸过多症:Al(OH)3+3HCl==AlCl3+3H2O
B.实验室用稀硫酸与铜片反应制取H2:Cu+H2SO4==CuSO4+H2↑
C.用铁粉从含硝酸银的废水中提取金属银:Fe+3AgNO3==Fe(NO3)3+3Ag
D.用点燃的方法除去二氧化碳气体中混有的少量一氧化碳:2CO+O2点燃2CO2
5.下列事实的结论或解释中不正确的是
A.水烧开后易把壶盖冲起
——说明温度升高分子会变大
B.公园的桂花开放时满园飘香——说明分子在不断运动
C.酸碱中和反应都能生成水
——
实质是H+
和OH—
结合生成了H2O
D.氢气燃烧后的生成物只有水——
说明氢气是一种清洁燃料
6.下列选项中物质的名称、俗名、化学式、类别完全一致的是
A.醋酸
甲酸
CH3COOH
酸
B.氢氧化钠
烧碱
NaOH
碱
C.乙醇
酒精
C2H5OH
氧化物
D.氢氧化钙
石灰石
Ca(OH)2
碱
7.下列关于氢氧化钠的说法中错误的是(
)
A.俗名苛性钠、火碱或烧碱
B.易溶于水,溶于水时吸收大量的热
C.氢氧化钠固体露置在空气中容易变质
D.是重要的化工原料广泛用于肥皂、纺织、印刷等工业
8.下列化学药品敞口放置,主要是由于发生化学变化而质量变大的是(
)
A.浓盐酸
B.浓硫酸
C.石灰水(只考虑溶液质量)
D.生石灰
9.常见食物的近似pH为:葡萄3.5-4.5,苹果2.9-3.3,牛奶6.3-6.6,鸡蛋清7.6-8.0,下列说法错误的是()
A.胃酸过多的人不应多食苹果
B.苹果汁的酸性比葡萄汁强
C.鸡蛋清呈碱性
D.葡萄汁能使紫色石蕊试液变蓝
10.如图表示向一定量稀盐酸中加入碳酸钙时有关质量的变化关系,则纵坐标不能表示
A.消耗盐酸的质量
B.氯化钙的质量
C.水的质量
D.二氧化碳的质量
11.下列对实验现象的描述中,错误的是(
)
A.打开盛有浓硫酸的试剂瓶,瓶口有白烟
B.硝酸铵溶于水吸收大量的热
C.硫在氧气中燃烧时生成有刺激性气味的气体
D.氢气在空气中燃烧,发出淡蓝色火焰
12.对下列实验现象的描述中,与实验事实不相符的是(
)
A.硝酸铵在水中溶解时溶液温度降低
B.盐酸与铁锈反应后溶液呈浅绿色
C.二氧化碳通入澄清石灰水中溶液变浑浊
D.硫磺在氧气中燃烧发出蓝紫色火焰
13.下列做法中,仅利用物理变化原理的是( )
A.用天然气作燃料煮饭
B.用食醋去除暖水瓶中的水垢
C.用活性炭去除冰箱中的异味
D.用稀盐酸去除铁片表面的铁锈
二、实验题
14.根据图所示实验回答问题。
(1)实验①是除去水中不溶性杂质的操作。玻璃棒的作用是_____。
(2)实验②是甲、乙两名同学为测定某土壤的酸碱度,分别取土样与水混合。充分混合并静置后,接下来的操作是_____。若甲同学的测定结果为pH=
9,则乙同学的测定结果应为pH_____(选填“>”“<”或“=”)9。
(3)实验③是验证浓硫酸的_____性的实验。实验现象是_____。
15.按照下图所示实验探究分子的性质。
(1)该实验体现出分子的性质为_____。
(2)A杯中溶液变为红色,说明·解离出来了_____(填离子符号)
三、推断题
16.A﹣I是初中化学中常见的物质,它们之间有如图所示的转化关系(部分反应物、生成物省略)。已知A常用作导线,F、G是元素组成相同的酸,I是一种难溶性碱,H的水溶液呈蓝色。
请回答如下问题:
(1)请写出物质B和G的化学式:B______、G______
(2)请写出下列物质的颜色:A_______、D______
(3)请写出下列转变的化学方程式:
①
E
→
F
:________
②
D
→
H
:________
17.化学就在我们身边,认识和探究身边的化学物质、了解化学的奥秘,是学习化学的重要内容。
(1)A、B、C是三种常见的含钙化合物。它们之间有如图所示的转化关系(部分产物略去):请写出下列物质的化学式:A__________;B_________;C______。
(2)反应①的化学方程式:__________。
(3)我们常用洗涤剂清洗餐具上的油污,这是因为洗涤剂具有
______的功能。
四、计算题
18.将氢氧化钠和氯化钠的混合物19.3g,放入80.7g水中使其完全溶解,再加入100g溶质质量分数为7.3%的稀盐酸,恰好完全反应。试计算:
(1)将上述浓度的稀盐酸100克稀释为溶质质量分数为4%的稀盐酸,需要加入水的质量;
(2)原混合物中氢氧化钠的质量;
(3)反应后所得溶液中溶质的质量。
19.在
200g4.0%的氢氧化钠溶液中加入
150
g
盐酸时溶液
pH=7.求:
(1)所得混合溶液中氯化钠的质量分数________;
(2)若所用盐酸由
36.5%(密度为
1.2
g/cm3)的浓盐酸来配制,需要浓盐酸的体积是多少________?
20.某混合溶液中含有硫酸和盐酸,取该混合溶液20g于烧杯中,不断滴加氢氧化钡溶液,反应过程中烧杯中产生沉淀的质量、溶液pH的变化如图所示(BaCl2溶液呈中性)。求:
(1)完全反应后生成沉淀的质量为_____g;
(2)与盐酸反应的氢氧化钡溶液质量为_______g;
(3)原混合溶液中硫酸的质量分数是多少_____?
参考答案
1.B
2.C
3.B
4.A
5.A
6.B
7.B
8.D
9.D
10.C
11.A
12.B
13.C
14.引流
取上层清液滴在pH试纸上,把试纸显示的颜色与标准比色卡比较,读出pH
>
吸水
烧杯1内壁的水雾较快消失
15.分子在不断运动
OH-
16.O2
H2SO4
紫红色
黑色
SO2+H2O═H2SO3
CuO+H2SO4═CuSO4+H2O
17.CaO
Ca(OH)2
CaCO3
CaO+H2O=Ca(OH)2
乳化
18.(1)82.5克
(2)8克
(3)23克
19.3.3%
16.7mL
20.4.66g
40
9.8%
答案第1页,总2页
