高中化学人教版 选修四 第二章 第一节 化学反应速率19ppt
文档属性
| 名称 | 高中化学人教版 选修四 第二章 第一节 化学反应速率19ppt | 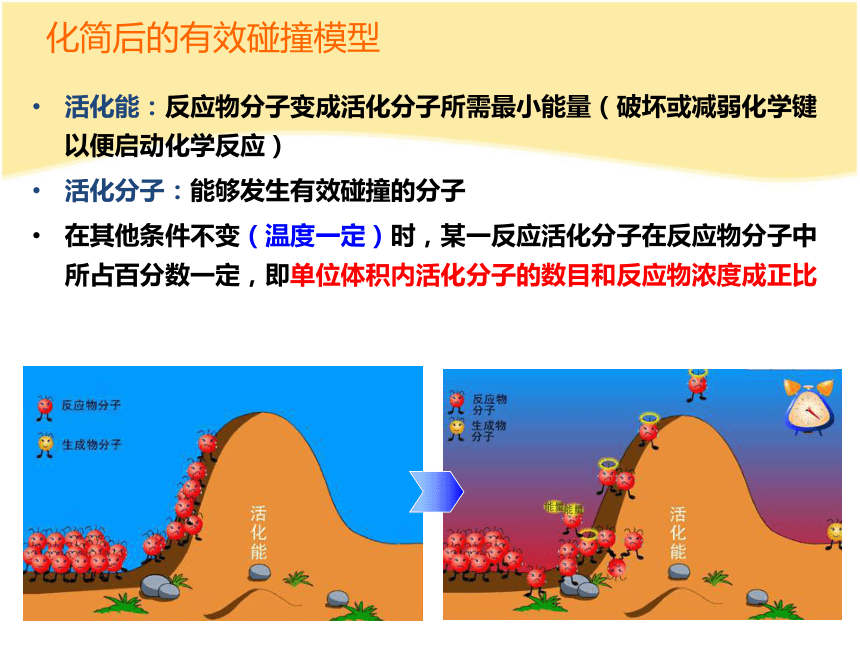 | |
| 格式 | zip | ||
| 文件大小 | 865.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-06-01 21:11:43 | ||
图片预览







文档简介
(共19张PPT)
化简后的有效碰撞模型
活化能:反应物分子变成活化分子所需最小能量(破坏或减弱化学键以便启动化学反应)
活化分子:能够发生有效碰撞的分子
在其他条件不变(温度一定)时,某一反应活化分子在反应物分子中所占百分数一定,即单位体积内活化分子的数目和反应物浓度成正比
有效碰撞:能够发生化学反应的碰撞
化学反应发生的先决条件:
在一定的活化能下,活化分子的有效碰撞
E1:活化能
E2:活化分子变成生成物放出的能量(逆反应的活化能)
△H=E1-E2
第二章
化学反应速率和化学平衡
化学反应的快慢(速率)及影响因素
化学反应的限度(反应物能否全部转变为物)
化学反应进行的方向(推动力)
本章学习内容
第一节
化学反应速率
第二章
化学反应速率和化学平衡
a.钠和钾分别与水反应的现象。
b.比较等物质的量浓度的盐酸和醋酸与大理石反应的快慢。
怎么样来比较和描述不同反应的快慢呢?
化学反应速率是用来衡量化学反应进行快慢程度的一个物理量。
【回忆】
不同的化学反应快慢是不一样的。
通常用单位时间内反应物或生成物的浓度变化来表示。
浓度常用单位
:
时间常用单位:
化学反应速率常用单位:
表达式:
用什么来表示化学反应速率?
s
或
min
mol/L
mol/(L·s)
或
mol/(L·min)
v
=
△c/△t
【例题】在2L的密闭容器中,加入1mol
N2和3mol
H2,发生
N2
+
3H2
=?2NH3
,在2s末时,测得容器中含有0.4mol的NH3,求该反应的化学反应速率。
N2
+
3H2
=?
2
NH3
起始浓度
0.5
1.5
0
浓度变化
0.1
0.3
0.2
v(N2)=0.1/2=0.05mol/(L·s)
v(H2)=0.3/2=0.15mol/(L·s)
v(NH3)=
(0.2-0)/2=0.1mol/(L·s)
观察并回答,分别用三种物质表示的反应速率之间有什么关系?
问题1
2S末浓度
0.4
1.2
0.2
同一个反应,用不同的物质来表示反应速率,数值是不一样的,所以应注明是由哪种物质表示的。
同一反应中,各物质的速率之比等于它们在化学方程式中的化学计量数之比。
如在N2
+
3H2
=?2NH3
中,
v(N2):v(H2):v(NH3)=1:3:2
我们得到的速率是指什么时候的速率?
我们所说的速率是指在整个过程中的平均速率。且均为正值.
结论1
问题2
结论2
常见题型例举
1、用不同的物质来表示反应速率。
例1、反应4NH3
+
5O2
===
4NO
+
6H2O
在5L的密闭容器中进行,30s后,NO的物质的量增加了0.3mol,则此反应的平均速率可表示为:
A、
v
(O2)=0.01
mol/(L·s)
B、
v
(NO)=0.008
mol/(L·s)
C、
v
(H2O)=0.003
mol/(L·s)
D、
v
(NH3)=0.002
mol/(L·s)
v
(NO)=0.3/(5×30)=0.002
mol/(L·s)
2、比较反应速率的大小
例、反应A
+
3B
==
2C
+
2D在四种不同情况下的反应速率分别为
①VA
=
0.15mol·L-1·s-1
②VB
=
0.6mol·L-1·s-1
③Vc
=
0.4mol·L-1·s-1
④VD
=
0.45mol·L-1·s-1
则该反应在不同条件下速率快慢顺序是
。
④﹥
②=
③﹥
①
根据下图回答:
1、反应物是__________.
2、2min内A的平均速率是________
3、写出化学方程式
A、B
2.5mol/(L·min)
3、根据各物质的反应速率之比写出化学方程式。
化学反应的速率是通过实验测定的,常用的测定方法有哪些?P18
(实验2一1)实验分析∶
该实验所用的仪器和药品?
锥形瓶
分液漏斗
玻璃导管
乳胶管
注射器(50ml)
铁架台
量筒(50ml)
胶头滴管
秒表
锌粒、1mol/L硫酸、
4
mol/L硫酸
1、如何检查该装置的气密性?
思考?
2、如果没有注射器,用什么来代替?
3、你还能根据反应速率相关量的哪些变化来测定该反应的反应速率?
(Ⅰ)测定锌与稀硫酸反应的速率的方法有多种,
不同的方法需要测定不同的数据。请根据你设计的
测定方法,填写需要记录的数据及其单位:
①
,单位
;
②
,单位
。
根据你测定的实验数据,处理后可求得_________
(填化学式)的反应速率,单位是__________。
(Ⅱ)若某同学需要收集并测量气体体积应选下图中的 装置
反应时间
min(或s)
生成氢气的体积
L(或mL)
H+,mol?L-1;H2,L?min-1;Zn,g?min-1;
Zn,mol?min-1;H2SO4,mol?L-1?min-1;或其它合理答案。
B
1、把0.6molX气体和0.4molY气体混合于2L容器中,发生反应:3X(g)
+
Y(g)
=
n
Z
(
g)
+
2W(g)
.5min末已生成0.2molW,若测知以Z浓度的变化来表示平均速率0.01mol/(L·min),则
(1)
上述反应Z气体的计量系数n的值是______
(2)
上述反应在5min末时,已用去的Y占原来物质的质量分数是__________
1
25%
2:一定温度下,向一个容积为2L的事先装入催化剂的真空密闭容器中通入1mol氮气和3mol氢气,3min后测得容器内的压强是起始时压强的0.9倍,在此时间内,用氢气的量的变化来表示的该反应的平均反应速率v(H2)是:
(
)
A、0.2mol/(L·min)
B、
0.6mol/(L·min)
C、0.1mol/(L·min)
D、
0.3mol/(L·min)
C
化简后的有效碰撞模型
活化能:反应物分子变成活化分子所需最小能量(破坏或减弱化学键以便启动化学反应)
活化分子:能够发生有效碰撞的分子
在其他条件不变(温度一定)时,某一反应活化分子在反应物分子中所占百分数一定,即单位体积内活化分子的数目和反应物浓度成正比
有效碰撞:能够发生化学反应的碰撞
化学反应发生的先决条件:
在一定的活化能下,活化分子的有效碰撞
E1:活化能
E2:活化分子变成生成物放出的能量(逆反应的活化能)
△H=E1-E2
第二章
化学反应速率和化学平衡
化学反应的快慢(速率)及影响因素
化学反应的限度(反应物能否全部转变为物)
化学反应进行的方向(推动力)
本章学习内容
第一节
化学反应速率
第二章
化学反应速率和化学平衡
a.钠和钾分别与水反应的现象。
b.比较等物质的量浓度的盐酸和醋酸与大理石反应的快慢。
怎么样来比较和描述不同反应的快慢呢?
化学反应速率是用来衡量化学反应进行快慢程度的一个物理量。
【回忆】
不同的化学反应快慢是不一样的。
通常用单位时间内反应物或生成物的浓度变化来表示。
浓度常用单位
:
时间常用单位:
化学反应速率常用单位:
表达式:
用什么来表示化学反应速率?
s
或
min
mol/L
mol/(L·s)
或
mol/(L·min)
v
=
△c/△t
【例题】在2L的密闭容器中,加入1mol
N2和3mol
H2,发生
N2
+
3H2
=?2NH3
,在2s末时,测得容器中含有0.4mol的NH3,求该反应的化学反应速率。
N2
+
3H2
=?
2
NH3
起始浓度
0.5
1.5
0
浓度变化
0.1
0.3
0.2
v(N2)=0.1/2=0.05mol/(L·s)
v(H2)=0.3/2=0.15mol/(L·s)
v(NH3)=
(0.2-0)/2=0.1mol/(L·s)
观察并回答,分别用三种物质表示的反应速率之间有什么关系?
问题1
2S末浓度
0.4
1.2
0.2
同一个反应,用不同的物质来表示反应速率,数值是不一样的,所以应注明是由哪种物质表示的。
同一反应中,各物质的速率之比等于它们在化学方程式中的化学计量数之比。
如在N2
+
3H2
=?2NH3
中,
v(N2):v(H2):v(NH3)=1:3:2
我们得到的速率是指什么时候的速率?
我们所说的速率是指在整个过程中的平均速率。且均为正值.
结论1
问题2
结论2
常见题型例举
1、用不同的物质来表示反应速率。
例1、反应4NH3
+
5O2
===
4NO
+
6H2O
在5L的密闭容器中进行,30s后,NO的物质的量增加了0.3mol,则此反应的平均速率可表示为:
A、
v
(O2)=0.01
mol/(L·s)
B、
v
(NO)=0.008
mol/(L·s)
C、
v
(H2O)=0.003
mol/(L·s)
D、
v
(NH3)=0.002
mol/(L·s)
v
(NO)=0.3/(5×30)=0.002
mol/(L·s)
2、比较反应速率的大小
例、反应A
+
3B
==
2C
+
2D在四种不同情况下的反应速率分别为
①VA
=
0.15mol·L-1·s-1
②VB
=
0.6mol·L-1·s-1
③Vc
=
0.4mol·L-1·s-1
④VD
=
0.45mol·L-1·s-1
则该反应在不同条件下速率快慢顺序是
。
④﹥
②=
③﹥
①
根据下图回答:
1、反应物是__________.
2、2min内A的平均速率是________
3、写出化学方程式
A、B
2.5mol/(L·min)
3、根据各物质的反应速率之比写出化学方程式。
化学反应的速率是通过实验测定的,常用的测定方法有哪些?P18
(实验2一1)实验分析∶
该实验所用的仪器和药品?
锥形瓶
分液漏斗
玻璃导管
乳胶管
注射器(50ml)
铁架台
量筒(50ml)
胶头滴管
秒表
锌粒、1mol/L硫酸、
4
mol/L硫酸
1、如何检查该装置的气密性?
思考?
2、如果没有注射器,用什么来代替?
3、你还能根据反应速率相关量的哪些变化来测定该反应的反应速率?
(Ⅰ)测定锌与稀硫酸反应的速率的方法有多种,
不同的方法需要测定不同的数据。请根据你设计的
测定方法,填写需要记录的数据及其单位:
①
,单位
;
②
,单位
。
根据你测定的实验数据,处理后可求得_________
(填化学式)的反应速率,单位是__________。
(Ⅱ)若某同学需要收集并测量气体体积应选下图中的 装置
反应时间
min(或s)
生成氢气的体积
L(或mL)
H+,mol?L-1;H2,L?min-1;Zn,g?min-1;
Zn,mol?min-1;H2SO4,mol?L-1?min-1;或其它合理答案。
B
1、把0.6molX气体和0.4molY气体混合于2L容器中,发生反应:3X(g)
+
Y(g)
=
n
Z
(
g)
+
2W(g)
.5min末已生成0.2molW,若测知以Z浓度的变化来表示平均速率0.01mol/(L·min),则
(1)
上述反应Z气体的计量系数n的值是______
(2)
上述反应在5min末时,已用去的Y占原来物质的质量分数是__________
1
25%
2:一定温度下,向一个容积为2L的事先装入催化剂的真空密闭容器中通入1mol氮气和3mol氢气,3min后测得容器内的压强是起始时压强的0.9倍,在此时间内,用氢气的量的变化来表示的该反应的平均反应速率v(H2)是:
(
)
A、0.2mol/(L·min)
B、
0.6mol/(L·min)
C、0.1mol/(L·min)
D、
0.3mol/(L·min)
C
