第一节 化学反应与能量变化 第2课时 化学键与化学反应中能量变化的关系 学案
文档属性
| 名称 | 第一节 化学反应与能量变化 第2课时 化学键与化学反应中能量变化的关系 学案 |

|
|
| 格式 | zip | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-06-01 15:03:04 | ||
图片预览


文档简介
中小学教育资源及组卷应用平台
第一节
化学反应与能量变化
第2课时
化学键与化学反应中能量变化的关系
学习目标
1.知道化学能与热能之间的内在联系以及化学能与热能的相互转化。
2.从本质上(微观结构角度)理解化学反应中能量的变化,从而建立起科学的能量变化观。
自主学习
一、化学键与化学反应中能量变化的关系
1.化学键的概念。
化学键是指能够使原子或离子相结合的 ,它包含 和 两种作用。?
2.化学键的断裂、形成与能量的吸收、释放。
断裂化学键为原子或离子需要 (填“吸收”或“释放”,下同)能量;形成化学键需要 能量;相同条件下,断裂或形成同一种化学键吸收和释放的能量 (填“相等”或“不等”)。?
3.旧化学键的断裂和新化学键的形成是化学反应中能量变化的主要原因。
一个确定的化学反应在发生过程中是吸收能量还是放出能量,决定于 的相对大小。?
4.化学反应的热效应和键能的关系?
二、反应物、生成物的总能量与化学反应中能量变化的关系
根据能量守恒定律,如果反应物总能量高于生成物总能量则反应 (填“放热”或“吸热”,下同);如果反应物总能量低于生成物总能量则反应 。?
课内探究
一、化学键与化学反应中能量变化的关系
【交流研讨】键能概念:拆开 所吸收的能量或形成 所释放的能量。单位: 。1
mol
H2中含有1
mol
H—H键,在25
℃、101
kPa条件下,由H原子形成1
mol
H—H键要放出436
kJ的能量,而断开1
mol
H—H键重新变为H原子要 的能量。?
【迁移应用】在反应H2+Cl22HCl中,已知H—H键的键能为436
kJ/mol,Cl—Cl键的键能为247
kJ/mol,H—Cl键的键能为431
kJ/mol,判断该反应是 反应?并解释原因。?
二、反应物、生成物的总能量与化学反应中能量变化的关系
【交流研讨】化学反应中能量变化与反应物的总能量、生成物的总能量的相对大小的关系。
∑E(反应物)>∑E(生成物)—— 能量;?
∑E(反应物)<∑E(生成物)—— 能量。?
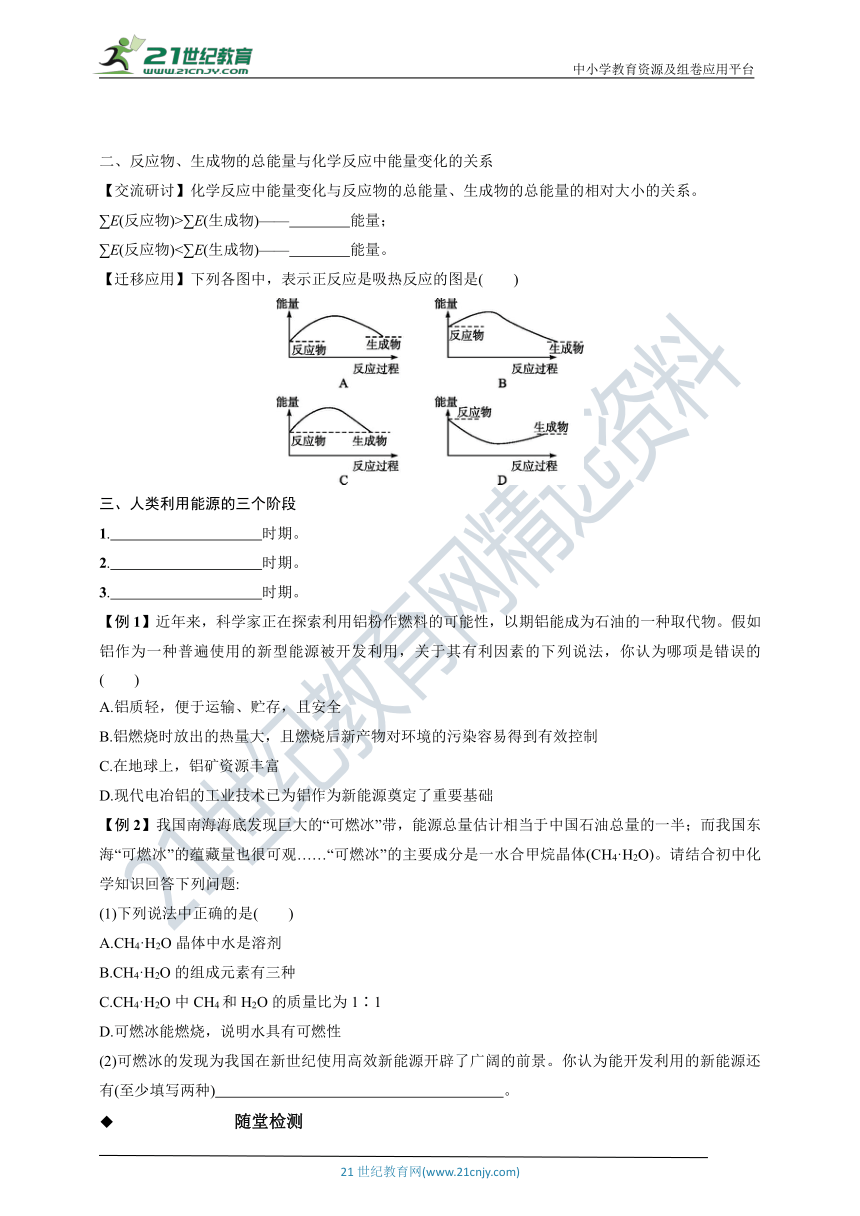
【迁移应用】下列各图中,表示正反应是吸热反应的图是( )
三、人类利用能源的三个阶段
1. 时期。?
2. 时期。?
3. 时期。?
【例1】近年来,科学家正在探索利用铝粉作燃料的可能性,以期铝能成为石油的一种取代物。假如铝作为一种普遍使用的新型能源被开发利用,关于其有利因素的下列说法,你认为哪项是错误的( )
A.铝质轻,便于运输、贮存,且安全
B.铝燃烧时放出的热量大,且燃烧后新产物对环境的污染容易得到有效控制
C.在地球上,铝矿资源丰富
D.现代电冶铝的工业技术已为铝作为新能源奠定了重要基础
【例2】我国南海海底发现巨大的“可燃冰”带,能源总量估计相当于中国石油总量的一半;而我国东海“可燃冰”的蕴藏量也很可观……“可燃冰”的主要成分是一水合甲烷晶体(CH4·H2O)。请结合初中化学知识回答下列问题:
(1)下列说法中正确的是( )
A.CH4·H2O晶体中水是溶剂
B.CH4·H2O的组成元素有三种
C.CH4·H2O中CH4和H2O的质量比为1∶1
D.可燃冰能燃烧,说明水具有可燃性
(2)可燃冰的发现为我国在新世纪使用高效新能源开辟了广阔的前景。你认为能开发利用的新能源还有(至少填写两种) 。
随堂检测
1.天然气、石油、煤等在地球上的蕴藏量是有限的,因此:①可利用电解水的方法得到氢气作能源;②可用酒精作能源;③砍伐树木作能源;④应开发太阳能、核能等新的能源。上述说法正确的是( )
A.只有①
B.①和④
C.②和③
D.只有④
2.下列说法正确的是( )
A.物质发生化学反应都伴随着能量变化
B.伴有能量变化的物质变化都是化学变化
C.在一个确定的化学反应关系中,反应物的总能量与生成物的总能量一定不同
D.在一个确定的化学反应关系中,反应物的总能量总是高于生成物的总能量
3.下列选项中说明乙醇作为燃料的优点的是( )
①燃烧时发生氧化反应 ②充分燃烧的产物不污染环境 ③乙醇是一种再生能源 ④燃烧时放出大量热量
A.①②③
B.①②④
C.①③④
D.②③④
4.航天飞机用铝粉与高氯酸铵(NH4ClO4)的混合物为固体燃料,点燃时铝粉被氧化放热引发高氯酸铵反应,其化学方程式可表示为:
2NH4ClO4N2↑+4H2O+Cl2↑+2O2↑
下列对此反应的叙述中错误的是( )
A.上述反应属于分解反应
B.上述反应瞬间产生大量高温气体推动航天飞机飞行
C.反应从能量变化上说,主要是化学能转变为热能和动能
D.在反应中高氯酸铵只起氧化剂作用
5.已知某反应是放热反应,下列说法正确的是( )
A.该反应发生时,一定不需要加热
B.该反应中反应物的总能量小于生成物的总能量
C.该反应中反应物的总能量大于生成物的总能量
D.如果该反应开始后停止加热,反应一定能继续进行
6.1
mol
H—I键的键能是299
kJ/mol。1
mol
I—I键的键能是151
kJ/mol,1
mol
H—H键的键能是436
kJ/mol,则H2(g)+I2(g)2HI(g)的反应是( )
A.吸热反应
B.放热反应
C.分解反应
D.可逆反应
参考答案
自主学习
一、1.作用力 静电吸引 静电排斥
2.吸收 释放 相等
3.旧键断裂吸收的能量和新键形成释放的能量
4.在化学反应中,从反应物分子转变为生成物分子,各原子内部并没有多少变化,但原子间的结合方式发生了改变。在这个过程中,反应物分子中的化学键部分或全部遭到破坏,生成物分子中的新化学键形成了。在破坏旧化学键时,需要能量来克服原子间的相互作用,在形成新化学键时,由于原子间的相互作用而放出能量,化学反应的热效应来源于反应过程中断裂旧化学键并形成新化学键时的能量变化。化学键键能的大小可粗略计算化学反应的热效应。化学反应的热效应=反应物的键能总和-生成物的键能总和。
二、放热 吸热
课内探究
一、【交流研讨】1
mol化学键 1
mol化学键 kJ/mol 吸收436
kJ
【迁移应用】
答案:放热
原因:(1)化学键断裂时需要吸收能量。如果1
mol
H2与1
mol
Cl2发生反应,断裂化学键吸收总能量为436
kJ+247
kJ=683
kJ;
(2)化学键形成时需要释放能量。生成2
mol
HCl释放总能量为431
kJ+431
kJ=862
kJ;
(3)化学键形成时需要释放能量大于化学键断裂时需要吸收能量,故反应放热,放出的热量为862
kJ-683
kJ=179
kJ。
二、【交流研讨】释放 吸收
【迁移应用】解析:依据∑E(反应物)>∑E(生成物)——释放能量;∑E(反应物)<∑E(生成物)——吸收能量,可知A,∑E(反应物)<∑E(生成物)——吸收能量;B、D,∑E(反应物)>∑E(生成物)——释放能量;C,∑E(反应物)=∑E(生成物)既不吸热也不放热,且这类反应事实上并不存在。
答案:A
三、1.柴草 2.化石能源 3.多能源结构
【例1】解析:铝质轻,燃烧时放热多,在地壳中是含量最大的金属元素,铝矿资源丰富,这些都是用铝作为新型燃料的有利条件,但是电冶铝本身需要消耗大量的能量,从这一点考虑,如果没有开发出新的冶炼金属铝的技术,则用铝作为新能源的做法是不合理的。所以D说法错误。
答案:D
【例2】解析:(1)溶剂是能够溶解其他物质的物质,溶剂与溶质间没有固定的组成,而CH4·H2O的组成固定,故A不正确。CH4中含C、H两种元素,H2O中含H、O两种元素,故CH4·H2O由C、H、O三种元素组成,B正确。CH4·H2O分子中CH4与H2O的物质的量之比为1∶1,则C不正确。CH4·H2O可燃是由于分解产生CH4的原因,故D不正确。
(2)新能源是指以新技术为基础,系统开发利用的能源包括太阳能、生物能、风能、地热能、氢能源等。
答案:(1)B (2)太阳能、潮汐能、水能、风能、核能、地热、氢能源等
随堂检测
1.D 2.AC 3.D 4.D 5.CD 6.BD
21世纪教育网
www.21cnjy.com
精品试卷·第
2
页
(共
2
页)
HYPERLINK
"http://21世纪教育网(www.21cnjy.com)
"
21世纪教育网(www.21cnjy.com)
第一节
化学反应与能量变化
第2课时
化学键与化学反应中能量变化的关系
学习目标
1.知道化学能与热能之间的内在联系以及化学能与热能的相互转化。
2.从本质上(微观结构角度)理解化学反应中能量的变化,从而建立起科学的能量变化观。
自主学习
一、化学键与化学反应中能量变化的关系
1.化学键的概念。
化学键是指能够使原子或离子相结合的 ,它包含 和 两种作用。?
2.化学键的断裂、形成与能量的吸收、释放。
断裂化学键为原子或离子需要 (填“吸收”或“释放”,下同)能量;形成化学键需要 能量;相同条件下,断裂或形成同一种化学键吸收和释放的能量 (填“相等”或“不等”)。?
3.旧化学键的断裂和新化学键的形成是化学反应中能量变化的主要原因。
一个确定的化学反应在发生过程中是吸收能量还是放出能量,决定于 的相对大小。?
4.化学反应的热效应和键能的关系?
二、反应物、生成物的总能量与化学反应中能量变化的关系
根据能量守恒定律,如果反应物总能量高于生成物总能量则反应 (填“放热”或“吸热”,下同);如果反应物总能量低于生成物总能量则反应 。?
课内探究
一、化学键与化学反应中能量变化的关系
【交流研讨】键能概念:拆开 所吸收的能量或形成 所释放的能量。单位: 。1
mol
H2中含有1
mol
H—H键,在25
℃、101
kPa条件下,由H原子形成1
mol
H—H键要放出436
kJ的能量,而断开1
mol
H—H键重新变为H原子要 的能量。?
【迁移应用】在反应H2+Cl22HCl中,已知H—H键的键能为436
kJ/mol,Cl—Cl键的键能为247
kJ/mol,H—Cl键的键能为431
kJ/mol,判断该反应是 反应?并解释原因。?
二、反应物、生成物的总能量与化学反应中能量变化的关系
【交流研讨】化学反应中能量变化与反应物的总能量、生成物的总能量的相对大小的关系。
∑E(反应物)>∑E(生成物)—— 能量;?
∑E(反应物)<∑E(生成物)—— 能量。?
【迁移应用】下列各图中,表示正反应是吸热反应的图是( )
三、人类利用能源的三个阶段
1. 时期。?
2. 时期。?
3. 时期。?
【例1】近年来,科学家正在探索利用铝粉作燃料的可能性,以期铝能成为石油的一种取代物。假如铝作为一种普遍使用的新型能源被开发利用,关于其有利因素的下列说法,你认为哪项是错误的( )
A.铝质轻,便于运输、贮存,且安全
B.铝燃烧时放出的热量大,且燃烧后新产物对环境的污染容易得到有效控制
C.在地球上,铝矿资源丰富
D.现代电冶铝的工业技术已为铝作为新能源奠定了重要基础
【例2】我国南海海底发现巨大的“可燃冰”带,能源总量估计相当于中国石油总量的一半;而我国东海“可燃冰”的蕴藏量也很可观……“可燃冰”的主要成分是一水合甲烷晶体(CH4·H2O)。请结合初中化学知识回答下列问题:
(1)下列说法中正确的是( )
A.CH4·H2O晶体中水是溶剂
B.CH4·H2O的组成元素有三种
C.CH4·H2O中CH4和H2O的质量比为1∶1
D.可燃冰能燃烧,说明水具有可燃性
(2)可燃冰的发现为我国在新世纪使用高效新能源开辟了广阔的前景。你认为能开发利用的新能源还有(至少填写两种) 。
随堂检测
1.天然气、石油、煤等在地球上的蕴藏量是有限的,因此:①可利用电解水的方法得到氢气作能源;②可用酒精作能源;③砍伐树木作能源;④应开发太阳能、核能等新的能源。上述说法正确的是( )
A.只有①
B.①和④
C.②和③
D.只有④
2.下列说法正确的是( )
A.物质发生化学反应都伴随着能量变化
B.伴有能量变化的物质变化都是化学变化
C.在一个确定的化学反应关系中,反应物的总能量与生成物的总能量一定不同
D.在一个确定的化学反应关系中,反应物的总能量总是高于生成物的总能量
3.下列选项中说明乙醇作为燃料的优点的是( )
①燃烧时发生氧化反应 ②充分燃烧的产物不污染环境 ③乙醇是一种再生能源 ④燃烧时放出大量热量
A.①②③
B.①②④
C.①③④
D.②③④
4.航天飞机用铝粉与高氯酸铵(NH4ClO4)的混合物为固体燃料,点燃时铝粉被氧化放热引发高氯酸铵反应,其化学方程式可表示为:
2NH4ClO4N2↑+4H2O+Cl2↑+2O2↑
下列对此反应的叙述中错误的是( )
A.上述反应属于分解反应
B.上述反应瞬间产生大量高温气体推动航天飞机飞行
C.反应从能量变化上说,主要是化学能转变为热能和动能
D.在反应中高氯酸铵只起氧化剂作用
5.已知某反应是放热反应,下列说法正确的是( )
A.该反应发生时,一定不需要加热
B.该反应中反应物的总能量小于生成物的总能量
C.该反应中反应物的总能量大于生成物的总能量
D.如果该反应开始后停止加热,反应一定能继续进行
6.1
mol
H—I键的键能是299
kJ/mol。1
mol
I—I键的键能是151
kJ/mol,1
mol
H—H键的键能是436
kJ/mol,则H2(g)+I2(g)2HI(g)的反应是( )
A.吸热反应
B.放热反应
C.分解反应
D.可逆反应
参考答案
自主学习
一、1.作用力 静电吸引 静电排斥
2.吸收 释放 相等
3.旧键断裂吸收的能量和新键形成释放的能量
4.在化学反应中,从反应物分子转变为生成物分子,各原子内部并没有多少变化,但原子间的结合方式发生了改变。在这个过程中,反应物分子中的化学键部分或全部遭到破坏,生成物分子中的新化学键形成了。在破坏旧化学键时,需要能量来克服原子间的相互作用,在形成新化学键时,由于原子间的相互作用而放出能量,化学反应的热效应来源于反应过程中断裂旧化学键并形成新化学键时的能量变化。化学键键能的大小可粗略计算化学反应的热效应。化学反应的热效应=反应物的键能总和-生成物的键能总和。
二、放热 吸热
课内探究
一、【交流研讨】1
mol化学键 1
mol化学键 kJ/mol 吸收436
kJ
【迁移应用】
答案:放热
原因:(1)化学键断裂时需要吸收能量。如果1
mol
H2与1
mol
Cl2发生反应,断裂化学键吸收总能量为436
kJ+247
kJ=683
kJ;
(2)化学键形成时需要释放能量。生成2
mol
HCl释放总能量为431
kJ+431
kJ=862
kJ;
(3)化学键形成时需要释放能量大于化学键断裂时需要吸收能量,故反应放热,放出的热量为862
kJ-683
kJ=179
kJ。
二、【交流研讨】释放 吸收
【迁移应用】解析:依据∑E(反应物)>∑E(生成物)——释放能量;∑E(反应物)<∑E(生成物)——吸收能量,可知A,∑E(反应物)<∑E(生成物)——吸收能量;B、D,∑E(反应物)>∑E(生成物)——释放能量;C,∑E(反应物)=∑E(生成物)既不吸热也不放热,且这类反应事实上并不存在。
答案:A
三、1.柴草 2.化石能源 3.多能源结构
【例1】解析:铝质轻,燃烧时放热多,在地壳中是含量最大的金属元素,铝矿资源丰富,这些都是用铝作为新型燃料的有利条件,但是电冶铝本身需要消耗大量的能量,从这一点考虑,如果没有开发出新的冶炼金属铝的技术,则用铝作为新能源的做法是不合理的。所以D说法错误。
答案:D
【例2】解析:(1)溶剂是能够溶解其他物质的物质,溶剂与溶质间没有固定的组成,而CH4·H2O的组成固定,故A不正确。CH4中含C、H两种元素,H2O中含H、O两种元素,故CH4·H2O由C、H、O三种元素组成,B正确。CH4·H2O分子中CH4与H2O的物质的量之比为1∶1,则C不正确。CH4·H2O可燃是由于分解产生CH4的原因,故D不正确。
(2)新能源是指以新技术为基础,系统开发利用的能源包括太阳能、生物能、风能、地热能、氢能源等。
答案:(1)B (2)太阳能、潮汐能、水能、风能、核能、地热、氢能源等
随堂检测
1.D 2.AC 3.D 4.D 5.CD 6.BD
21世纪教育网
www.21cnjy.com
精品试卷·第
2
页
(共
2
页)
HYPERLINK
"http://21世纪教育网(www.21cnjy.com)
"
21世纪教育网(www.21cnjy.com)
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
