6.1化学反应与能量变化 第2课时 (课件37页)
文档属性
| 名称 | 6.1化学反应与能量变化 第2课时 (课件37页) |  | |
| 格式 | zip | ||
| 文件大小 | 5.4MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-06-01 14:39:47 | ||
图片预览








文档简介
(共37张PPT)
第一节
化学反应与能量变化(第2课时)
第六章
化学反应与能量
一、导入新课
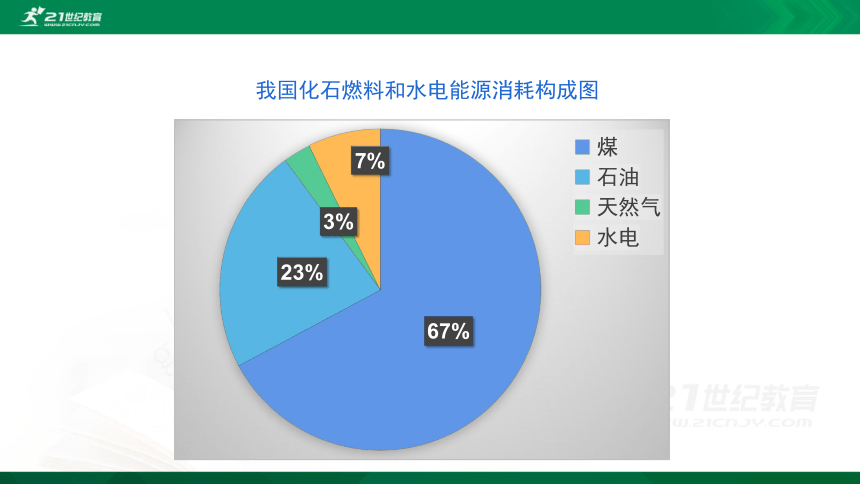
我国化石燃料和水电能源消耗构成图
一、导入新课
能源是人类赖以生存和发展的物质基础,我们每时每刻、分分秒秒都离不开它。迄今为止,人类所能利用的能源主要是化学能、电能、以及核能等等。但是,由于人类大量开发和浪费资源,造成了资源的不合理利用从而引发了不可避免的能源危机。
二、推进新课
化学变化的特征
化学变化中除有新物质生成外,常伴随着放热、发光、变色、放出气体、生成沉淀等现象发生。
利用化学反应:
二、是利用反应中的能量
一、是制取物质
能量
【提问】化学反应过程中为什么会有能量变化?
为什么有的化学反应释放能量,有的化学反应吸收能量?
二、推进新课
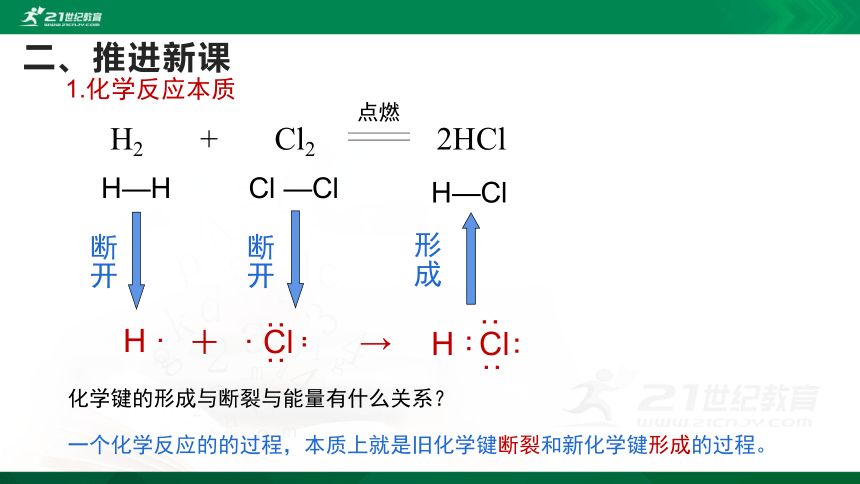
以氢气在氯气中燃烧为例,用化学键的观点分析反应的本质过程。
1.化学反应的本质是什么?
化学键:使离子相结合或原子相结合的作用。
键能:拆开1
mol某键所需的能量或形成1
mol该化学键所释放的能量叫键能。单位:kJ/mol。
微观:化学键与化学反应中能量变化的关系
二、推进新课
H
·
··
·
Cl
··
:
+
→
Cl
··
··
H
··
··
H2
+
Cl2
2HCl
H—H
Cl
—Cl
H—Cl
断开
断开
点燃
一个化学反应的的过程,本质上就是旧化学键断裂和新化学键形成的过程。
形成
1.化学反应本质
化学键的形成与断裂与能量有什么关系?
二、推进新课
H
·
··
·
Cl
··
:
+
→
Cl
··
··
H
··
··
H2
+
Cl2
2HCl
H—H
Cl
—Cl
H—Cl
断开
断开
点燃
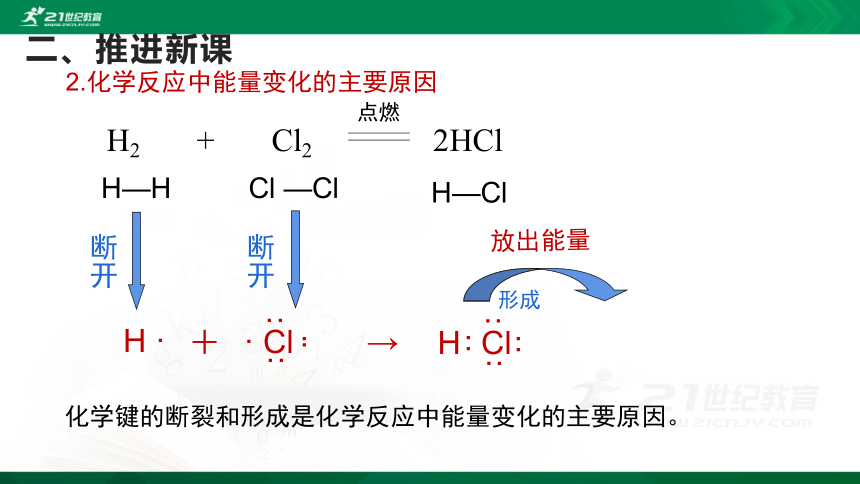
化学键的断裂和形成是化学反应中能量变化的主要原因。
形成
放出能量
2.化学反应中能量变化的主要原因
二、推进新课
3.从化学键的观点来分析能量的变化
一个化学反应的的过程,本质上就是旧化学键断裂和新化学键形成的过程。
吸收能量
放出能量
【提问】一个化学反应是否为放热还是吸热取决于什么呢?
取决于所有断键吸收的总能量与所有形成新键放出的总能量的相对大小
二、推进新课
实验测得,在25℃、101
kPa条件下,将1
mol
H2
(H-H)变为2
mol
H原子需吸收436
kJ能量,而2
mol
H原子变成1
mol
H2
(H-H)放出436
kJ能量,这个能量就是H-H键的键能。
吸收能量
<
放出能量
反应放热
吸收能量
>
放出能量
反应吸热
二、推进新课
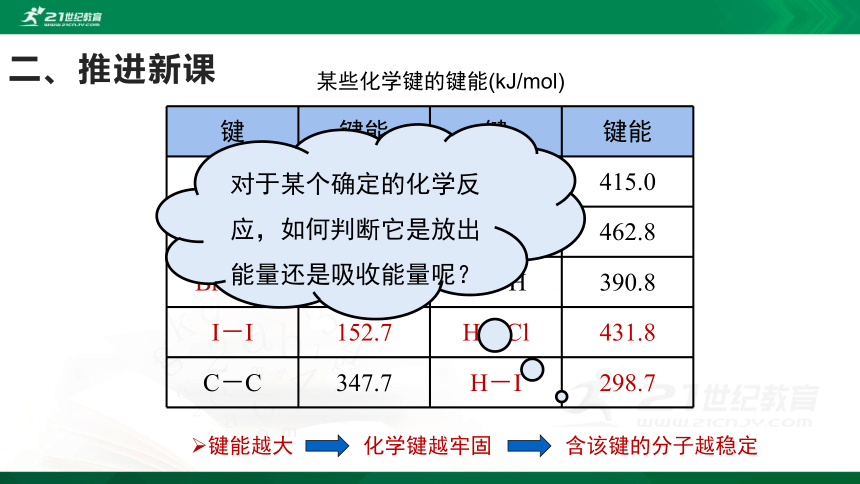
某些化学键的键能(kJ/mol)
键
键能
键
键能
H-H
436
C-H
415.0
Cl-Cl
242.7
O-H
462.8
Br-Br
193.7
N-H
390.8
I-I
152.7
H-Cl
431.8
C-C
347.7
H-I
298.7
对于某个确定的化学反应,如何判断它是放出能量还是吸收能量呢?
键能越大
含该键的分子越稳定
化学键越牢固
二、推进新课
放热
(1)化学键断裂时需要吸收能量。吸收的总能量为436
kJ+247
kJ=683
kJ;
(2)化学键形成时需要释放能量。释放的总能量为431
kJ+431
kJ=862
kJ;
(3)反应中放出的热量的计算:862
kJ
-
683
kJ=179
kJ
判断该反应是
反应
1mol
H-H
键断裂所需能量
436kJ
1mol
Cl-Cl
键断裂所需能量
243kJ
1mol
H-Cl
键形成放出能量
431kJ
在反应H2
+
Cl2
2HCl中
点燃
二、推进新课
?H1
?H2
?H1键断裂吸收的能量
t
?H2键生成释放的能量
若?H2
-
?H1>
0
反应放热
能量
H-H
Cl-Cl
2H
2Cl
2HCl
反应过程
0
H2
+
Cl2
2HCl
点燃
4.反应中能量变化示意图
二、推进新课
?H1
?H2
?H1键断裂吸收的能量
?H2键生成释放的能量
若?H2
-
?H1<
0
反应吸热
能量
反应物
过渡态
生成物
反应过程
0
二、推进新课
放出热量
能量
反应物
生成物
反应过程
0
吸收热量
能量
反应物
生成物
反应过程
0
放热反应
吸热反应
二、推进新课
微观:化学反应中能量变化的原因——化学键的断裂和形成。
①断开化学键吸收的总能量小于形成化学键释放出的总能量,反应放出能量。
②断开化学键吸收的总能量大于形成化学键释放出的总能量,反应吸收能量。
【小结】
二、推进新课
宏观:化学反应中能量变化的原因
——反应物和生成物的总能量相对大小
反应物本身所具有的总能量和生成物本身所具有的总能量之间的相对大小与反应放热、吸热的关系分别如何?(提示:可从能量守恒角度分析)
放出热量
能量
反应物
生成物
反应过程
0
①反应物的总能量大于生成物的总能量,反应
。
放出能量
二、推进新课
二、推进新课
吸收热量
能量
反应物
生成物
反应过程
0
②反应物总能量小于生成物总能量,反应吸收能量。
二、推进新课
二、推进新课
①反应物的总能量
大于
生成物的总能量,反应放出能量。
②反应物的总能量
小于
生成物的总能量,反应吸收能量。
化学反应中的能量变化遵循能量守恒定律。
宏观:化学反应中能量变化的原因
——反应物和生成物的总能量相对大小
【小结】
二、推进新课
【小结】
1.化学反应的特点是有新物质生成,生成物和反应物总能量不同。
2.反应中要遵循能量守恒。
3.反应物与生成物的能量差若以热能形式表现即为放热和吸热。如果二者能量比较接近,则放热和吸热不明显。
二、推进新课
反应物的总能量高
生成物的总能量低
反应物的总能量
=
生成物的总能量
+
放出的热量
生成物的总能量
=
反应物的总能量
+
吸收的热量
化学反应的过程,可以看成是能量的“贮存”或“释放”的过程
反应物的总能量低
生成物的总能量高
放热反应
吸热反应
二、推进新课
【规律】
一个确定的化学反应在发生过程中是吸收能量还是放出能量,决定于反应物的总能量与生成物的总能量的相对大小。
(1)如果反应物所具有的总能量高于生成物所具有的总能量,那么在发生化学反应时,就有部分能量以热的形式释放出来;
∑E(反应物)>∑E(生成物)——放出能量
(2)如果反应物所具有的总能量低于生成物所具有的总能量,那么在发生化学反应时,反应物就需要吸收能量,才能转化为生成物。
∑E(反应物)<∑E(生成物)——吸收能量
二、推进新课
能量公式化
E(反应物)=E(生成物)+Q
(能量守恒定律)
E(反应物)-E(生成物)=Q
Q
>
0为放热反应
Q
<
0为吸热反应
二、推进新课
人类利用能源的三个阶段
二、推进新课
柴草时期(火的发现至18世纪产业革命)
以树枝杂草为主要能源。通过火(燃烧)的光和热推动了人类文明的进步,使人类告别“茹毛饮血”、采集野果的生活。
烧陶
炼丹
二、推进新课
化石能源时期
(18世纪中期至现代)
以煤、石油、天然气为主要能源(仍然是利用燃烧反应所释放的热能)
煤的燃烧
气缸中燃料的燃烧
二、推进新课
多能源结构时期
太阳能、风能、潮汐能、核能
二、推进新课
在101.3kPa,25℃条件下,断开1molAB为A、B时吸收的能量称为A-B键的键能。
【补充】键能
通常,键能越大,键越牢固,由该键构成的分子也愈稳定,该分子能量就愈低。
Q=反应物的键能之和-生成物的键能之和
Q
>
0,吸热
Q<
0,放热
注意:键能
≠
键所具有的能量
三、课堂练习
【思考】在25℃和101kPa的条件下,
即:由1mol的H2和1mol的F2,生成2molHF会释放出:
2
×
565kJ
-
436kJ
-
155kJ
=
539kJ
H2
+
F2
2HF
kJ
F
-
F
F
+
F
吸收155kJ/mol
H
-
H
H
+
H
吸收436kJ/mol
放出539
H
+
F
H-F
放出565kJ/mol
三、课堂练习
1.在反应H2
+
Cl2
=2HCl中,已知H-H键能为436kJ,Cl-Cl键能为247kJ,H-Cl键能为431kJ,判断该反应是(
)
A.
吸热反应
B.
放热反应
C.
吸收179kJ热量
D.放出179kJ热量
BD
三、课堂练习
2.已知反应A+B=C+D为放热反应,对该反应的下列说法中正确的是(
)
A.
A的能量一定高于C
B.
B的能量一定高于D
C.
A和B的总能量一定高于C和D的总能量
D.
该反应为放热反应,故不必加热就一定能发生
C
三、课堂练习
3.下列说法中正确的是(
)
A.物质发生化学反应都伴随着能量的变化
B.伴有能量变化的物质变化都是化学变化
C.在一个确定的化学反应关系中,反应物的总能量与生成物的总能量一定不同
D.所有物质的内部都“储存”有能量,而且这些能量都是相等的
AC
四、课堂小结
第2课时
化学键与化学反应中能量变化的关系
一、化学能与热能的相互转化
二、化学键与化学反应中能量变化的关系
1.化学键的断裂和形成是化学反应中能量变化的主要原因
2.
∑E(反应物)
>
∑E(生成物)——放出能量
∑E(反应物)
<
∑E(生成物)——吸收能量
三、人类利用能源的三个阶段
化学反应
放热反应:放出热的化学反应
吸热反应:吸收热的化学反应
再
见
谢谢
21世纪教育网(www.21cnjy.com)
中小学教育资源网站
有大把高质量资料?一线教师?一线教研员?
欢迎加入21世纪教育网教师合作团队!!月薪过万不是梦!!
详情请看:
https://www.21cnjy.com/help/help_extract.php
第一节
化学反应与能量变化(第2课时)
第六章
化学反应与能量
一、导入新课
我国化石燃料和水电能源消耗构成图
一、导入新课
能源是人类赖以生存和发展的物质基础,我们每时每刻、分分秒秒都离不开它。迄今为止,人类所能利用的能源主要是化学能、电能、以及核能等等。但是,由于人类大量开发和浪费资源,造成了资源的不合理利用从而引发了不可避免的能源危机。
二、推进新课
化学变化的特征
化学变化中除有新物质生成外,常伴随着放热、发光、变色、放出气体、生成沉淀等现象发生。
利用化学反应:
二、是利用反应中的能量
一、是制取物质
能量
【提问】化学反应过程中为什么会有能量变化?
为什么有的化学反应释放能量,有的化学反应吸收能量?
二、推进新课
以氢气在氯气中燃烧为例,用化学键的观点分析反应的本质过程。
1.化学反应的本质是什么?
化学键:使离子相结合或原子相结合的作用。
键能:拆开1
mol某键所需的能量或形成1
mol该化学键所释放的能量叫键能。单位:kJ/mol。
微观:化学键与化学反应中能量变化的关系
二、推进新课
H
·
··
·
Cl
··
:
+
→
Cl
··
··
H
··
··
H2
+
Cl2
2HCl
H—H
Cl
—Cl
H—Cl
断开
断开
点燃
一个化学反应的的过程,本质上就是旧化学键断裂和新化学键形成的过程。
形成
1.化学反应本质
化学键的形成与断裂与能量有什么关系?
二、推进新课
H
·
··
·
Cl
··
:
+
→
Cl
··
··
H
··
··
H2
+
Cl2
2HCl
H—H
Cl
—Cl
H—Cl
断开
断开
点燃
化学键的断裂和形成是化学反应中能量变化的主要原因。
形成
放出能量
2.化学反应中能量变化的主要原因
二、推进新课
3.从化学键的观点来分析能量的变化
一个化学反应的的过程,本质上就是旧化学键断裂和新化学键形成的过程。
吸收能量
放出能量
【提问】一个化学反应是否为放热还是吸热取决于什么呢?
取决于所有断键吸收的总能量与所有形成新键放出的总能量的相对大小
二、推进新课
实验测得,在25℃、101
kPa条件下,将1
mol
H2
(H-H)变为2
mol
H原子需吸收436
kJ能量,而2
mol
H原子变成1
mol
H2
(H-H)放出436
kJ能量,这个能量就是H-H键的键能。
吸收能量
<
放出能量
反应放热
吸收能量
>
放出能量
反应吸热
二、推进新课
某些化学键的键能(kJ/mol)
键
键能
键
键能
H-H
436
C-H
415.0
Cl-Cl
242.7
O-H
462.8
Br-Br
193.7
N-H
390.8
I-I
152.7
H-Cl
431.8
C-C
347.7
H-I
298.7
对于某个确定的化学反应,如何判断它是放出能量还是吸收能量呢?
键能越大
含该键的分子越稳定
化学键越牢固
二、推进新课
放热
(1)化学键断裂时需要吸收能量。吸收的总能量为436
kJ+247
kJ=683
kJ;
(2)化学键形成时需要释放能量。释放的总能量为431
kJ+431
kJ=862
kJ;
(3)反应中放出的热量的计算:862
kJ
-
683
kJ=179
kJ
判断该反应是
反应
1mol
H-H
键断裂所需能量
436kJ
1mol
Cl-Cl
键断裂所需能量
243kJ
1mol
H-Cl
键形成放出能量
431kJ
在反应H2
+
Cl2
2HCl中
点燃
二、推进新课
?H1
?H2
?H1键断裂吸收的能量
t
?H2键生成释放的能量
若?H2
-
?H1>
0
反应放热
能量
H-H
Cl-Cl
2H
2Cl
2HCl
反应过程
0
H2
+
Cl2
2HCl
点燃
4.反应中能量变化示意图
二、推进新课
?H1
?H2
?H1键断裂吸收的能量
?H2键生成释放的能量
若?H2
-
?H1<
0
反应吸热
能量
反应物
过渡态
生成物
反应过程
0
二、推进新课
放出热量
能量
反应物
生成物
反应过程
0
吸收热量
能量
反应物
生成物
反应过程
0
放热反应
吸热反应
二、推进新课
微观:化学反应中能量变化的原因——化学键的断裂和形成。
①断开化学键吸收的总能量小于形成化学键释放出的总能量,反应放出能量。
②断开化学键吸收的总能量大于形成化学键释放出的总能量,反应吸收能量。
【小结】
二、推进新课
宏观:化学反应中能量变化的原因
——反应物和生成物的总能量相对大小
反应物本身所具有的总能量和生成物本身所具有的总能量之间的相对大小与反应放热、吸热的关系分别如何?(提示:可从能量守恒角度分析)
放出热量
能量
反应物
生成物
反应过程
0
①反应物的总能量大于生成物的总能量,反应
。
放出能量
二、推进新课
二、推进新课
吸收热量
能量
反应物
生成物
反应过程
0
②反应物总能量小于生成物总能量,反应吸收能量。
二、推进新课
二、推进新课
①反应物的总能量
大于
生成物的总能量,反应放出能量。
②反应物的总能量
小于
生成物的总能量,反应吸收能量。
化学反应中的能量变化遵循能量守恒定律。
宏观:化学反应中能量变化的原因
——反应物和生成物的总能量相对大小
【小结】
二、推进新课
【小结】
1.化学反应的特点是有新物质生成,生成物和反应物总能量不同。
2.反应中要遵循能量守恒。
3.反应物与生成物的能量差若以热能形式表现即为放热和吸热。如果二者能量比较接近,则放热和吸热不明显。
二、推进新课
反应物的总能量高
生成物的总能量低
反应物的总能量
=
生成物的总能量
+
放出的热量
生成物的总能量
=
反应物的总能量
+
吸收的热量
化学反应的过程,可以看成是能量的“贮存”或“释放”的过程
反应物的总能量低
生成物的总能量高
放热反应
吸热反应
二、推进新课
【规律】
一个确定的化学反应在发生过程中是吸收能量还是放出能量,决定于反应物的总能量与生成物的总能量的相对大小。
(1)如果反应物所具有的总能量高于生成物所具有的总能量,那么在发生化学反应时,就有部分能量以热的形式释放出来;
∑E(反应物)>∑E(生成物)——放出能量
(2)如果反应物所具有的总能量低于生成物所具有的总能量,那么在发生化学反应时,反应物就需要吸收能量,才能转化为生成物。
∑E(反应物)<∑E(生成物)——吸收能量
二、推进新课
能量公式化
E(反应物)=E(生成物)+Q
(能量守恒定律)
E(反应物)-E(生成物)=Q
Q
>
0为放热反应
Q
<
0为吸热反应
二、推进新课
人类利用能源的三个阶段
二、推进新课
柴草时期(火的发现至18世纪产业革命)
以树枝杂草为主要能源。通过火(燃烧)的光和热推动了人类文明的进步,使人类告别“茹毛饮血”、采集野果的生活。
烧陶
炼丹
二、推进新课
化石能源时期
(18世纪中期至现代)
以煤、石油、天然气为主要能源(仍然是利用燃烧反应所释放的热能)
煤的燃烧
气缸中燃料的燃烧
二、推进新课
多能源结构时期
太阳能、风能、潮汐能、核能
二、推进新课
在101.3kPa,25℃条件下,断开1molAB为A、B时吸收的能量称为A-B键的键能。
【补充】键能
通常,键能越大,键越牢固,由该键构成的分子也愈稳定,该分子能量就愈低。
Q=反应物的键能之和-生成物的键能之和
Q
>
0,吸热
Q<
0,放热
注意:键能
≠
键所具有的能量
三、课堂练习
【思考】在25℃和101kPa的条件下,
即:由1mol的H2和1mol的F2,生成2molHF会释放出:
2
×
565kJ
-
436kJ
-
155kJ
=
539kJ
H2
+
F2
2HF
kJ
F
-
F
F
+
F
吸收155kJ/mol
H
-
H
H
+
H
吸收436kJ/mol
放出539
H
+
F
H-F
放出565kJ/mol
三、课堂练习
1.在反应H2
+
Cl2
=2HCl中,已知H-H键能为436kJ,Cl-Cl键能为247kJ,H-Cl键能为431kJ,判断该反应是(
)
A.
吸热反应
B.
放热反应
C.
吸收179kJ热量
D.放出179kJ热量
BD
三、课堂练习
2.已知反应A+B=C+D为放热反应,对该反应的下列说法中正确的是(
)
A.
A的能量一定高于C
B.
B的能量一定高于D
C.
A和B的总能量一定高于C和D的总能量
D.
该反应为放热反应,故不必加热就一定能发生
C
三、课堂练习
3.下列说法中正确的是(
)
A.物质发生化学反应都伴随着能量的变化
B.伴有能量变化的物质变化都是化学变化
C.在一个确定的化学反应关系中,反应物的总能量与生成物的总能量一定不同
D.所有物质的内部都“储存”有能量,而且这些能量都是相等的
AC
四、课堂小结
第2课时
化学键与化学反应中能量变化的关系
一、化学能与热能的相互转化
二、化学键与化学反应中能量变化的关系
1.化学键的断裂和形成是化学反应中能量变化的主要原因
2.
∑E(反应物)
>
∑E(生成物)——放出能量
∑E(反应物)
<
∑E(生成物)——吸收能量
三、人类利用能源的三个阶段
化学反应
放热反应:放出热的化学反应
吸热反应:吸收热的化学反应
再
见
谢谢
21世纪教育网(www.21cnjy.com)
中小学教育资源网站
有大把高质量资料?一线教师?一线教研员?
欢迎加入21世纪教育网教师合作团队!!月薪过万不是梦!!
详情请看:
https://www.21cnjy.com/help/help_extract.php
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
