人教版高中化学选修三3.4离子晶体 课件(35张ppt)
文档属性
| 名称 | 人教版高中化学选修三3.4离子晶体 课件(35张ppt) | 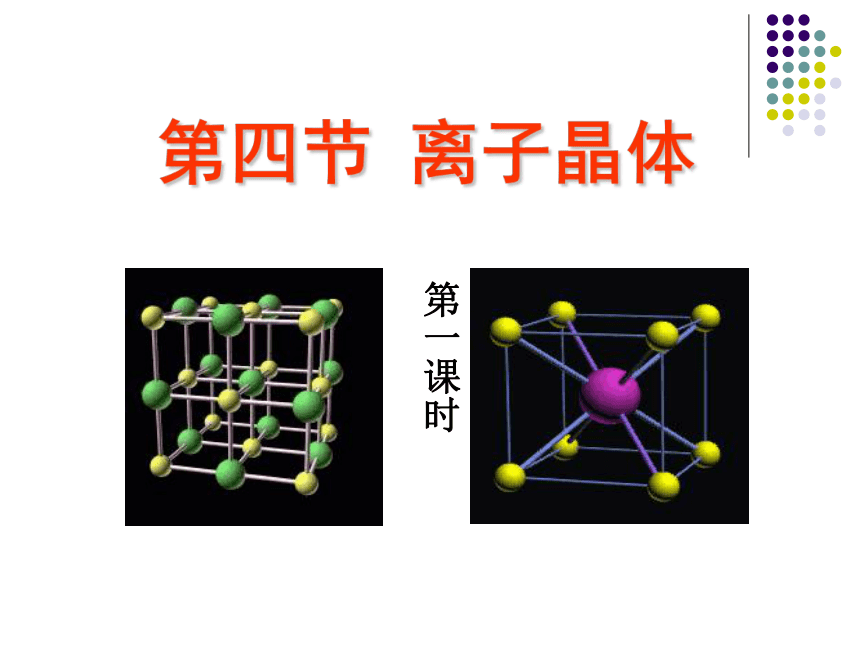 | |
| 格式 | zip | ||
| 文件大小 | 3.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-06-01 21:35:16 | ||
图片预览










文档简介
(共35张PPT)
第四节
离子晶体
第一课时
常见晶体
1.NaCl晶体是典型的离子化合物,其中存在哪些微粒?试写出NaCl的电子式.
2.上述离子是通过怎样的相互作用结合成晶体的呢?
知识回顾:离子键
1、
称为离子键。
2、成键的微粒:
阴、阳离子
3、成键的本质:
阴阳离子间的静电作用
4、成键的条件:
活泼金属元素的原子和活泼的非金属元素的原子
使阴、阳离子结合成离子化合物的静电作用
思考
哪些物质中含有离子键?
1、活泼的金属元素(IA、IIA)和活泼的非金属元素(VIA、VIIA)形成的化合物。
2、活泼的金属元素和酸根离子(或氢氧根离子)形成的化合物
3、铵根和酸根离子(或活泼非金属元素离子)形成的盐。
强碱
大多数盐
活泼金属氧化物
4、从物质类别的角度来说,离子化合物通常包括________、___________和________________。
5.常见的离子化合物
6、影响离子键强弱的因素:
离子半径和
离子电荷
同种类型的离子晶体,通常离子半径越
、离子带电荷越
,离子键就越
。离子键越强,破坏它所需能量就越
。熔点就越
。
小
多
强
大
高
7、离子键的特征
没有方向性:
阴阳离子是球形对称的,电荷的分布也是球形对称的,它们在空间各个方向上的静电作用相同,都可以和带不同电荷的离子发生作用
没有饱和性:
在静电作用能达到的范围内,只要空间条件允许,一个离子可以多个离子发生作用
重晶石
BaSO4
莹石
CaF2
胆矾
CuSO4·5H2O
明矾
KAl(SO4)2·12H2O
强碱、活泼金属氧化物、大部分的盐类。
1、定义:
由阳离子和阴离子通过离子键结合而成的晶体。
2、成键粒子:
阴、阳离子
3、相互作用力:
离子键
4、常见的离子晶体:
一、离子晶体
(2)
硬度
。
5.
离子晶体物理性质的特点:
(1)
熔沸点
,
难挥发难压缩。
较高
较大
(3)
水溶性
(4)
导电性
阅读课本P79最后一段(即科学视野之前的一段),结合氯化钠晶体的结构,你认为离子晶体物理性质有何特点?
离子电荷越多,核间距离越小,熔沸点升高。
一般易溶于水,而难溶于非极性溶剂。
固态不导电,水溶液或者熔融状态下能导电。
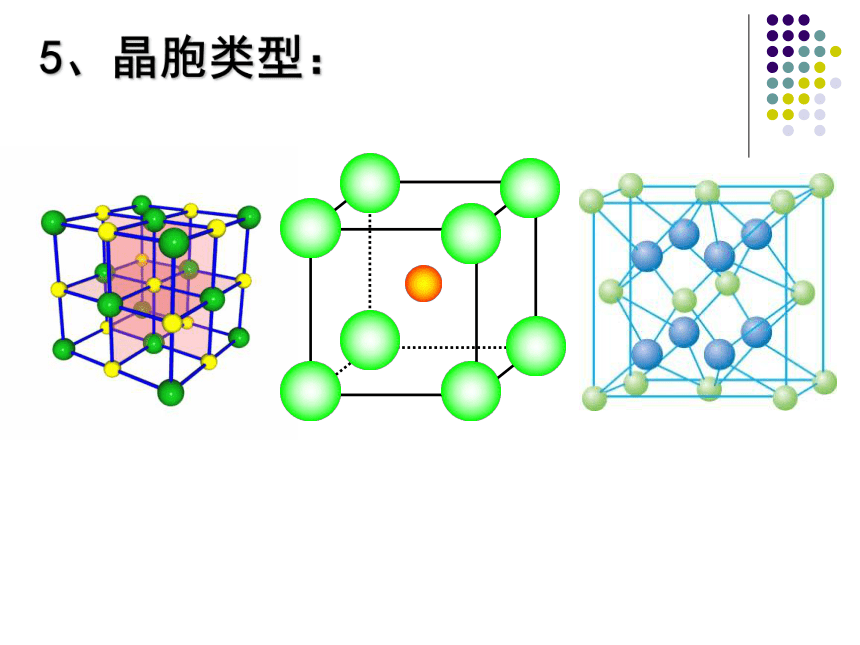
5、晶胞类型:
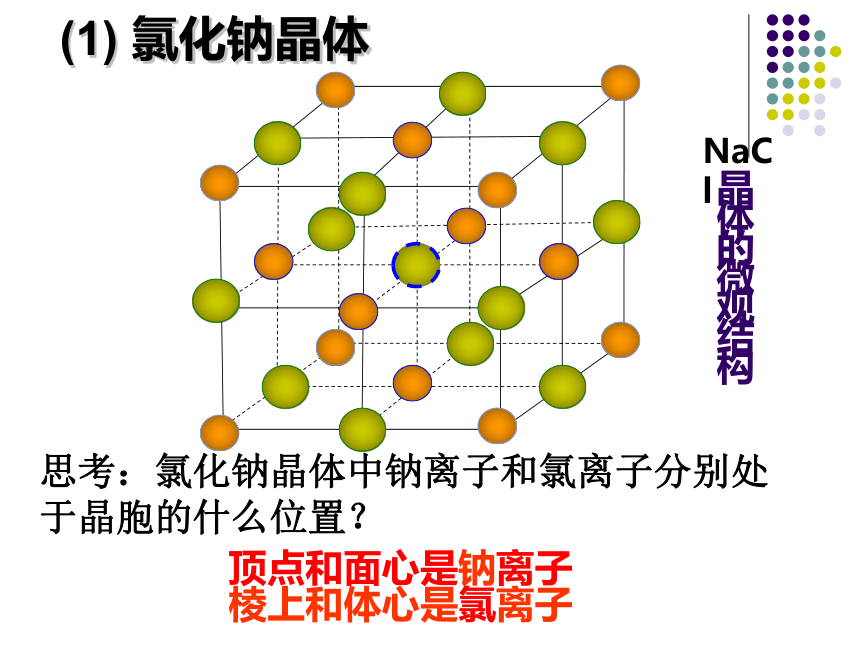
思考:氯化钠晶体中钠离子和氯离子分别处于晶胞的什么位置?
(1)
氯化钠晶体
每个Cl-
周围与之最接近且距离相等的Na+共有
个。
6
这几个Na+在空间构成的几何构型为
。
正八面体
NaCl晶体中离子的配位数
CsCl晶体的结构
氯化铯晶体中氯离子和铯离子分别处于晶胞的什么位置?
氯离子位于顶点,铯离子位于体心。
(2)氯化铯晶体
CsCl晶体中离子的配位数
(1)每个晶胞含铯离子、氯离子的个数?
(2)在氯化铯晶体中,每个Cs+周围与之最接近且距离相等的Cl-共有
;这几个Cl-在空间构成的几何构型为
。
(3)在每个Cl-周围距离相等且最近的Cs+共有
;这几个Cs+
在空间构成的几何构型
。
(3)CaF2型晶胞
2°Ca2+的配位数:
F-的配位数:
1°一个CaF2晶胞中含:
4个Ca2+和8个F?
8
4
Ca
F
Ca2+配位数是_____,F-的配位数是_______。
8
4
图示为CaF2晶胞的1/8,观察点为上左前方
晶胞上面心
(4)ZnS型晶胞
2°阳离子的配位数:
阴离子的配位数:
1°一个ZnS晶胞中含:
4个阳离子和4个阴离子
4
4
科学探究:
找出NaCl、CsCl两种离子晶体中阳离子和阴离子的配位数,它们是否相等?
6
6
8
8
离子晶体
阴离子的配位数
阳离子的配位数
NaCl
CsCl
科学探究:
你认为是什么因素决定了离子晶体中离子的配位数?根据表3—5、表3—6分析影响离子晶体中离子配位数的因素。
配位数
4
6
8
半径比
0.2~0.4
0.4~0.7
0.7~1.0
空间构型
ZnS
NaCl
CsCl
6、决定离子晶体结构的因素
(1)几何因素
晶体中正负离子的半径比
(2)电荷因素
晶体中正负离子的电荷比
(3)键性因素
离子键的纯粹因素
1、几何因素
配位数与
r
+/
r-
之比相关:
0.225
——
0.414
4
配位
0.414
——
0.732
6
配位
0.732
——
1.000
8
配位
NaCl:95/181=0.525
CsCl:169/181=0.933
2、电荷因素
CaF2的晶胞
例:CaF2的晶体中,Ca2+和F-的个数之比____,电荷数之比_____,Ca2+配位数是_____,F-的配位数是_______。
由正负离子的电荷比影响
离子晶体的配位数的因素,
称为电荷因素。
1:2
2:1
8
4
为什么NaCl的熔沸点比CsCl高?
结论:
对于组成和结构相似的物质,
阴、阳离子半径越小,离子键越强,熔沸点较高,晶体越稳定。
离子键的强弱在一定程度上可以用离子晶体的晶格能来衡量。
1.概念:气态离子形成1摩尔离子晶体释放的能量,通常取正值。或指拆开1mol离子晶体使之形成气态阴离子和气态阳离子所吸收的能量
(二)、离子晶体的晶格能
2.表示:符号为U
单位是KJ/mol
,取正值
3、影响晶格能大小因素
离子晶体中阴阳离子半径越小,所带电荷越多,离子键越强,晶格能越大
4
晶格能的作用:
(1)晶格能越大,离子晶体越稳定,离子晶体的熔沸点越高,硬度越大。
(2)岩浆晶出规则与晶格能的关系
★晶格能高的晶体熔点较高,更容易在岩浆冷却过程中冷却下来,从而先结晶
例:下列热化学方程式中,能直接表示出氯化钠晶格能的是______
A、
Na
(s)
+
1/2Cl2
(g)
=
NaCl(s);
△H
B、Na+(g)
+
Cl-
(g)
=
NaCl(s);
△H1
C、Na
(s)=
Na
(g)
;
△H2
D
、Na
(g)
-e-
=
Na+
(g)
;
△H3
E、1/2Cl2(g)=Cl(g);
△H4
F、Cl(g)
+
e-
=Cl-(g);
△H5
写出△H1与△H
、△H2、△H3、△H4、△H5之间的关系式_____
△H
=△H1
+△H2+△H3
+△H4
+△H5
B
练习
1、下表列出了有关晶体的知识,其中错误的是( )
2、下列物质的晶体,按其熔点由低到高的排列顺序正确的是( )
A.NaCl、SiO2、CO2 B.NaCl、CO2、SiO2
C.NaCl、MgO、SiO2 D.NaCl、SiO2、MgO
B
C
A
B
C
D
晶体
硫化钾
干冰
金刚石
碘
组成晶体的微粒
阴阳离子
分子
原子
分子
晶体微粒间存在的作用力
离子键
共价键
共价键
范德华力
3.下列物质中,化学式能准确表示该物质分子组成的是
A.NH4Cl
B.SiO2
C.P4
D.Na2SO4
问题反思——化学式能否表示分子,关键能判断该物质是否分子晶体
4.下列有关晶体的叙述中不正确的是
(
)
A.金刚石的网状结构中,由共价键形成的碳原子环中,最小的环上有6个碳原子
B.
氯化钠晶体中,每个Na+周围距离相等的Na+离子共有6个
C.氯化铯晶体中,每个铯原子周围紧邻8个氯原子
D.干冰晶体中,每个二氧化碳分子周围紧邻12个二氧化碳分子
5.如图所示是某些晶体的结构,它们分别是NaCl、CsCl、干冰、金刚石、石墨结构中的某一部分。
⑴
其中代表金刚石的是(填编号字母,下同)_____,其中每个碳原子与____个碳原子最接近且距离相等。金刚石属于____晶体。
⑵
其中代表石墨的是_______,其中每个正六边形占有的碳原子数平均为______个。
⑶
其中代表NaCl的是______。⑷
代表CsCl的是___,它属于___晶体,每个Cs+与__个Cl—紧邻。
⑸
代表干冰的是_________,它属于______晶体,每个CO2分子与______个CO2分子紧邻。
⑹
上述五种物质熔点由高到低的顺序______________________。
参照下表中物质的熔点,回答有关问题:
①
钠的卤化物及碱金属的氯化物的熔点高低取决于其______________________,在这种情况下,____________越大,________________越弱,故熔点依次降低。
②
硅的卤化物及硅、锗、锡、铅的氯化物的熔点高低取决于其_______________,
___________________越大,___________________越大,故熔点依次升高。
③
钠的卤化物的熔点比相应硅的卤化物的熔点高得多,这是由______________。
物质
NaF
NaCl
NaBr
NaI
NaCl
KCl
RbCl
CsCl
熔点℃
995
801
755
651
801
776
715
646
物质
SiF4
SiCl4
SiBr4
SiI4
SiCl4
GeCl4
SnCl4
PbCl4
熔点℃
-90.2
-70.4
5.2
12.05
-70.4
-49.5
-36.2
-15.0
第四节
离子晶体
第一课时
常见晶体
1.NaCl晶体是典型的离子化合物,其中存在哪些微粒?试写出NaCl的电子式.
2.上述离子是通过怎样的相互作用结合成晶体的呢?
知识回顾:离子键
1、
称为离子键。
2、成键的微粒:
阴、阳离子
3、成键的本质:
阴阳离子间的静电作用
4、成键的条件:
活泼金属元素的原子和活泼的非金属元素的原子
使阴、阳离子结合成离子化合物的静电作用
思考
哪些物质中含有离子键?
1、活泼的金属元素(IA、IIA)和活泼的非金属元素(VIA、VIIA)形成的化合物。
2、活泼的金属元素和酸根离子(或氢氧根离子)形成的化合物
3、铵根和酸根离子(或活泼非金属元素离子)形成的盐。
强碱
大多数盐
活泼金属氧化物
4、从物质类别的角度来说,离子化合物通常包括________、___________和________________。
5.常见的离子化合物
6、影响离子键强弱的因素:
离子半径和
离子电荷
同种类型的离子晶体,通常离子半径越
、离子带电荷越
,离子键就越
。离子键越强,破坏它所需能量就越
。熔点就越
。
小
多
强
大
高
7、离子键的特征
没有方向性:
阴阳离子是球形对称的,电荷的分布也是球形对称的,它们在空间各个方向上的静电作用相同,都可以和带不同电荷的离子发生作用
没有饱和性:
在静电作用能达到的范围内,只要空间条件允许,一个离子可以多个离子发生作用
重晶石
BaSO4
莹石
CaF2
胆矾
CuSO4·5H2O
明矾
KAl(SO4)2·12H2O
强碱、活泼金属氧化物、大部分的盐类。
1、定义:
由阳离子和阴离子通过离子键结合而成的晶体。
2、成键粒子:
阴、阳离子
3、相互作用力:
离子键
4、常见的离子晶体:
一、离子晶体
(2)
硬度
。
5.
离子晶体物理性质的特点:
(1)
熔沸点
,
难挥发难压缩。
较高
较大
(3)
水溶性
(4)
导电性
阅读课本P79最后一段(即科学视野之前的一段),结合氯化钠晶体的结构,你认为离子晶体物理性质有何特点?
离子电荷越多,核间距离越小,熔沸点升高。
一般易溶于水,而难溶于非极性溶剂。
固态不导电,水溶液或者熔融状态下能导电。
5、晶胞类型:
思考:氯化钠晶体中钠离子和氯离子分别处于晶胞的什么位置?
(1)
氯化钠晶体
每个Cl-
周围与之最接近且距离相等的Na+共有
个。
6
这几个Na+在空间构成的几何构型为
。
正八面体
NaCl晶体中离子的配位数
CsCl晶体的结构
氯化铯晶体中氯离子和铯离子分别处于晶胞的什么位置?
氯离子位于顶点,铯离子位于体心。
(2)氯化铯晶体
CsCl晶体中离子的配位数
(1)每个晶胞含铯离子、氯离子的个数?
(2)在氯化铯晶体中,每个Cs+周围与之最接近且距离相等的Cl-共有
;这几个Cl-在空间构成的几何构型为
。
(3)在每个Cl-周围距离相等且最近的Cs+共有
;这几个Cs+
在空间构成的几何构型
。
(3)CaF2型晶胞
2°Ca2+的配位数:
F-的配位数:
1°一个CaF2晶胞中含:
4个Ca2+和8个F?
8
4
Ca
F
Ca2+配位数是_____,F-的配位数是_______。
8
4
图示为CaF2晶胞的1/8,观察点为上左前方
晶胞上面心
(4)ZnS型晶胞
2°阳离子的配位数:
阴离子的配位数:
1°一个ZnS晶胞中含:
4个阳离子和4个阴离子
4
4
科学探究:
找出NaCl、CsCl两种离子晶体中阳离子和阴离子的配位数,它们是否相等?
6
6
8
8
离子晶体
阴离子的配位数
阳离子的配位数
NaCl
CsCl
科学探究:
你认为是什么因素决定了离子晶体中离子的配位数?根据表3—5、表3—6分析影响离子晶体中离子配位数的因素。
配位数
4
6
8
半径比
0.2~0.4
0.4~0.7
0.7~1.0
空间构型
ZnS
NaCl
CsCl
6、决定离子晶体结构的因素
(1)几何因素
晶体中正负离子的半径比
(2)电荷因素
晶体中正负离子的电荷比
(3)键性因素
离子键的纯粹因素
1、几何因素
配位数与
r
+/
r-
之比相关:
0.225
——
0.414
4
配位
0.414
——
0.732
6
配位
0.732
——
1.000
8
配位
NaCl:95/181=0.525
CsCl:169/181=0.933
2、电荷因素
CaF2的晶胞
例:CaF2的晶体中,Ca2+和F-的个数之比____,电荷数之比_____,Ca2+配位数是_____,F-的配位数是_______。
由正负离子的电荷比影响
离子晶体的配位数的因素,
称为电荷因素。
1:2
2:1
8
4
为什么NaCl的熔沸点比CsCl高?
结论:
对于组成和结构相似的物质,
阴、阳离子半径越小,离子键越强,熔沸点较高,晶体越稳定。
离子键的强弱在一定程度上可以用离子晶体的晶格能来衡量。
1.概念:气态离子形成1摩尔离子晶体释放的能量,通常取正值。或指拆开1mol离子晶体使之形成气态阴离子和气态阳离子所吸收的能量
(二)、离子晶体的晶格能
2.表示:符号为U
单位是KJ/mol
,取正值
3、影响晶格能大小因素
离子晶体中阴阳离子半径越小,所带电荷越多,离子键越强,晶格能越大
4
晶格能的作用:
(1)晶格能越大,离子晶体越稳定,离子晶体的熔沸点越高,硬度越大。
(2)岩浆晶出规则与晶格能的关系
★晶格能高的晶体熔点较高,更容易在岩浆冷却过程中冷却下来,从而先结晶
例:下列热化学方程式中,能直接表示出氯化钠晶格能的是______
A、
Na
(s)
+
1/2Cl2
(g)
=
NaCl(s);
△H
B、Na+(g)
+
Cl-
(g)
=
NaCl(s);
△H1
C、Na
(s)=
Na
(g)
;
△H2
D
、Na
(g)
-e-
=
Na+
(g)
;
△H3
E、1/2Cl2(g)=Cl(g);
△H4
F、Cl(g)
+
e-
=Cl-(g);
△H5
写出△H1与△H
、△H2、△H3、△H4、△H5之间的关系式_____
△H
=△H1
+△H2+△H3
+△H4
+△H5
B
练习
1、下表列出了有关晶体的知识,其中错误的是( )
2、下列物质的晶体,按其熔点由低到高的排列顺序正确的是( )
A.NaCl、SiO2、CO2 B.NaCl、CO2、SiO2
C.NaCl、MgO、SiO2 D.NaCl、SiO2、MgO
B
C
A
B
C
D
晶体
硫化钾
干冰
金刚石
碘
组成晶体的微粒
阴阳离子
分子
原子
分子
晶体微粒间存在的作用力
离子键
共价键
共价键
范德华力
3.下列物质中,化学式能准确表示该物质分子组成的是
A.NH4Cl
B.SiO2
C.P4
D.Na2SO4
问题反思——化学式能否表示分子,关键能判断该物质是否分子晶体
4.下列有关晶体的叙述中不正确的是
(
)
A.金刚石的网状结构中,由共价键形成的碳原子环中,最小的环上有6个碳原子
B.
氯化钠晶体中,每个Na+周围距离相等的Na+离子共有6个
C.氯化铯晶体中,每个铯原子周围紧邻8个氯原子
D.干冰晶体中,每个二氧化碳分子周围紧邻12个二氧化碳分子
5.如图所示是某些晶体的结构,它们分别是NaCl、CsCl、干冰、金刚石、石墨结构中的某一部分。
⑴
其中代表金刚石的是(填编号字母,下同)_____,其中每个碳原子与____个碳原子最接近且距离相等。金刚石属于____晶体。
⑵
其中代表石墨的是_______,其中每个正六边形占有的碳原子数平均为______个。
⑶
其中代表NaCl的是______。⑷
代表CsCl的是___,它属于___晶体,每个Cs+与__个Cl—紧邻。
⑸
代表干冰的是_________,它属于______晶体,每个CO2分子与______个CO2分子紧邻。
⑹
上述五种物质熔点由高到低的顺序______________________。
参照下表中物质的熔点,回答有关问题:
①
钠的卤化物及碱金属的氯化物的熔点高低取决于其______________________,在这种情况下,____________越大,________________越弱,故熔点依次降低。
②
硅的卤化物及硅、锗、锡、铅的氯化物的熔点高低取决于其_______________,
___________________越大,___________________越大,故熔点依次升高。
③
钠的卤化物的熔点比相应硅的卤化物的熔点高得多,这是由______________。
物质
NaF
NaCl
NaBr
NaI
NaCl
KCl
RbCl
CsCl
熔点℃
995
801
755
651
801
776
715
646
物质
SiF4
SiCl4
SiBr4
SiI4
SiCl4
GeCl4
SnCl4
PbCl4
熔点℃
-90.2
-70.4
5.2
12.05
-70.4
-49.5
-36.2
-15.0
