人教版高中化学选修三3.1 晶体的常识-课件(共32张PPT)
文档属性
| 名称 | 人教版高中化学选修三3.1 晶体的常识-课件(共32张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 5.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-06-02 00:00:00 | ||
图片预览











文档简介
(共32张PPT)
金刚石
冰糖
石墨
【新课导入】自然界中常见的固体有一些有漂亮的外观。是由什么导致的呢?
高二化学(选修3)第三章
第一节
晶体的常识
【学习目标】
1、了解晶体的特点、知道晶体与非晶体的本质差异。
2、了解晶胞的概念,学会用均摊法确定晶胞和晶体的组成。
【学习重难点】
均摊法确定晶胞组成
晶体SiO2和非晶体SiO2的投影示意图
水晶
硅藻土
内部微粒(原子、离子或分子)在空间按一定规律做周期性重复排列构成的固体物质称为晶体。
原子呈周期性有序排列
原子排列相对无序
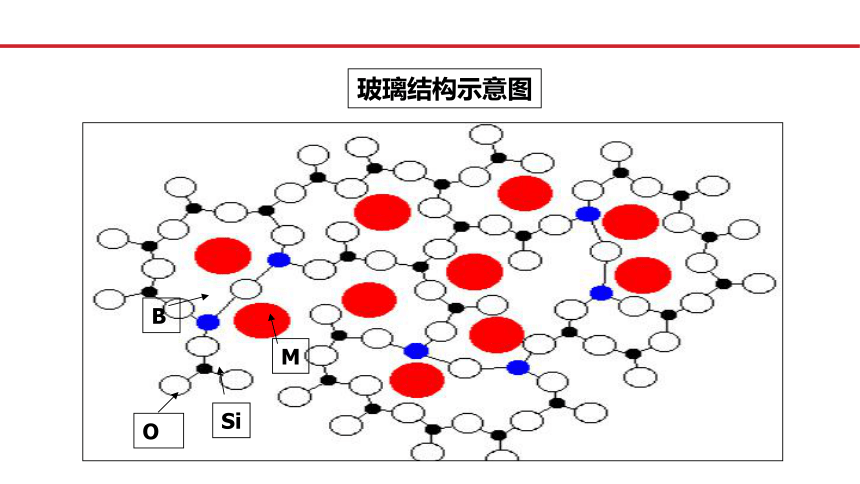
玻璃结构示意图
B
O
Si
M
一、晶体与非晶体
1.概念
晶体:具有规则几何外形的固体;
非晶体:没有规则几何外形的固体(又称玻璃体):玻璃、石蜡、沥青等。
晶体
离子晶体
原子晶体
分子晶体
金属晶体
2.分类
3.晶体的特点和性质
一、晶体与非晶体
(1)具有规则的几何外形。
(2)自范性:晶体能自发地呈现多面体外形的性质。
(3)各向异性:某些物理性质常常会表现出各向异性。
(4)有序性:晶体的外形和内部质点排列的高度有序性。
(5)有固定的熔点(而非晶态没有)。
4.晶体与非晶体的本质区别
构成固体的粒子在三维空间里是否呈现周期性的有序排列
【观察与思考】请同学们判断下列物质是晶体还是非晶体:
明矾
硅藻土
钻石
食盐
石蜡
雪花
泡沫塑料
水晶石
对于不能直接通过外观来判断是否为晶体的物质,有什么更好更专业的方法吗?
【拓展】
X—射线衍射
当一束单色X射线入射到晶体时,由于晶体是由原子规则排列成的晶胞组成,这些规则排列的原子间距离与入射X射线波长有X射线衍射分析相同数量级,故由不同原子散射的X射线相互干涉,在某些特殊方向上产生强X射线衍射,衍射线在空间分布的方位和强度,与晶体结构密切相关,每种晶体所产生的衍射花样都反映出该晶体内部的原子分配规律。这就是X射线衍射的基本原理。
【学以致用】根据晶体的物理性质的各向异性的特点,人们很容易识别用玻璃仿造的假宝石。你能列举一些可能有效的方法鉴别假宝石吗?
(1)观察宝石的外形,具有多面体的外形。(2)实验它的硬度,刻划玻璃.(3)加热,测熔点
(4)X—射线衍射
5.获得晶体的三个途径:
(1)使熔融物质凝固
(2)使气态物质冷却不经过液态直接凝固(凝华)
(3)使溶质从溶液中析出
要求:晶体生长的速率适当。
√
【练1】
蜂巢与蜂室
晶体与晶胞的关系可用蜂巢与峰室的关系比喻,然而蜂巢是有形的,晶胞是无形的,是人为划定的。
二、晶胞
1.
晶胞:描述晶体结构的基本单元
铜晶体
铜晶胞
晶体结构
晶胞示意图
金刚石晶胞
NaCl晶胞
思考与交流:
1.上述铜晶体、金刚石、CO2晶体、NaCl晶体的晶胞的空间构形呈什么形状?
2.在上述晶体中,晶胞是如何排列的?晶胞之间是否存在空隙?
CO2晶胞
平行六面体
无隙并置
平行六面体
无隙并置
1.定义:晶体中的基本单元
2.特征:
(-)晶胞
3.晶体和晶胞的关系:晶体可以看作是数量巨大的晶胞“无隙并置”而成。
二、晶胞
一般来说,晶胞都是平行六面体(其边长不一定相等也不一定垂直)------通过上、下、左、右、前、后的平移能与下一个晶胞完全重合.
“并置”指所有晶胞都是平行排列的,取向相同。一个晶胞到另一个晶胞只需平移,不可旋转。
“无隙”指相邻的晶胞之间没有任何间隙;一个晶胞与相邻的晶胞完全共顶点、共棱边、共面
“无隙并置”的含义
“完全等同”指所有晶胞的形状、内部的原子种类、个数及几何排列完全相同。
答案:
B
【例1】铜晶体的一个晶胞中含有多少个铜原子?
A.
14
B.
4
C.
8
D.
6
铜晶胞
体心
面心
顶点
棱边
均摊法:如某个粒子为x个晶胞所共有,则该粒子有1/x属于一个晶胞。
(二)晶胞中原子个数的计算
二、晶胞
1
2
4
3
7
6
8
5
1
2
2
1
3
4
请看:
1
体心:1
面心:1/2
顶点
棱边:1/4
:1/8
均摊法:如某个粒子为x个晶胞所共有,则该粒子有1/x属于一个晶胞。
(二)晶胞中原子个数的计算
二、晶胞
立方晶胞中粒子个数的计算规律
立方晶胞
体心:
1
面心:
1/2
棱边:
1/4
顶点:
1/8
图3-8依次是金属钠(Na)、金属锌(Zn)、碘(12)、金刚石(C)晶胞的示意图,数一数,它们分别平均含几个原子?
学与问
钠所含原子数:
8×1/8+1=2
锌所含原子数:
8×1/8+1=2
碘所含原子数:(8×1/8+6×1/2)×2=8
金刚石所含原子数:8×1/8+6×1/2+4=8
习题
【例3】下图的晶胞中各有几个原子?
所含原子数:
8×1/8+6×1/2=4
所含原子数:
8×1/8+6×1/2+4=8
所含原子数:
3×(8×1/8+6×1/2)=12
三棱柱:
体心:
1
面心:
1/2
棱边:
水平1/4
竖1/6
顶点:
1/12
六棱柱:
体心:
1
面心:
1/2
棱边:
水平1/4
竖1/3
顶点:
1/6
常见晶胞中微粒数的计算:
(1)立方体:
(2)三棱柱:
(3)六棱柱:
体心:
1
面心:
1/2
棱边:
1/4
顶点:
1/8
体心:
1
面心:
1/2
棱边:
水平1/4
竖1/6
顶点:
1/12
体心:
1
面心:
1/2
棱边:
水平1/4
竖1/3
顶点:
1/6
【例2】某晶体的一部分如图所示,这种晶体中A、B、C三种粒子数之比是( )
A.3∶9∶4
B.1∶4∶2
C.2∶9∶4
D.3∶8∶4
√
石墨晶体的层状结构,层内为平面正六边形结构(如图),试回答下列问题:
(1)图中平均每个正六边形占有C原子数为____个、占有的碳碳键数为____个。
碳原子数目与碳碳化学键数目之比为_______。
【练2】
2:3
2
3
【练3】最近,科学家发现了一种由钛原子和碳原子构成的气态团簇分子。如图所示,其结构与NaCl的结构相同,顶角和面心的原子是钛原子,棱的中心和体心的原子是碳原子,则它的化学式是
A.TiC
B.Ti6C7
C.Ti13C14
D.Ti13C14
C
注意:团簇分子或纳米颗粒,是独立存在的粒子,所含微粒是其自身所有,不与其他分子或颗粒共用。不能用均摊法。均摊法只适用于晶胞。
【拓展】晶体微粒数与M、ρ的计算
与晶体有关的计算类型主要有:根据晶胞的结构计算和判断晶体的质量(m)、密度(ρ)、相对分子质量或摩尔质量(M)、阿伏伽德罗常数(NA)与一个晶胞的关系。
常用公式有:①ρ=m/V
②M1=M1NA(m1为一个与晶体组成相同的微粒的质量)
【例】A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型;C、D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:
A和B能够形成化合物F,其晶胞结构如下图所示,晶胞参数a=0.566
nm,F的化学式为________;晶胞中A原子的配位数为________;列式计算晶体F的密度(g·cm-3)________。
金刚石
冰糖
石墨
【新课导入】自然界中常见的固体有一些有漂亮的外观。是由什么导致的呢?
高二化学(选修3)第三章
第一节
晶体的常识
【学习目标】
1、了解晶体的特点、知道晶体与非晶体的本质差异。
2、了解晶胞的概念,学会用均摊法确定晶胞和晶体的组成。
【学习重难点】
均摊法确定晶胞组成
晶体SiO2和非晶体SiO2的投影示意图
水晶
硅藻土
内部微粒(原子、离子或分子)在空间按一定规律做周期性重复排列构成的固体物质称为晶体。
原子呈周期性有序排列
原子排列相对无序
玻璃结构示意图
B
O
Si
M
一、晶体与非晶体
1.概念
晶体:具有规则几何外形的固体;
非晶体:没有规则几何外形的固体(又称玻璃体):玻璃、石蜡、沥青等。
晶体
离子晶体
原子晶体
分子晶体
金属晶体
2.分类
3.晶体的特点和性质
一、晶体与非晶体
(1)具有规则的几何外形。
(2)自范性:晶体能自发地呈现多面体外形的性质。
(3)各向异性:某些物理性质常常会表现出各向异性。
(4)有序性:晶体的外形和内部质点排列的高度有序性。
(5)有固定的熔点(而非晶态没有)。
4.晶体与非晶体的本质区别
构成固体的粒子在三维空间里是否呈现周期性的有序排列
【观察与思考】请同学们判断下列物质是晶体还是非晶体:
明矾
硅藻土
钻石
食盐
石蜡
雪花
泡沫塑料
水晶石
对于不能直接通过外观来判断是否为晶体的物质,有什么更好更专业的方法吗?
【拓展】
X—射线衍射
当一束单色X射线入射到晶体时,由于晶体是由原子规则排列成的晶胞组成,这些规则排列的原子间距离与入射X射线波长有X射线衍射分析相同数量级,故由不同原子散射的X射线相互干涉,在某些特殊方向上产生强X射线衍射,衍射线在空间分布的方位和强度,与晶体结构密切相关,每种晶体所产生的衍射花样都反映出该晶体内部的原子分配规律。这就是X射线衍射的基本原理。
【学以致用】根据晶体的物理性质的各向异性的特点,人们很容易识别用玻璃仿造的假宝石。你能列举一些可能有效的方法鉴别假宝石吗?
(1)观察宝石的外形,具有多面体的外形。(2)实验它的硬度,刻划玻璃.(3)加热,测熔点
(4)X—射线衍射
5.获得晶体的三个途径:
(1)使熔融物质凝固
(2)使气态物质冷却不经过液态直接凝固(凝华)
(3)使溶质从溶液中析出
要求:晶体生长的速率适当。
√
【练1】
蜂巢与蜂室
晶体与晶胞的关系可用蜂巢与峰室的关系比喻,然而蜂巢是有形的,晶胞是无形的,是人为划定的。
二、晶胞
1.
晶胞:描述晶体结构的基本单元
铜晶体
铜晶胞
晶体结构
晶胞示意图
金刚石晶胞
NaCl晶胞
思考与交流:
1.上述铜晶体、金刚石、CO2晶体、NaCl晶体的晶胞的空间构形呈什么形状?
2.在上述晶体中,晶胞是如何排列的?晶胞之间是否存在空隙?
CO2晶胞
平行六面体
无隙并置
平行六面体
无隙并置
1.定义:晶体中的基本单元
2.特征:
(-)晶胞
3.晶体和晶胞的关系:晶体可以看作是数量巨大的晶胞“无隙并置”而成。
二、晶胞
一般来说,晶胞都是平行六面体(其边长不一定相等也不一定垂直)------通过上、下、左、右、前、后的平移能与下一个晶胞完全重合.
“并置”指所有晶胞都是平行排列的,取向相同。一个晶胞到另一个晶胞只需平移,不可旋转。
“无隙”指相邻的晶胞之间没有任何间隙;一个晶胞与相邻的晶胞完全共顶点、共棱边、共面
“无隙并置”的含义
“完全等同”指所有晶胞的形状、内部的原子种类、个数及几何排列完全相同。
答案:
B
【例1】铜晶体的一个晶胞中含有多少个铜原子?
A.
14
B.
4
C.
8
D.
6
铜晶胞
体心
面心
顶点
棱边
均摊法:如某个粒子为x个晶胞所共有,则该粒子有1/x属于一个晶胞。
(二)晶胞中原子个数的计算
二、晶胞
1
2
4
3
7
6
8
5
1
2
2
1
3
4
请看:
1
体心:1
面心:1/2
顶点
棱边:1/4
:1/8
均摊法:如某个粒子为x个晶胞所共有,则该粒子有1/x属于一个晶胞。
(二)晶胞中原子个数的计算
二、晶胞
立方晶胞中粒子个数的计算规律
立方晶胞
体心:
1
面心:
1/2
棱边:
1/4
顶点:
1/8
图3-8依次是金属钠(Na)、金属锌(Zn)、碘(12)、金刚石(C)晶胞的示意图,数一数,它们分别平均含几个原子?
学与问
钠所含原子数:
8×1/8+1=2
锌所含原子数:
8×1/8+1=2
碘所含原子数:(8×1/8+6×1/2)×2=8
金刚石所含原子数:8×1/8+6×1/2+4=8
习题
【例3】下图的晶胞中各有几个原子?
所含原子数:
8×1/8+6×1/2=4
所含原子数:
8×1/8+6×1/2+4=8
所含原子数:
3×(8×1/8+6×1/2)=12
三棱柱:
体心:
1
面心:
1/2
棱边:
水平1/4
竖1/6
顶点:
1/12
六棱柱:
体心:
1
面心:
1/2
棱边:
水平1/4
竖1/3
顶点:
1/6
常见晶胞中微粒数的计算:
(1)立方体:
(2)三棱柱:
(3)六棱柱:
体心:
1
面心:
1/2
棱边:
1/4
顶点:
1/8
体心:
1
面心:
1/2
棱边:
水平1/4
竖1/6
顶点:
1/12
体心:
1
面心:
1/2
棱边:
水平1/4
竖1/3
顶点:
1/6
【例2】某晶体的一部分如图所示,这种晶体中A、B、C三种粒子数之比是( )
A.3∶9∶4
B.1∶4∶2
C.2∶9∶4
D.3∶8∶4
√
石墨晶体的层状结构,层内为平面正六边形结构(如图),试回答下列问题:
(1)图中平均每个正六边形占有C原子数为____个、占有的碳碳键数为____个。
碳原子数目与碳碳化学键数目之比为_______。
【练2】
2:3
2
3
【练3】最近,科学家发现了一种由钛原子和碳原子构成的气态团簇分子。如图所示,其结构与NaCl的结构相同,顶角和面心的原子是钛原子,棱的中心和体心的原子是碳原子,则它的化学式是
A.TiC
B.Ti6C7
C.Ti13C14
D.Ti13C14
C
注意:团簇分子或纳米颗粒,是独立存在的粒子,所含微粒是其自身所有,不与其他分子或颗粒共用。不能用均摊法。均摊法只适用于晶胞。
【拓展】晶体微粒数与M、ρ的计算
与晶体有关的计算类型主要有:根据晶胞的结构计算和判断晶体的质量(m)、密度(ρ)、相对分子质量或摩尔质量(M)、阿伏伽德罗常数(NA)与一个晶胞的关系。
常用公式有:①ρ=m/V
②M1=M1NA(m1为一个与晶体组成相同的微粒的质量)
【例】A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型;C、D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:
A和B能够形成化合物F,其晶胞结构如下图所示,晶胞参数a=0.566
nm,F的化学式为________;晶胞中A原子的配位数为________;列式计算晶体F的密度(g·cm-3)________。
