物质的量
图片预览







文档简介
(共21张PPT)
第一章 从实验学化学
第二节 化学计量在实验中的应用
第一课时 物质的量的单位
——摩尔
主讲:湖北红安一中 王卫明
[想一想]
1、大家都知道曹冲称象的故事吧,其中解决问题的主导思想是什么?
2、你能用托盘天平称一粒米的质量吗?
(化整为零,化大为小)
(积小成大,聚微为宏)
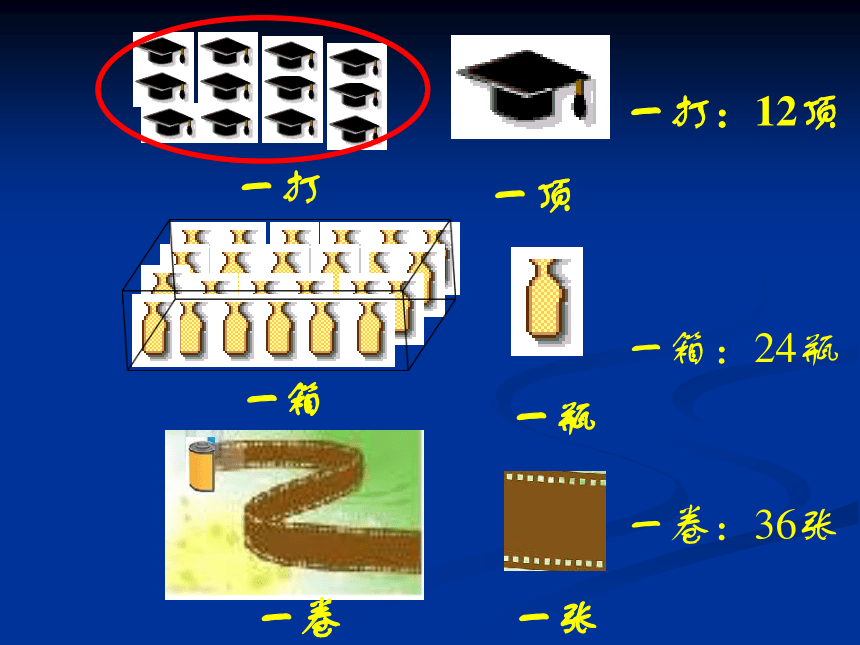
一打
一顶
一打:12顶
一瓶
一箱:24瓶
一箱
一张
一卷
一卷:36张
2H2 + O2 ====== 2H2O
点燃
宏观角度:
微观角度:
物质之间发生化学反应的实质:以微观粒子进行。
4 g 32 g 36 g
2个氢分子 1个氧分子 2个水分子
微观粒子与可称量的物质之间
是通过什么联系的呢?
一滴水中所含的水分子数,让10亿人去数,每人每分钟数100个,日夜不停的数,需要3万年才能数完。
当个体数量大时,人们习惯以集体为单位统计个体数量。因此当微观粒子的数量很大,我们也将以集体为单位对其进行计算
你知道吗?
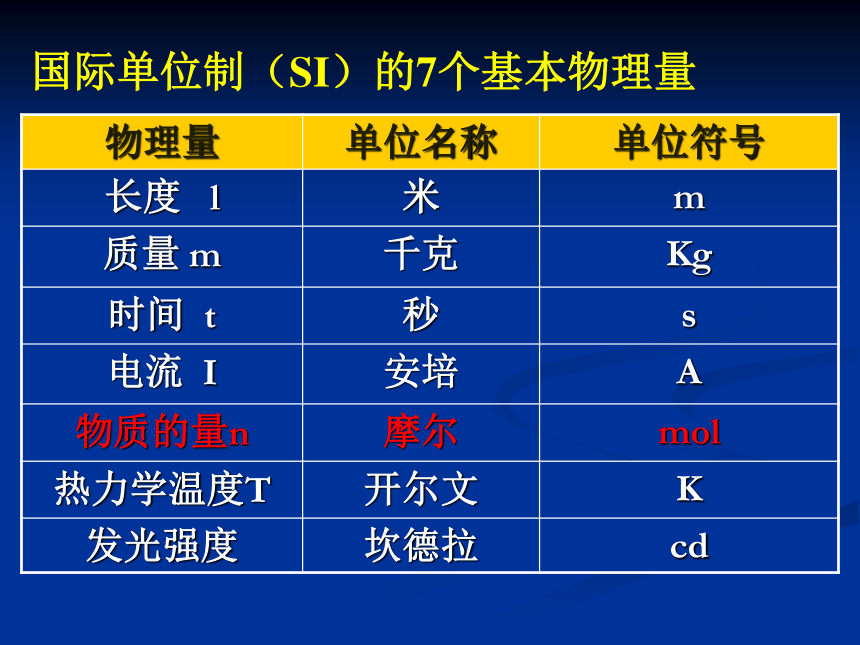
物理量 单位名称 单位符号
长度 l 米 m
质量 m 千克 Kg
时间 t 秒 s
电流 I 安培 A
物质的量n 摩尔 mol
热力学温度T 开尔文 K
发光强度 坎德拉 cd
国际单位制(SI)的7个基本物理量
是国际单位制七个基本物理量之一
1).定义:
2).符号:
3).单位:
4). 对象:
表示物质所含微粒多少的一个物理量,
也表示含有一定数目粒子的集体
n
摩尔(mol)
1.物质的量
微观粒子(分子、原子、离子、
原子团、电子、中子、质子等)
注 意
1mol 氢 ( )
仅用于计量微观粒子
使用时必须指明粒子种类
1mol 瓜子( )
1mol 大米( )
×
×
×
1mol 橙子( )
×
判断下列说法是否正确
(A)氧的物质的量为1 mol
(B)1.5 molO2
(C)2mol H+
(D)摩尔是7个基本物理量之一
(E)0.5 mol 大米
随堂练习
错误,必须指明微粒的种类,是氧原子、氧分子还是氧离子,改为 1mol O
正确
正确
错误 摩尔是物质的量的单位,物质的量才是基本物理量之一
错误 物质的量及其单位摩尔的使用范围是微观粒子
Help me!!!
×
×
×
(1)“物质的量”是一个整体,不可拆分、增字减字。
(2)物质的量仅用于计量微观粒子(分子、原子、离子、电子、中子、质子等),不适用于宏观物体.
(3)摩尔不是物理量,只是物质的量的这个物理量的单位。
(4)用摩尔表示物质的量时,要指明粒子的种类 。
(5)摩尔是一个巨大数量粒子的集合体,可以是整数,也可以是小数,如0.5molO2、 0.01molH2SO4等。但分子、原子等具体的粒子只能是整数而不能是0.5个或0.01个。
【想一想】应用“物质的量” 时应注意的问题:
那么到底用多少粒子作为一个
集合体最为合适呢?
疑惑:
1971年,第14届国际计量大会规定,
1mol粒子集合体所含粒子数与0.012kg
12C中所含碳原子数相同,约为6.02×1023
,把1mol粒子集合体所含粒子数叫做阿伏加
德罗常数。
12C原子是指原子核内
有6个质子和6个中子
的碳原子
2、阿伏加德罗常数
(为了纪念他的贡献,以他的名字命名。)
1)定义:1 mol 任何粒子的粒子数叫做阿伏加德罗常数。
NA ≈6.02×1023 mol -1
3)单位:mol -1
2)符号:NA
4)数值:
(1)如果把6.02×1023个直径为2.5cm的硬币排成一行,可以来回于地球与太阳之间240.8亿次
(2)如果把 6.02×1023 粒米给全球60亿人吃,每人每天吃一斤,要吃14万年。
感受阿伏加德罗常数
所以物质的量只用来表示原子、分子、离子等微观粒子
1mol粒子的粒子数
0.012Kg12C中所含原子数
阿伏加德罗常数
6.02×1023
约为
约为
约为
‖
‖
=
在0.5 mol O2中含有的氧分子数目约是多少?
解:
N(O2) = n(O2) × NA
= 3.01 × 1023
答:0.5 mol O2的氧分子数约为3.01 × 1023个。
[例题]
注意解题格式
先写出公式、后代入数字,带单位计算,得出结果,作答。
=0.5 mol× 6.02 ×1023 mol-1
课堂练习:
1、1 mol H2所含有氢分子的个数约为___________
2、1 mol O2 约含_____________个氧原子
3、1.204×1023个H2O的物质的量是 ____ mol, 其中氢原子的物质的量为________。
6.02×1023
1.204×1024
0.2
0.4mol
5、N个C原子的物质的量是________mol。
N/NA
4. 2molH2O中与1molH2SO4中所含氧原子数
之比为_____,含H的物质的量之比为_____
1:2
2:1
3、物质的量(n)、阿伏加德罗常数(NA)、粒子数(N)之间的关系
物质的量 =
粒子数
阿伏加德罗常数
NA
N
=
n
物质的量n
微粒数N
× NA
NA ÷
课堂小结
1、物质的量
1)定义 2)符号 3)单位 4)对象
2、阿伏伽德罗常数
1)定义 2)符号 3)单位 4)数值
3、物质的量(n)、阿伏加德罗常数(NA)、粒子数(N)之间的关系
NA
N
=
n
第一章 从实验学化学
第二节 化学计量在实验中的应用
第一课时 物质的量的单位
——摩尔
主讲:湖北红安一中 王卫明
[想一想]
1、大家都知道曹冲称象的故事吧,其中解决问题的主导思想是什么?
2、你能用托盘天平称一粒米的质量吗?
(化整为零,化大为小)
(积小成大,聚微为宏)
一打
一顶
一打:12顶
一瓶
一箱:24瓶
一箱
一张
一卷
一卷:36张
2H2 + O2 ====== 2H2O
点燃
宏观角度:
微观角度:
物质之间发生化学反应的实质:以微观粒子进行。
4 g 32 g 36 g
2个氢分子 1个氧分子 2个水分子
微观粒子与可称量的物质之间
是通过什么联系的呢?
一滴水中所含的水分子数,让10亿人去数,每人每分钟数100个,日夜不停的数,需要3万年才能数完。
当个体数量大时,人们习惯以集体为单位统计个体数量。因此当微观粒子的数量很大,我们也将以集体为单位对其进行计算
你知道吗?
物理量 单位名称 单位符号
长度 l 米 m
质量 m 千克 Kg
时间 t 秒 s
电流 I 安培 A
物质的量n 摩尔 mol
热力学温度T 开尔文 K
发光强度 坎德拉 cd
国际单位制(SI)的7个基本物理量
是国际单位制七个基本物理量之一
1).定义:
2).符号:
3).单位:
4). 对象:
表示物质所含微粒多少的一个物理量,
也表示含有一定数目粒子的集体
n
摩尔(mol)
1.物质的量
微观粒子(分子、原子、离子、
原子团、电子、中子、质子等)
注 意
1mol 氢 ( )
仅用于计量微观粒子
使用时必须指明粒子种类
1mol 瓜子( )
1mol 大米( )
×
×
×
1mol 橙子( )
×
判断下列说法是否正确
(A)氧的物质的量为1 mol
(B)1.5 molO2
(C)2mol H+
(D)摩尔是7个基本物理量之一
(E)0.5 mol 大米
随堂练习
错误,必须指明微粒的种类,是氧原子、氧分子还是氧离子,改为 1mol O
正确
正确
错误 摩尔是物质的量的单位,物质的量才是基本物理量之一
错误 物质的量及其单位摩尔的使用范围是微观粒子
Help me!!!
×
×
×
(1)“物质的量”是一个整体,不可拆分、增字减字。
(2)物质的量仅用于计量微观粒子(分子、原子、离子、电子、中子、质子等),不适用于宏观物体.
(3)摩尔不是物理量,只是物质的量的这个物理量的单位。
(4)用摩尔表示物质的量时,要指明粒子的种类 。
(5)摩尔是一个巨大数量粒子的集合体,可以是整数,也可以是小数,如0.5molO2、 0.01molH2SO4等。但分子、原子等具体的粒子只能是整数而不能是0.5个或0.01个。
【想一想】应用“物质的量” 时应注意的问题:
那么到底用多少粒子作为一个
集合体最为合适呢?
疑惑:
1971年,第14届国际计量大会规定,
1mol粒子集合体所含粒子数与0.012kg
12C中所含碳原子数相同,约为6.02×1023
,把1mol粒子集合体所含粒子数叫做阿伏加
德罗常数。
12C原子是指原子核内
有6个质子和6个中子
的碳原子
2、阿伏加德罗常数
(为了纪念他的贡献,以他的名字命名。)
1)定义:1 mol 任何粒子的粒子数叫做阿伏加德罗常数。
NA ≈6.02×1023 mol -1
3)单位:mol -1
2)符号:NA
4)数值:
(1)如果把6.02×1023个直径为2.5cm的硬币排成一行,可以来回于地球与太阳之间240.8亿次
(2)如果把 6.02×1023 粒米给全球60亿人吃,每人每天吃一斤,要吃14万年。
感受阿伏加德罗常数
所以物质的量只用来表示原子、分子、离子等微观粒子
1mol粒子的粒子数
0.012Kg12C中所含原子数
阿伏加德罗常数
6.02×1023
约为
约为
约为
‖
‖
=
在0.5 mol O2中含有的氧分子数目约是多少?
解:
N(O2) = n(O2) × NA
= 3.01 × 1023
答:0.5 mol O2的氧分子数约为3.01 × 1023个。
[例题]
注意解题格式
先写出公式、后代入数字,带单位计算,得出结果,作答。
=0.5 mol× 6.02 ×1023 mol-1
课堂练习:
1、1 mol H2所含有氢分子的个数约为___________
2、1 mol O2 约含_____________个氧原子
3、1.204×1023个H2O的物质的量是 ____ mol, 其中氢原子的物质的量为________。
6.02×1023
1.204×1024
0.2
0.4mol
5、N个C原子的物质的量是________mol。
N/NA
4. 2molH2O中与1molH2SO4中所含氧原子数
之比为_____,含H的物质的量之比为_____
1:2
2:1
3、物质的量(n)、阿伏加德罗常数(NA)、粒子数(N)之间的关系
物质的量 =
粒子数
阿伏加德罗常数
NA
N
=
n
物质的量n
微粒数N
× NA
NA ÷
课堂小结
1、物质的量
1)定义 2)符号 3)单位 4)对象
2、阿伏伽德罗常数
1)定义 2)符号 3)单位 4)数值
3、物质的量(n)、阿伏加德罗常数(NA)、粒子数(N)之间的关系
NA
N
=
n
