离子反应(1)
图片预览







文档简介
(共22张PPT)
离子反应
思考: 根据初中所学知识判断,下列物质中哪些能导电?为什么? 盐酸、NaOH溶液、NaCl固体、石墨、蔗糖溶液、K2SO4溶液、酒精溶液、Cu
思考: 溶液的导电能力由何决定 又有哪些溶液能导电呢
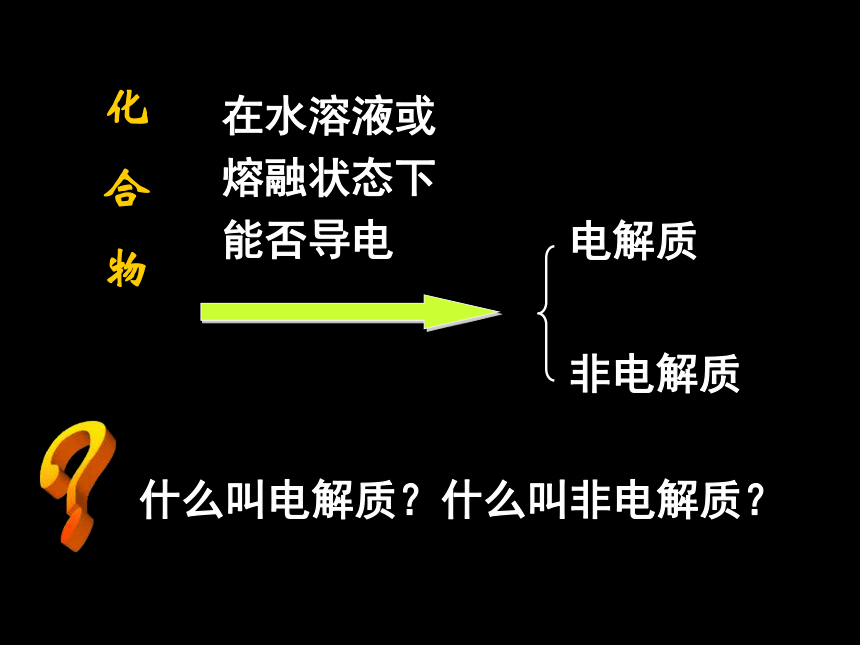
化合物
在水溶液或 熔融状态下 能否导电
电解质
非电解质
什么叫电解质?什么叫非电解质?
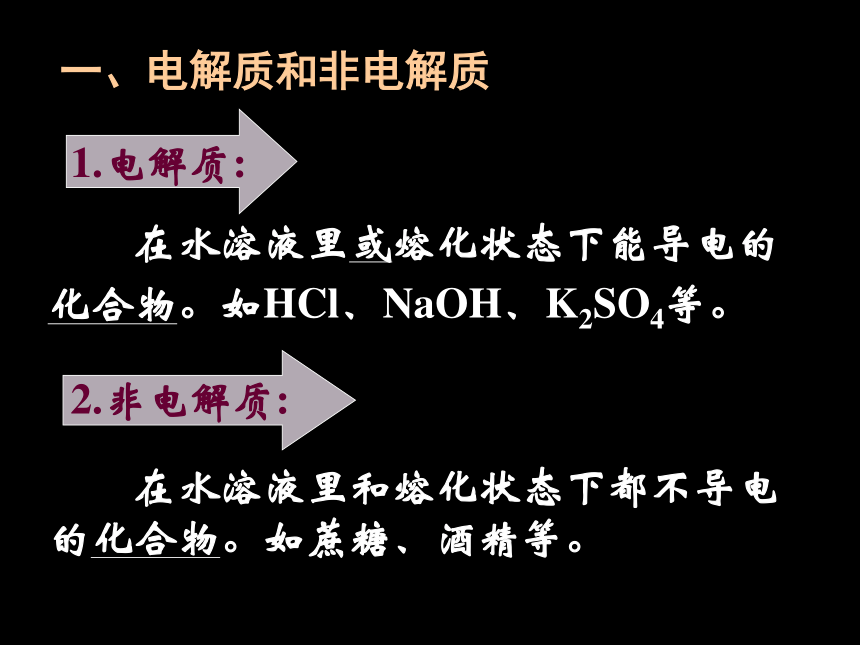
一、电解质和非电解质
在水溶液里或熔化状态下能导电的化合物。如HCl、NaOH、K2SO4等。
1.电解质:
一、电解质和非电解质
1.电解质:
在水溶液里或熔化状态下能导电的化合物。如HCl、NaOH、K2SO4等。
2.非电解质:
在水溶液里和熔化状态下都不导电的化合物。如蔗糖、酒精等。
思考: 理解电解质、非电解质概念时应注意 哪些问题?请结合下列问题加以讨论、分 析、归纳。
下列叙述正确的是( ) A.氯化钠溶液能导电,所以氯化钠溶液是电解质 B.固态氯化钠不导电,但氯化钠是电解质 C.氯化氢水溶液能导电,所以氯化氢是电解质 D.三氧化硫溶于水能导电,所以三氧化硫是电解质 E.铜能导电,所以是电解质
F.BaSO4的水溶液不能导电,所以BaSO4是非电解质
结论: 应注意以下几点: (1) 电解质、非电解应是化合物。
(2) 电解质导电须有外界条件:水溶液或熔化状态。
(3) 电解质应是在一定条件下本身电离而导电的化合物。某些化合物,像SO3、SO2、CO2、NH3,它们的水溶液虽能导电,但不是电解质,而是非电解质。因为它们溶于水跟水反应生成了电解质,这些电解质能电离而导电,并非这些化合物本身电离所为。
(4)某些难溶于水的化合物。如BaSO4、AgCl等,由 于它们溶解度太小,测不出(或难测)其水溶液的导电性,但它们溶解的部分是完全电离的,或在熔化状态下能完全电离,所以是难溶性强电解质。 (5)酸、碱、盐、水是电解质,蔗糖、酒精等是非电解质。
下列哪些是电解质: Cu、NaCl固体、NaOH固体、 K2SO4溶液、CO2、蔗糖、NaCl溶液、 H2O、酒精
思考: 作为电解质,其在一定条件下的导电能力是否相同呢?
二、强电解质和弱电解质
1.强电解质:
在水溶液中全部电离成离子的电 解质。如NaCl、HCl等。
二、强电解质和弱电解质
1.强电解质:
在水溶液中全部电离成离子的电 解质。如NaCl、HCl等。
2.弱电解质:
在水溶液中只一部分电离成离子 的电解质。如CH3COOH、 NH3·H2O、H2O等。
强电解质 弱电解质
电离程度 全部 部分
溶液里溶质 粒子 水合离子 分子、 水合离子
同条件下导 电性 强 弱
化合物类型 离子化合物、 某些共价化合物 某些共价 化合物
物质类别 大多数盐、 强碱、强酸 弱酸、弱碱、水、少部分盐
强弱电解质的对比
思考 为什么NaCl溶液等溶液能产生自 由移动的离子?
阅读课本P30第2、3段
三、电解质在溶液中的电离
电解质在溶液中的电离方程式:
思考
强酸:HCl= H2SO4= 强碱:NaOH= Ba(OH)2= 盐:NaCl= Na2CO3= NaHSO4= NaHCO3= 弱酸:CH3COOH= 弱碱:NH3·H2O=
结论:
弱电解质的在水溶液中是部分电离,是可逆的;强电解质在水溶液中则全部电离;多元弱酸的酸式盐对应的阴离子在水溶液中不能全部电离。
A
B
C
D
思考:
在200 mL混合酸中,盐酸与硫酸单位体积内所含的分子数相等,向此混合酸中加入Ba(OH)2溶液,原溶液中导电能力变化图示正确的是(纵坐标为导电能力,横坐标为加入Ba(OH)2溶液的体积V )
总结:强弱电解质、非电解质的分类和判断
1.强电解质
强酸
强碱
大多数盐
完全电离,用“=”
一般为离子化合物或 强极性共价化合物
2.弱电解质
弱电解质
弱酸
弱碱
少部分盐
部分电离,用可逆符号“ ”
一般为弱极性共价化合物
3.非电解质
酒精 、蔗糖、甲烷等有机物
CO2、 SO2、 SO3、NH3 等能和水反应的物质
4.既不是电解质,又不是非电解质
CI2、 Cu、 Fe等单质
盐酸 、稀硫酸、NaCl溶液(因属于混合物)
但若写成HCl、 H2SO4 、NH3 H2O可以认为是电解质
离子反应
思考: 根据初中所学知识判断,下列物质中哪些能导电?为什么? 盐酸、NaOH溶液、NaCl固体、石墨、蔗糖溶液、K2SO4溶液、酒精溶液、Cu
思考: 溶液的导电能力由何决定 又有哪些溶液能导电呢
化合物
在水溶液或 熔融状态下 能否导电
电解质
非电解质
什么叫电解质?什么叫非电解质?
一、电解质和非电解质
在水溶液里或熔化状态下能导电的化合物。如HCl、NaOH、K2SO4等。
1.电解质:
一、电解质和非电解质
1.电解质:
在水溶液里或熔化状态下能导电的化合物。如HCl、NaOH、K2SO4等。
2.非电解质:
在水溶液里和熔化状态下都不导电的化合物。如蔗糖、酒精等。
思考: 理解电解质、非电解质概念时应注意 哪些问题?请结合下列问题加以讨论、分 析、归纳。
下列叙述正确的是( ) A.氯化钠溶液能导电,所以氯化钠溶液是电解质 B.固态氯化钠不导电,但氯化钠是电解质 C.氯化氢水溶液能导电,所以氯化氢是电解质 D.三氧化硫溶于水能导电,所以三氧化硫是电解质 E.铜能导电,所以是电解质
F.BaSO4的水溶液不能导电,所以BaSO4是非电解质
结论: 应注意以下几点: (1) 电解质、非电解应是化合物。
(2) 电解质导电须有外界条件:水溶液或熔化状态。
(3) 电解质应是在一定条件下本身电离而导电的化合物。某些化合物,像SO3、SO2、CO2、NH3,它们的水溶液虽能导电,但不是电解质,而是非电解质。因为它们溶于水跟水反应生成了电解质,这些电解质能电离而导电,并非这些化合物本身电离所为。
(4)某些难溶于水的化合物。如BaSO4、AgCl等,由 于它们溶解度太小,测不出(或难测)其水溶液的导电性,但它们溶解的部分是完全电离的,或在熔化状态下能完全电离,所以是难溶性强电解质。 (5)酸、碱、盐、水是电解质,蔗糖、酒精等是非电解质。
下列哪些是电解质: Cu、NaCl固体、NaOH固体、 K2SO4溶液、CO2、蔗糖、NaCl溶液、 H2O、酒精
思考: 作为电解质,其在一定条件下的导电能力是否相同呢?
二、强电解质和弱电解质
1.强电解质:
在水溶液中全部电离成离子的电 解质。如NaCl、HCl等。
二、强电解质和弱电解质
1.强电解质:
在水溶液中全部电离成离子的电 解质。如NaCl、HCl等。
2.弱电解质:
在水溶液中只一部分电离成离子 的电解质。如CH3COOH、 NH3·H2O、H2O等。
强电解质 弱电解质
电离程度 全部 部分
溶液里溶质 粒子 水合离子 分子、 水合离子
同条件下导 电性 强 弱
化合物类型 离子化合物、 某些共价化合物 某些共价 化合物
物质类别 大多数盐、 强碱、强酸 弱酸、弱碱、水、少部分盐
强弱电解质的对比
思考 为什么NaCl溶液等溶液能产生自 由移动的离子?
阅读课本P30第2、3段
三、电解质在溶液中的电离
电解质在溶液中的电离方程式:
思考
强酸:HCl= H2SO4= 强碱:NaOH= Ba(OH)2= 盐:NaCl= Na2CO3= NaHSO4= NaHCO3= 弱酸:CH3COOH= 弱碱:NH3·H2O=
结论:
弱电解质的在水溶液中是部分电离,是可逆的;强电解质在水溶液中则全部电离;多元弱酸的酸式盐对应的阴离子在水溶液中不能全部电离。
A
B
C
D
思考:
在200 mL混合酸中,盐酸与硫酸单位体积内所含的分子数相等,向此混合酸中加入Ba(OH)2溶液,原溶液中导电能力变化图示正确的是(纵坐标为导电能力,横坐标为加入Ba(OH)2溶液的体积V )
总结:强弱电解质、非电解质的分类和判断
1.强电解质
强酸
强碱
大多数盐
完全电离,用“=”
一般为离子化合物或 强极性共价化合物
2.弱电解质
弱电解质
弱酸
弱碱
少部分盐
部分电离,用可逆符号“ ”
一般为弱极性共价化合物
3.非电解质
酒精 、蔗糖、甲烷等有机物
CO2、 SO2、 SO3、NH3 等能和水反应的物质
4.既不是电解质,又不是非电解质
CI2、 Cu、 Fe等单质
盐酸 、稀硫酸、NaCl溶液(因属于混合物)
但若写成HCl、 H2SO4 、NH3 H2O可以认为是电解质
