氧化还原反应第一课时
图片预览






文档简介
(共21张PPT)
第三节 氧化还原反应(一)
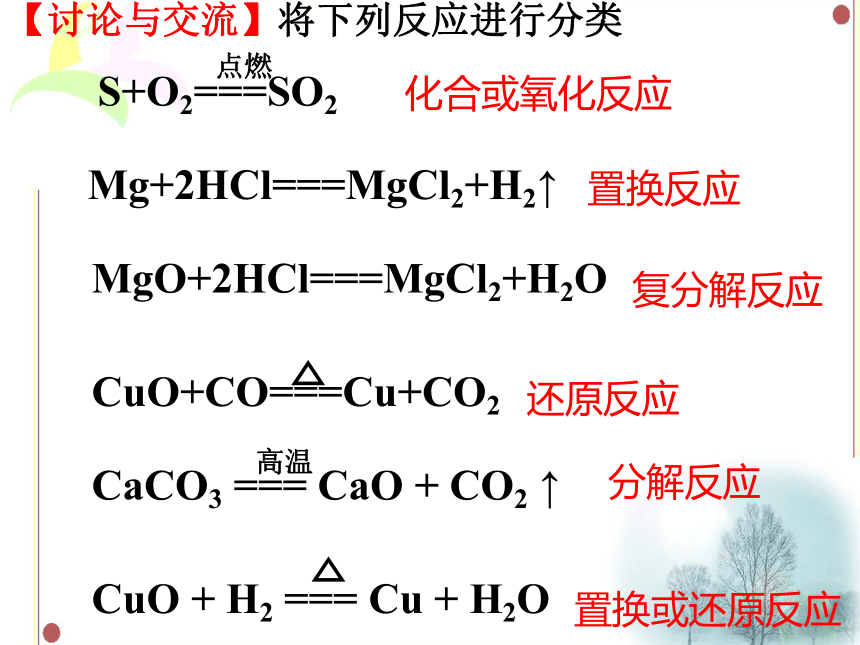
【讨论与交流】将下列反应进行分类
S+O2===SO2
Mg+2HCl===MgCl2+H2↑
MgO+2HCl===MgCl2+H2O
CuO+CO===Cu+CO2
CaCO3 === CaO + CO2 ↑
CuO + H2 === Cu + H2O
点燃
高温
复分解反应
分解反应
化合或氧化反应
置换反应
置换或还原反应
还原反应
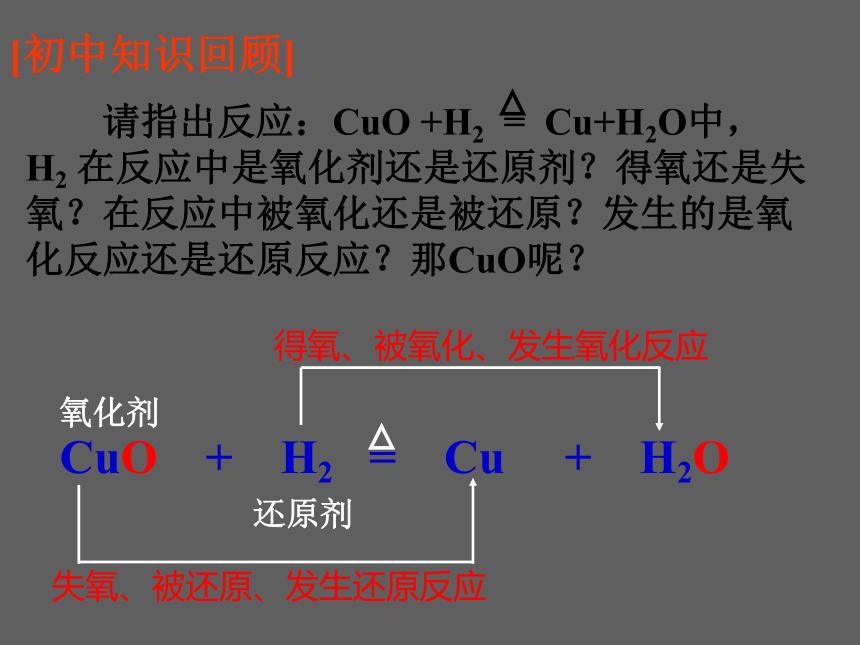
[初中知识回顾]
请指出反应:CuO +H2 = Cu+H2O中, H2 在反应中是氧化剂还是还原剂?得氧还是失氧?在反应中被氧化还是被还原?发生的是氧化反应还是还原反应?那CuO呢?
CuO + H2 = Cu + H2O
还原剂
得氧、被氧化、发生氧化反应
氧化剂
失氧、被还原、发生还原反应
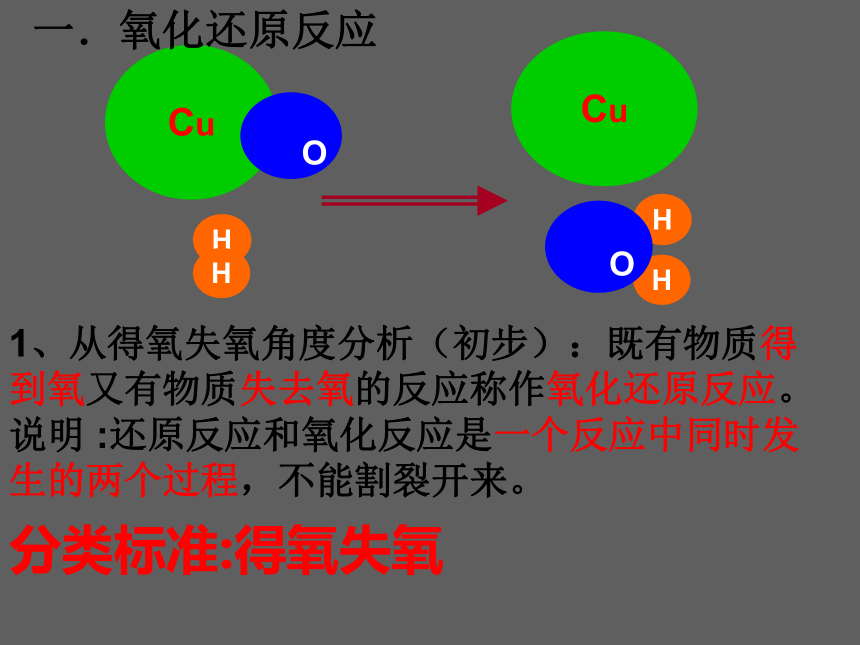
Cu
O
H
H
Cu
H
H
O
分类标准:得氧失氧
一.氧化还原反应
1、从得氧失氧角度分析(初步):既有物质得到氧又有物质失去氧的反应称作氧化还原反应。
说明 :还原反应和氧化反应是一个反应中同时发生的两个过程,不能割裂开来。
请模仿分析氢气还原氧化铜反应的方法,指出下列反应是否属于氧化还原反应。如果是,请标明反应前后元素的化合价,并指出化合价发生改变了的元素。
[思考与探究]
高温
⑴Fe2O3 + 3CO == 2Fe + 3CO2
还原剂
氧化剂
得氧、被氧化、发生氧化反应
失氧、被还原、发生还原反应
+3
0
+2
+4
⑴Fe2O3+3CO == 2Fe+3CO2
⑵Ag2O+H2 == 2Ag + H2O
高温
根据你对上述两个反应的分析,回答下列问题:
⑴以上两个氧化还原反应中除了都发生得氧、失氧外,还有什么共同的特征?
⑵这两个氧化还原反应中,氧化剂、还原剂的化合价在反应前后有什么共同特征?
[思考与交流1]
⑵Ag2O + H2 = 2Ag + H2O
还原剂
氧化剂
得氧、被氧化、发生氧化反应
失氧、被还原、发生还原反应
+1
0
0
+1
[思考与交流2]
请分析下列反应中各种元素的化合价在反应前后有无变化,如何变化。
Fe + CuSO4 == FeSO4 + Cu
Mg + 2HCl == MgCl2 + H2
S + O2 === SO2
CuO + H2 === Cu + H2O
点燃
0
+2
+2
0
0
+2
+1
0
0
+4
0
+2
0
0
+1
是否只有得失氧的反应才是氧化还原反应呢 上述反应都是氧化还原反应吗 那化合价升降与氧化还原反应之间存在什么样的联系呢?
-2
2、从化合价升降角度分析(特征) :凡是有元素化合价升降的化学反应有都是氧化还原反应。
氧化剂:
化合价降低 被还原 得到还原产物
还原剂:
化合价升高 被氧化 得到氧化产物
分类标准:化合价升降
讨论:化合价的升降是什么原因引起的?氧化还原反应的本质到底是什么?
2Na + Cl2 = 2NaCl
+11
+17
+17
+11
Na+ Cl-
Na
Cl
Cl-
Na+
化合价的升降——电子的得失
失电子,化合价升高,被氧化
得电子,化合价降低,被还原
0
0
+1
-1
H Cl
+17
+1
+1
+17
H Cl
+1 -1
H
Cl
HCl
化合价的升降—共用电子对的偏移
H2 + Cl2 = 2HCl
电子对偏离,化合价升高,被氧化
0
0
+1
-1
电子对偏向,化合价降低,被还原
3、从电子转移角度分析(实质) :凡有电子转移(电子得失或共用电子对偏移)的化学反应都是氧化还原反应。
小结 氧化还原反应
◆从得氧失氧角度分析
说明:仅局限于得氧失氧的反应。
◆从化合价升降角度分析
说明:元素化合价升降是氧化还原反应的表观特征,
可作为氧化还原反应的判断依据。
◆从电子转移角度分析
说明:氧化还原反应的本质是电子转移。
既有物质得到氧又有物质失去氧的反应 氧化还原反应。
有元素化合价升降的化学反应是氧化还原反应。
有电子转移(得失或偏移)的化学反应是氧化还原反应。
升失氧化降得还
实质就在得失间
氧化还原存一体
对立统一是必然
C + 2CuO == 2Cu + CO2 ↑
高温
判断下列反应是否为氧化还原反应,找出四种基本反应类型与氧化还原反应的关系。
3Fe + 2O2 == Fe3O4
点燃
H2O+ CaO == Ca(OH)2
CaCO3 == CaO + CO2
高温
2HgO == 2Hg + O2
△
Zn + H2SO4 = ZnSO4 + H2↑
BaCl2 + Na2SO4 = 2NaCl + BaSO4↓
NaCl +AgNO3= NaNO3 + AgCl↓
⑴
⑵
⑶
⑷
【回顾·迁移·应用】
·
①集合法:
氧化还原反应与四种基本反应的关系:
复分解反应
置换反应
化合反应
分解反应
氧化还原反应
非氧化还原反应
②交叉分类法:
1、下列说法正确的是( )
A.氧化还原反应的本质是元素化合价发生变化
B.还原剂是一种能够得到电子的物质
C.物质所含元素化合价升高的反应是还原反应
D.氧化反应和还原反应是同时发生的
2、氧化还原反应的实质是 ( )
A.化合价的升降
B.分子中各原子重新组合
C.电子的得失或偏移
D.氧原子的得失
D
C
【巩固练习】
3、下列化学反应中,属于氧化还原反应的是( )
A.Na2CO3+CaCl2=CaCO3↓+2NaCl
B.Fe+CuSO4=Cu+FeSO4
C.2NaHCO3 = Na2CO3+CO2↑+H2O
D.CaO+H2O=Ca(OH)2
4、属于氧化还原反应的离子方程式的是( )
A.CaCO3+2H+ = Ca2++CO2↑+H2O
B.Ba2++SO42- = BaSO4↓
C.HCO3 +H+ = CO2 +H2O
D.2Na+2H2O = 2Na++2OH +H2↑
B
D
6、在下列反应中,HCl中氯元素的化合价发生变化的是( ),HCl中氢元素的化合价发生变化的是( )
A、NaOH + HCl = NaCl + H2O
B、Zn +2HCl = ZnCl2 + H2
C、MnO2 + 4HCl(浓) == MnCl2 + 2H2O + Cl2
D、CuO + 2HCl = CuCl2 + H2O
C
C
B
5.某元素在化学反应中由化合态(化合物)变为游离态(单质),则该元素( )
A.一定被氧化
B.一定被还原
C.可能被氧化,也可能被还原
D.以上都不是
第三节 氧化还原反应(一)
【讨论与交流】将下列反应进行分类
S+O2===SO2
Mg+2HCl===MgCl2+H2↑
MgO+2HCl===MgCl2+H2O
CuO+CO===Cu+CO2
CaCO3 === CaO + CO2 ↑
CuO + H2 === Cu + H2O
点燃
高温
复分解反应
分解反应
化合或氧化反应
置换反应
置换或还原反应
还原反应
[初中知识回顾]
请指出反应:CuO +H2 = Cu+H2O中, H2 在反应中是氧化剂还是还原剂?得氧还是失氧?在反应中被氧化还是被还原?发生的是氧化反应还是还原反应?那CuO呢?
CuO + H2 = Cu + H2O
还原剂
得氧、被氧化、发生氧化反应
氧化剂
失氧、被还原、发生还原反应
Cu
O
H
H
Cu
H
H
O
分类标准:得氧失氧
一.氧化还原反应
1、从得氧失氧角度分析(初步):既有物质得到氧又有物质失去氧的反应称作氧化还原反应。
说明 :还原反应和氧化反应是一个反应中同时发生的两个过程,不能割裂开来。
请模仿分析氢气还原氧化铜反应的方法,指出下列反应是否属于氧化还原反应。如果是,请标明反应前后元素的化合价,并指出化合价发生改变了的元素。
[思考与探究]
高温
⑴Fe2O3 + 3CO == 2Fe + 3CO2
还原剂
氧化剂
得氧、被氧化、发生氧化反应
失氧、被还原、发生还原反应
+3
0
+2
+4
⑴Fe2O3+3CO == 2Fe+3CO2
⑵Ag2O+H2 == 2Ag + H2O
高温
根据你对上述两个反应的分析,回答下列问题:
⑴以上两个氧化还原反应中除了都发生得氧、失氧外,还有什么共同的特征?
⑵这两个氧化还原反应中,氧化剂、还原剂的化合价在反应前后有什么共同特征?
[思考与交流1]
⑵Ag2O + H2 = 2Ag + H2O
还原剂
氧化剂
得氧、被氧化、发生氧化反应
失氧、被还原、发生还原反应
+1
0
0
+1
[思考与交流2]
请分析下列反应中各种元素的化合价在反应前后有无变化,如何变化。
Fe + CuSO4 == FeSO4 + Cu
Mg + 2HCl == MgCl2 + H2
S + O2 === SO2
CuO + H2 === Cu + H2O
点燃
0
+2
+2
0
0
+2
+1
0
0
+4
0
+2
0
0
+1
是否只有得失氧的反应才是氧化还原反应呢 上述反应都是氧化还原反应吗 那化合价升降与氧化还原反应之间存在什么样的联系呢?
-2
2、从化合价升降角度分析(特征) :凡是有元素化合价升降的化学反应有都是氧化还原反应。
氧化剂:
化合价降低 被还原 得到还原产物
还原剂:
化合价升高 被氧化 得到氧化产物
分类标准:化合价升降
讨论:化合价的升降是什么原因引起的?氧化还原反应的本质到底是什么?
2Na + Cl2 = 2NaCl
+11
+17
+17
+11
Na+ Cl-
Na
Cl
Cl-
Na+
化合价的升降——电子的得失
失电子,化合价升高,被氧化
得电子,化合价降低,被还原
0
0
+1
-1
H Cl
+17
+1
+1
+17
H Cl
+1 -1
H
Cl
HCl
化合价的升降—共用电子对的偏移
H2 + Cl2 = 2HCl
电子对偏离,化合价升高,被氧化
0
0
+1
-1
电子对偏向,化合价降低,被还原
3、从电子转移角度分析(实质) :凡有电子转移(电子得失或共用电子对偏移)的化学反应都是氧化还原反应。
小结 氧化还原反应
◆从得氧失氧角度分析
说明:仅局限于得氧失氧的反应。
◆从化合价升降角度分析
说明:元素化合价升降是氧化还原反应的表观特征,
可作为氧化还原反应的判断依据。
◆从电子转移角度分析
说明:氧化还原反应的本质是电子转移。
既有物质得到氧又有物质失去氧的反应 氧化还原反应。
有元素化合价升降的化学反应是氧化还原反应。
有电子转移(得失或偏移)的化学反应是氧化还原反应。
升失氧化降得还
实质就在得失间
氧化还原存一体
对立统一是必然
C + 2CuO == 2Cu + CO2 ↑
高温
判断下列反应是否为氧化还原反应,找出四种基本反应类型与氧化还原反应的关系。
3Fe + 2O2 == Fe3O4
点燃
H2O+ CaO == Ca(OH)2
CaCO3 == CaO + CO2
高温
2HgO == 2Hg + O2
△
Zn + H2SO4 = ZnSO4 + H2↑
BaCl2 + Na2SO4 = 2NaCl + BaSO4↓
NaCl +AgNO3= NaNO3 + AgCl↓
⑴
⑵
⑶
⑷
【回顾·迁移·应用】
·
①集合法:
氧化还原反应与四种基本反应的关系:
复分解反应
置换反应
化合反应
分解反应
氧化还原反应
非氧化还原反应
②交叉分类法:
1、下列说法正确的是( )
A.氧化还原反应的本质是元素化合价发生变化
B.还原剂是一种能够得到电子的物质
C.物质所含元素化合价升高的反应是还原反应
D.氧化反应和还原反应是同时发生的
2、氧化还原反应的实质是 ( )
A.化合价的升降
B.分子中各原子重新组合
C.电子的得失或偏移
D.氧原子的得失
D
C
【巩固练习】
3、下列化学反应中,属于氧化还原反应的是( )
A.Na2CO3+CaCl2=CaCO3↓+2NaCl
B.Fe+CuSO4=Cu+FeSO4
C.2NaHCO3 = Na2CO3+CO2↑+H2O
D.CaO+H2O=Ca(OH)2
4、属于氧化还原反应的离子方程式的是( )
A.CaCO3+2H+ = Ca2++CO2↑+H2O
B.Ba2++SO42- = BaSO4↓
C.HCO3 +H+ = CO2 +H2O
D.2Na+2H2O = 2Na++2OH +H2↑
B
D
6、在下列反应中,HCl中氯元素的化合价发生变化的是( ),HCl中氢元素的化合价发生变化的是( )
A、NaOH + HCl = NaCl + H2O
B、Zn +2HCl = ZnCl2 + H2
C、MnO2 + 4HCl(浓) == MnCl2 + 2H2O + Cl2
D、CuO + 2HCl = CuCl2 + H2O
C
C
B
5.某元素在化学反应中由化合态(化合物)变为游离态(单质),则该元素( )
A.一定被氧化
B.一定被还原
C.可能被氧化,也可能被还原
D.以上都不是
