人教版高二化学选修4第三章第一节 弱电解质的电离(共20张PPT)
文档属性
| 名称 | 人教版高二化学选修4第三章第一节 弱电解质的电离(共20张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 3.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-06-03 14:59:24 | ||
图片预览








文档简介
(共20张PPT)
第三章第一节
弱电解质的电离
主要成分:盐酸
主要成分:醋酸
二者在化学性质方面有什么不同呢?
(1)了解强电解质、弱电解质在水溶液中
电离程度的差异,能判断常见的强电解质和弱电解质。
(2)会书写常见弱电解质的电离方程式
(3)掌握弱电解质的电离平衡及其影响因
素,会判断外界条件对电离平衡的影响。
教学目标
重难点:弱电解质的电离平衡
一、强弱电解质
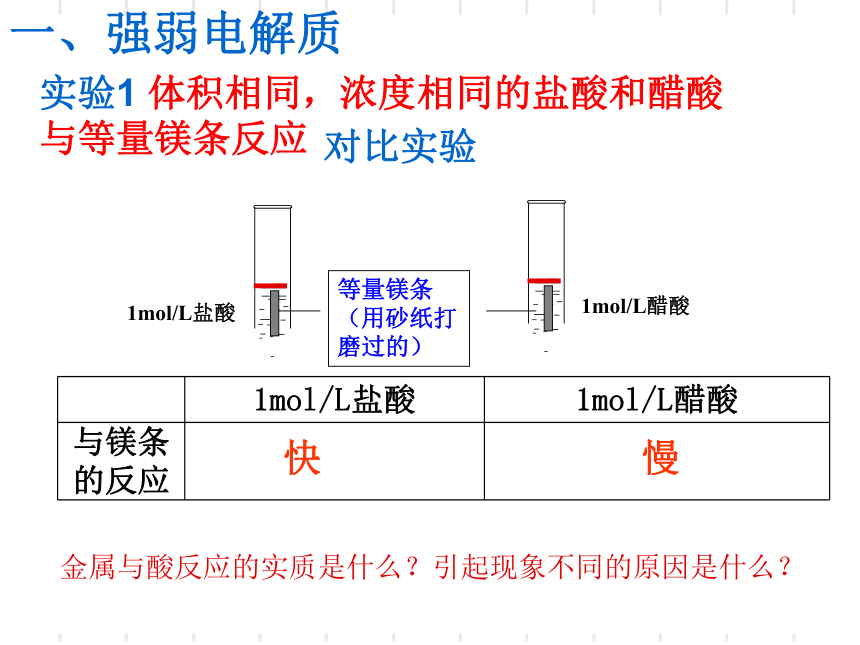
实验1
体积相同,浓度相同的盐酸和醋酸与等量镁条反应
1mol/L盐酸
1mol/L醋酸
对比实验
快
慢
金属与酸反应的实质是什么?引起现象不同的原因是什么?
1mol/L盐酸
1mol/L醋酸
与镁条的反应
实验2:
用pH试纸测定0.1mol/L的盐酸、醋酸pH。
实验数据:pH(HCl)
=
1
pH(CH3COOH)
=
3
数据处理:
结
论:
盐酸完全电离,
电离程度(即电离度)为100%;
醋酸不完全电离,
电离程度较小,且小于100%,
即醋酸的电离是可逆的。
0.1mol/L
HCl
c(H+)
=
0.1mol/L
0.1mol/L
CH3COOH
c(H+)
=
0.001mol/L
实验结果:
相同浓度的盐酸与醋酸,其溶液中
C(
H+盐酸)>
C(
H+醋酸)
结论:HCl和CH3COOH的电离程度不同。
盐酸与醋酸在水中的电离示意图
观察两种溶液中溶质微粒有多少种?
盐酸在水中的电离示意图
醋酸在水中的电离示意图
说明
HCl分子在水中完全电离
醋酸分子在水中部分电离
强电解质和弱电解质
强电解质:在水溶液中能全部电离成
离子的电解质。
弱电解质:在水溶液中只部分电离成
离子的电解质。
1、定义
HCl
=
H++
Cl-
常见的强电解质:
强酸、强碱、大部分盐。
常见的弱电解质:
弱酸、弱碱、水。
2、常见强、弱电解质
练一练
判断下列物质是不是电解质,属强电解质的有哪些?属弱电解质的有哪些?
NaCl、
NaOH
、
H2SO4、CH3COOH、NH3·H2O、Cl2、Cu、BaSO4、H2O
强电解质:
NaCl
NaOH
H2SO4
BaSO4
弱电解质:
CH3COOH
NH3·H2O
H2O
强弱电解质的区分依据不是看该物质水溶性的大小,也不是看其水溶液导电能力的强弱,而是看电离的是否完全。
电解质溶于水或者受热熔化时,离解成自由移动的离子的过程叫做电离。
二、电解质的电离
1、电离
2、电离方程式
用来表示电离过程的式子叫做电离方程式。
3、电离方程式的书写:
(1)式子左边用电离物质的化学式表示,右边用离子符号表示。
(2)强电解质用“=”表示电离过程,弱电解质用“
”
表示电离过程。
(4)多元弱碱分步电离(较复杂),中学阶段要求一步写出。
如:
Cu(OH)2
Cu2+
+
2OH-
(3)多元弱酸的电离要分步。
练习:写出H3PO4在水溶液中的电离方程式
H3PO4
H+
+
H2PO4-
(1)
H2PO4-
H+
+
HPO42-
(2)
HPO42-
H+
+
PO43-
(3)
练一练
用电离方程式表示下列物质的电离过程
H2CO3
HClO
HCl
Fe(OH)3
NaCl
CH3COOH
NH3?H2O
H2O
完全电离
部分电离
不可逆过程
可逆过程
用等号
用可逆符号
离子
分子、离子
离子符号
分子
强酸、强碱、多数盐、
弱酸、弱碱、水
小结:强弱电解质的比较
强电解质
弱电解质
相同点
都是电解质,在水溶液中都能电离。
电离程度
电离过程
表示方法
电解质在溶液中微粒形式
离子方程式中表示形式
物质种类
醋酸在电离过程中各微粒浓度的变化
CH3COOH
CH3COO
-
+
H+
接近0
接近0
最大
不变
不变
不变
迁移应用
C(H+)
C(Ac-)
C(HAc)
HAc初溶于水
紧接着
最后
弱电解质电离的v-t图像
0
t
v
平衡状态
在一定条件(如温度、浓度)下,当电解质分子电离成离子的速率和
离子重新结合成分子的速率相等时,电离过程就达到了平衡状态——电离平衡,此时溶液中各分子、离子的浓度保持不变的状态。
特点:
逆、等、动、定、变
影响电离平衡的因素
①温度
②浓度
③同离子效应
④化学反应
内因:电解质本身的性质。
通常电解质越弱电离程度越小。
外
因
外界条件改变时符合“勒夏特列原理”
完成表格:
正向
增大
增大
减小
逆向
增大
减小
增大
正向
减小
增大
减小
逆向
减小
增大
增大
正向
增大
增大
增大
正向
减小
减小
减小
增大
减小
增大
增大
减小
减小
改变条件
平衡移
动方向
C(H+)
C(Ac---)
C(HAc)
电离
程度
加
热
加
盐
酸
加
NaOH(s)
加醋酸钠(s)
加
醋
酸
加
水
小结:
电解质
强电解质
弱电解质
(全部电离)
(部分电离)
电离过程是可逆的
电离平衡
电离平衡的移动
浓度
温度
内因
外因
第三章第一节
弱电解质的电离
主要成分:盐酸
主要成分:醋酸
二者在化学性质方面有什么不同呢?
(1)了解强电解质、弱电解质在水溶液中
电离程度的差异,能判断常见的强电解质和弱电解质。
(2)会书写常见弱电解质的电离方程式
(3)掌握弱电解质的电离平衡及其影响因
素,会判断外界条件对电离平衡的影响。
教学目标
重难点:弱电解质的电离平衡
一、强弱电解质
实验1
体积相同,浓度相同的盐酸和醋酸与等量镁条反应
1mol/L盐酸
1mol/L醋酸
对比实验
快
慢
金属与酸反应的实质是什么?引起现象不同的原因是什么?
1mol/L盐酸
1mol/L醋酸
与镁条的反应
实验2:
用pH试纸测定0.1mol/L的盐酸、醋酸pH。
实验数据:pH(HCl)
=
1
pH(CH3COOH)
=
3
数据处理:
结
论:
盐酸完全电离,
电离程度(即电离度)为100%;
醋酸不完全电离,
电离程度较小,且小于100%,
即醋酸的电离是可逆的。
0.1mol/L
HCl
c(H+)
=
0.1mol/L
0.1mol/L
CH3COOH
c(H+)
=
0.001mol/L
实验结果:
相同浓度的盐酸与醋酸,其溶液中
C(
H+盐酸)>
C(
H+醋酸)
结论:HCl和CH3COOH的电离程度不同。
盐酸与醋酸在水中的电离示意图
观察两种溶液中溶质微粒有多少种?
盐酸在水中的电离示意图
醋酸在水中的电离示意图
说明
HCl分子在水中完全电离
醋酸分子在水中部分电离
强电解质和弱电解质
强电解质:在水溶液中能全部电离成
离子的电解质。
弱电解质:在水溶液中只部分电离成
离子的电解质。
1、定义
HCl
=
H++
Cl-
常见的强电解质:
强酸、强碱、大部分盐。
常见的弱电解质:
弱酸、弱碱、水。
2、常见强、弱电解质
练一练
判断下列物质是不是电解质,属强电解质的有哪些?属弱电解质的有哪些?
NaCl、
NaOH
、
H2SO4、CH3COOH、NH3·H2O、Cl2、Cu、BaSO4、H2O
强电解质:
NaCl
NaOH
H2SO4
BaSO4
弱电解质:
CH3COOH
NH3·H2O
H2O
强弱电解质的区分依据不是看该物质水溶性的大小,也不是看其水溶液导电能力的强弱,而是看电离的是否完全。
电解质溶于水或者受热熔化时,离解成自由移动的离子的过程叫做电离。
二、电解质的电离
1、电离
2、电离方程式
用来表示电离过程的式子叫做电离方程式。
3、电离方程式的书写:
(1)式子左边用电离物质的化学式表示,右边用离子符号表示。
(2)强电解质用“=”表示电离过程,弱电解质用“
”
表示电离过程。
(4)多元弱碱分步电离(较复杂),中学阶段要求一步写出。
如:
Cu(OH)2
Cu2+
+
2OH-
(3)多元弱酸的电离要分步。
练习:写出H3PO4在水溶液中的电离方程式
H3PO4
H+
+
H2PO4-
(1)
H2PO4-
H+
+
HPO42-
(2)
HPO42-
H+
+
PO43-
(3)
练一练
用电离方程式表示下列物质的电离过程
H2CO3
HClO
HCl
Fe(OH)3
NaCl
CH3COOH
NH3?H2O
H2O
完全电离
部分电离
不可逆过程
可逆过程
用等号
用可逆符号
离子
分子、离子
离子符号
分子
强酸、强碱、多数盐、
弱酸、弱碱、水
小结:强弱电解质的比较
强电解质
弱电解质
相同点
都是电解质,在水溶液中都能电离。
电离程度
电离过程
表示方法
电解质在溶液中微粒形式
离子方程式中表示形式
物质种类
醋酸在电离过程中各微粒浓度的变化
CH3COOH
CH3COO
-
+
H+
接近0
接近0
最大
不变
不变
不变
迁移应用
C(H+)
C(Ac-)
C(HAc)
HAc初溶于水
紧接着
最后
弱电解质电离的v-t图像
0
t
v
平衡状态
在一定条件(如温度、浓度)下,当电解质分子电离成离子的速率和
离子重新结合成分子的速率相等时,电离过程就达到了平衡状态——电离平衡,此时溶液中各分子、离子的浓度保持不变的状态。
特点:
逆、等、动、定、变
影响电离平衡的因素
①温度
②浓度
③同离子效应
④化学反应
内因:电解质本身的性质。
通常电解质越弱电离程度越小。
外
因
外界条件改变时符合“勒夏特列原理”
完成表格:
正向
增大
增大
减小
逆向
增大
减小
增大
正向
减小
增大
减小
逆向
减小
增大
增大
正向
增大
增大
增大
正向
减小
减小
减小
增大
减小
增大
增大
减小
减小
改变条件
平衡移
动方向
C(H+)
C(Ac---)
C(HAc)
电离
程度
加
热
加
盐
酸
加
NaOH(s)
加醋酸钠(s)
加
醋
酸
加
水
小结:
电解质
强电解质
弱电解质
(全部电离)
(部分电离)
电离过程是可逆的
电离平衡
电离平衡的移动
浓度
温度
内因
外因
