人教高二化学选修4第三章 第二节 水的电离和溶液的酸碱性(共21张PPT)
文档属性
| 名称 | 人教高二化学选修4第三章 第二节 水的电离和溶液的酸碱性(共21张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 581.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-06-03 20:42:48 | ||
图片预览






文档简介
(共21张PPT)
人教版高二化学选修四
《酸碱中和滴定》
第三章
水溶液中的离子平衡
李婧
2017年4月
第二节
水的电离和溶液的酸碱性
第三课时
酸碱中和滴定
酸
碱
中
和
滴
定
初试锋芒
亲临体会
成果展示
合作探究
酸
碱
中
和
滴
定
初试锋芒
亲临体会
成果展示
合作探究
用已知物质的量浓度的强酸或强碱来测定未知物质的量浓度的强碱或强酸。
2、原理:
H+
+
OH-
=
H2O
初试锋芒
思考一:酸碱中和滴定原理?
1、目的:
(1)准确量取待测NaOH溶液的体积
【思考二】:酸碱滴定的关键是什么?
(2)准确判断滴定终点
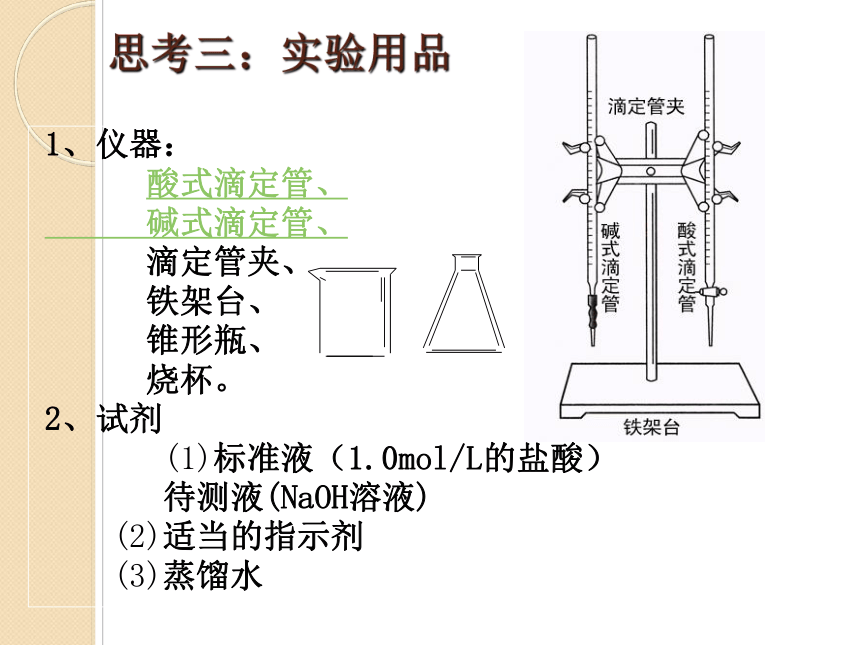
思考三:实验用品
1、仪器:
酸式滴定管、
碱式滴定管、
滴定管夹、
铁架台、
锥形瓶、
烧杯。
2、试剂
(1)标准液(1.0mol/L的盐酸)
待测液(NaOH溶液)
(2)适当的指示剂
(3)蒸馏水
红
橙
黄
红
紫
蓝
无色
粉红
红
注意:
石蕊不用做酸碱中和滴定的指示剂
思考四
酸碱滴定管的特点和使用要求
精确度:0.01mL
?
你读得准吗?
答案:25.60mL
酸
碱
中
和
滴
定
初试锋芒
亲临体会
成果展示
合作探究
用1.00mol/L的盐酸(标准液)滴定NaOH(待测)为例
1、酸碱中和滴定的操作步骤
1、查漏
滴定前的准备
5、注:向锥形瓶中加
入NaOH溶液20.00mL
2、洗涤、润洗(2~3次)
3、装液、排气泡
4、调节起始刻度、记录(两管)
6、加:加2~3滴指示剂
(并在瓶底衬一张白纸)
2、滴定过程
“三个动作”
左手控制旋塞,
右手摇晃锥形瓶,
眼睛注视锥形瓶内颜色的变化。
3、滴定终点的判断
最后一滴滴入时,溶液由红色变成无色,
且半分钟内不恢复红色。
用1.00mol/L的盐酸(标准液)滴定NaOH(待测)为例
当恰好中和(指示剂变色)时有:
nHCl=nNaOH
cHClVHCl=cNaOHVNaOH
4、数据处理
操作2~3次取平均值代入公式计算:
特别注意:滴定过程的数据偏差大的数据
可以直接舍弃!。
次
数
待测液体积(L)
标准液体积(L)
滴定前
滴定后
实际
平均值
1
2
酸
碱
中
和
滴
定
初试锋芒
亲临体会
成果展示
合作探究
酸
碱
中
和
滴
定
初试锋芒
亲临体会
成果展示
合作探究
合作探究:
达到滴定终点时,酸碱是否恰好完全反应?
由于酚酞变色范围是8.2------10.0,当溶液由红色变成无色时,只能说明溶液的PH值小于8.2,所以不一定恰好完全反应。
人教版高二化学选修四
《酸碱中和滴定》
第三章
水溶液中的离子平衡
李婧
2017年4月
第二节
水的电离和溶液的酸碱性
第三课时
酸碱中和滴定
酸
碱
中
和
滴
定
初试锋芒
亲临体会
成果展示
合作探究
酸
碱
中
和
滴
定
初试锋芒
亲临体会
成果展示
合作探究
用已知物质的量浓度的强酸或强碱来测定未知物质的量浓度的强碱或强酸。
2、原理:
H+
+
OH-
=
H2O
初试锋芒
思考一:酸碱中和滴定原理?
1、目的:
(1)准确量取待测NaOH溶液的体积
【思考二】:酸碱滴定的关键是什么?
(2)准确判断滴定终点
思考三:实验用品
1、仪器:
酸式滴定管、
碱式滴定管、
滴定管夹、
铁架台、
锥形瓶、
烧杯。
2、试剂
(1)标准液(1.0mol/L的盐酸)
待测液(NaOH溶液)
(2)适当的指示剂
(3)蒸馏水
红
橙
黄
红
紫
蓝
无色
粉红
红
注意:
石蕊不用做酸碱中和滴定的指示剂
思考四
酸碱滴定管的特点和使用要求
精确度:0.01mL
?
你读得准吗?
答案:25.60mL
酸
碱
中
和
滴
定
初试锋芒
亲临体会
成果展示
合作探究
用1.00mol/L的盐酸(标准液)滴定NaOH(待测)为例
1、酸碱中和滴定的操作步骤
1、查漏
滴定前的准备
5、注:向锥形瓶中加
入NaOH溶液20.00mL
2、洗涤、润洗(2~3次)
3、装液、排气泡
4、调节起始刻度、记录(两管)
6、加:加2~3滴指示剂
(并在瓶底衬一张白纸)
2、滴定过程
“三个动作”
左手控制旋塞,
右手摇晃锥形瓶,
眼睛注视锥形瓶内颜色的变化。
3、滴定终点的判断
最后一滴滴入时,溶液由红色变成无色,
且半分钟内不恢复红色。
用1.00mol/L的盐酸(标准液)滴定NaOH(待测)为例
当恰好中和(指示剂变色)时有:
nHCl=nNaOH
cHClVHCl=cNaOHVNaOH
4、数据处理
操作2~3次取平均值代入公式计算:
特别注意:滴定过程的数据偏差大的数据
可以直接舍弃!。
次
数
待测液体积(L)
标准液体积(L)
滴定前
滴定后
实际
平均值
1
2
酸
碱
中
和
滴
定
初试锋芒
亲临体会
成果展示
合作探究
酸
碱
中
和
滴
定
初试锋芒
亲临体会
成果展示
合作探究
合作探究:
达到滴定终点时,酸碱是否恰好完全反应?
由于酚酞变色范围是8.2------10.0,当溶液由红色变成无色时,只能说明溶液的PH值小于8.2,所以不一定恰好完全反应。
